人HO-1基因启动子区生物信息学分析*
王 凡,徐世明,古同男,王宏娟
(首都医科大学燕京医学院生物化学与分子生物学教研室,北京 101300)
人血红素加氧酶-1(hHO-1)是一种细胞保护酶,在内体广泛分布。血红素可被hHO-1催化降解成胆绿素、CO和亚铁离子[1]。研究表明,hHO-1与呼吸系统、消化系统、心血管系统、泌尿系统、神经系统等疾病发生、发展密切相关[1-2]。有报道称hHO-1启动子区(GT)n双核苷酸重复多态性与肿瘤关系密切,较短的(GT)n双核苷酸重复可能对食管鳞状上皮细胞癌的发生起抑制作用,而较长的(GT)n双核苷酸重复可能会增加患食管鳞状上皮细胞癌[2],口腔癌和心血管等疾病[3]的风险。本研究利用生物信息学方法,通过对hHO-1基因启动子转录因子结合位点及CpG岛的预测分析,探讨hHO-1启动子区与相关疾病的关系,旨在为今后研究hHO-1的生物学功能及调控机制提供有价值的信息。
1 材料与方法
1.1 材料
hHO-1基因及启动子序列信息的获取:美国国立生物技术信息中心(NCBI)数据库(https://www.ncbi.nlm.nih.gov/)。TATA盒预测网站:Softberry(http://linux1.softberry.com/berry.phtml?topic=tssw & group=programs & subgroup=promoter)。转录因子结合位点预测网站:PROMO(http://alggen.lsi.upc.es/cgi-bin/promo_v3/promo/promoinit.cgi?dirDB=TF_8.3),Gene regulation(http://gene-regulation.com/)。CpG岛位置预测网站:CpGFinder(http://www.softberry.com/berry.phtml?topic=cpgfinder & group=programs & subgroup=promoter),MethPrimer(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)。
1.2 方法
1.2.1hHO-1基因及其启动子序列的获取
在NCBI中搜索人HO-1基因,进入GenBank获取hHO-1基因序列。在Sequence text view中选取转录起始点上游3 000 bp的序列,将序列上传至Nucleotide BLAST中进行比对,推测出启动子序列长度。在Softberry中上传启动子序列,预测TATA盒。
1.2.2hHO-1启动子转录因子结合位点预测
登录PROMO网站,在SelectSpecies选项中选择Only human factors和Only human sites。点击SearchSites按钮,将启动子序列上传至对话框中,设置Maximum matrix dissimilarity rate参数为5。登录Gene regulation网站,选择AliBaba2.1程序,设置Min mat.conservation参数为80%,上传序列预测即可。
1.2.3hHO-1启动子CpG岛预测
登录MethPrimer网站,将Window值设置为200,其他数据为默认值(Obp/Exp=0.6,GC%=50),上传启动子和外显子1及部分内含子1序列进行预测。用CpGFinder预测CpG岛时使用默认设置预测即可,具体数值设置同上。
2 结 果
2.1 hHO-1基因及其启动子序列特点
Genbank中显示hHO-1基因位于22q12.3,包含5个外显子,登录号为NC_000022,基因全长13 112 bp,其转录出的mRNA全长为1 554 nt,基因蛋白质编码区(CDS)编码288个氨基酸。本研究选取转录起始点上游3 000 bp以内的DNA序列进行比对。Nucleotide BLAST比对结果显示,所选取DNA序列的第1 006位脱氧核苷酸与信息库中hHO-1基因启动子序列的第1位脱氧核苷酸比对上,可以确定hHO-1启动子区位于转录起始点上游1 995 bp以内,Genebank登录号为AF145047.1(图1)。Ⅱ类基因的启动子一般在转录起始位点上游-25~-30 bp附近存在TATA盒,富含AT序列,负责基因转录起始位点的定位,是RNA聚合酶的结合位点之一。Softberry预测结果显示,在hHO-1启动子序列第1 963 bp处(即转录起始点上游33 bp处)存在TATA盒,见图2。

图1 hHO-1启动子区Nucleotide BLAST比对结果

图2 hHO-1启动子区TATA盒
2.2 hHO-1启动子区转录因子结合位点预测结果
2.2.1PROMO预测结果
PROMO 3.0.2预测系统使用的是TRANSFAC数据库8.3版本,经预测并通过手工去重后得到57种转录因子结合位点(图3),图中显示出各种转录因子及其与启动子的结合位置,其中GR-alpha、Pax-5、p53、GR-beta、TFII-I、FOXP3、RXR-alpha、C/EBPbeta、STAT4、TFIID、AP-2alphaA、WT1等转录因子结合位点的重复次数较高。
2.2.2AliBaba2.1预测结果
AliBaba2.1在线预测软件使用的是TRANSFAC 4.0版本,经预测并通过手工去重后得到31种转录因子结合位点:AP-1、AP-2alpha、c-Myc、C/EBP、C/EBPalpha、C/EBPbeta、COUP、E1、ER、GATA-1、GLO、GCN4、Hb、HNF-1C、HNF-3、Id3、IRF-1、MEB-1、MyoD、NF-ATc3、NF-1、NF-kappaB、NF-muE1、Pit-1a、RAP1、RAR-alph、Sp1、T3R-alpha、TEC1、USF、YY1。将该结果与PROMO 3.0.2预测结果合并,经去重后共得到79种转录因子结合位点:AP-1、AP-2alph、AR、c-Ets-1、c-Ets-2、c-Fos、c-Jun、c-Myb、c-Myc、C/EBP、C/EBPalpha、C/EBPbeta、COUP、E1、E2F-1、Elk-1、ELF-1、ER、ER-alpha、FOXO4、FOXP3、GATA-1、GATA-2、GCN4、GCF、GLO、GR、GR-alpha、GR-betaHb、HNF-1C、HNF-3、HNF-3alpha、Id3、Ik-1、IRF-1、IRF-2、LEF-1、MEB-1、MyoD、NF-1、NF-AT1、NF-ATc3、NF-kappaB、NF-muE1、NF-Y、NFI/CTF、p53、Pax-5、PEA3、Pit-1a、PPAR-alpha∶RXR-alpha、PR-A、PR-B、PXR-1∶RXR-alpha、RAP1、RAR-alph、RAR-beta、RXR-alpha、Sp1、SRY、STAT1beta、STAT4、T3R-alpha、T3R-beta1、TBP、TEC1、TFII-I、TFIID、USF、USF1、USF2、VDR、WT1、WT1 I、WT1-KTS、WT1 I-KTS、WT1-del2、I-del2、YY1。预测结果中包括了两大类反式作用因子的结合位点。一类是通用转录因子(TF),其中TFII作用因子又包含TFIIA、TFIIB、TFIID和TFIIE,这些转录因子涉及RNA聚合酶、顺式作用元件和反式作用因子的相互作用,参与基因表达调控。第二类是特异转录因子,能对基本转录因子起增效作用,如SP1转录因子与启动子上GC盒结合后可使转录效率提高。
2.3 hHO-1启动子区CpG岛预测结果
2.3.1MethPrimer预测结果
CpG岛主要位于基因的启动子和第一外显子区域,是富含CpG二核苷酸的一些区域,约有60%以上的基因启动子区含有CpG岛。CpG岛不仅是基因的一种标志,而且还参与基因表达的调控。MethPrimer预测结果显示hHO-1启动子区CpG岛长307 bp,位于1 857~2 163 bp;跨越启动子区末端,外显子1及部分内含子1上游序列,具体细节见图4。

图3 PROMO 3.0.2转录因子结合位点预测结果
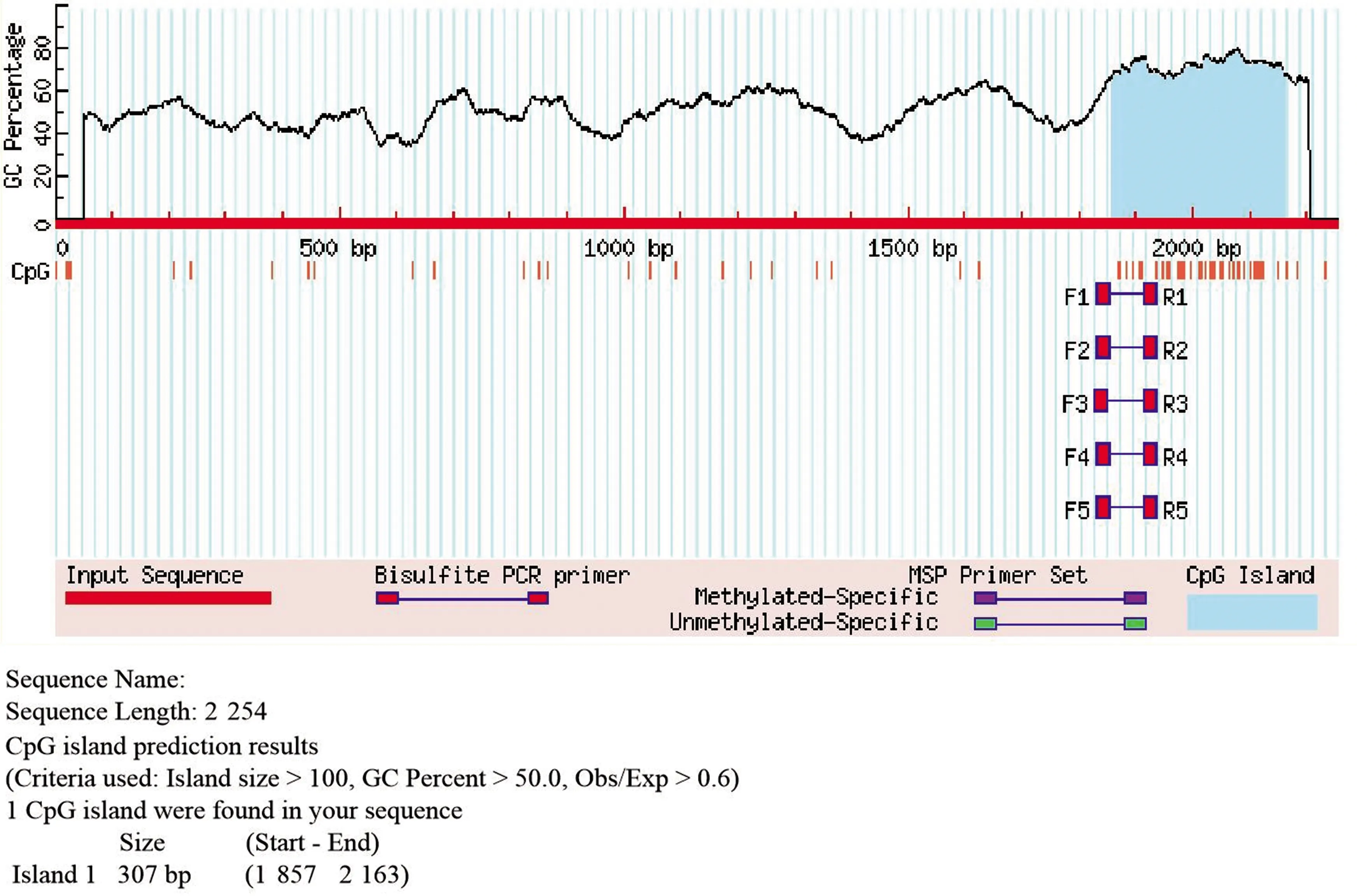
图4 MethPrimer CpG岛预测结果
2.3.2CpGFinder预测结果
在CpGFinder预测结果中同样也预测到hHO-1存在CpG岛,预测结果显示hHO-1启动子区CpG岛长259 bp,位于1 870~2 128 bp(图5);同样跨越启动子区末端,外显子1及部分内含子1上游序列,长度略短于MethPrimer的CpG岛预测结果。

图5 CpGFinder CpG岛预测结果
3 讨 论
hHO-1是一种具有免疫调节活性的防御酶,可被多种因素调控进而影响表达结果[4]。其C端被裂解后,可转移到细胞核内,参与由氧化应激介导的转录调节作用[5]。此外血红素经hHO-1催化降解的产物分别具有抗炎[6]、抗增殖[7]和促血管舒张活性[8]等作用。目前,关于hHO-1启动子的研究主要在启动子多态性与疾病关系方面的研究较多。本研究从hHO-1启动子转录因子结合位点入手,探讨其在抗逆方面的潜在作用。
通过在NCBI数据库中进行检索比对,获得了hHO-1转录起始位点上游1 995 bp的启动子区域。Softberry的预测结果与理论情况相符。经预测汇总后共得到79种转录因子结合位点。其中有多个转录因子已被证明与肿瘤、炎症、热应激有关,此外还有些转录因子是信号通路里的重要组分。如AP-1转录因子结合位点,属于激活蛋白家族成员结合位点,在生长因子、细胞因子、胁迫、病原菌等因素刺激下,AP-1被活化进而调节基因表达[9]。AP-1在恶性肿瘤及自身免疫病当中也有很重要的调控作用[10]。促氧化因子和促炎因子可刺激AP-1的表达上调,各种损伤性刺激可使AP-1上游的信号分子JNK和ERK分别磷酸化c-Jun和c-Fos,c-Jun和c-Fos被磷酸化后进入细胞核进而形成二聚体,与AP-1转录因子结合位点结合启动HO-1基因表达[11]。因此,hHO-1表现出的多种抗逆作用,可以通过其启动子含有众多转录因子结合位点来解释。
NF-κB是二聚体转录因子,属于Rel家族成员。当机体受到损伤性刺激时,NF-κB进入细胞核,与HO-1启动子上的NF-κB转录因子结合位点结合,启动HO-1基因转录,以应对损伤刺激[12]。E26转录因子1(ETS1)属于外转录间隔区(ETS)家族成员,ETS主要参与细胞的生长与分化及器官的形成,在人的血管生成过程中起到重要作用。ETS1可促进血管内皮细胞的迁移,在血管内皮受损后修复时ETS1表达量有所上调[13]。转录因子ETS1、c-Jun和LEF1能协同作用于孕丸X 受体基因的启动子区域,并增强该基因的表达[14]。转录因子LEF1的功能与ETS1相似,LEF1可促进血管内皮细胞的增殖及其在基质中的侵袭能力[15]。由此可见,一个基因可受到多种转录因子的调控,且转录因子之间存在协同作用。上述转录因子结合位点在hHO-1启动子区都已预测出来,但ETS1转录因子与hHO-1启动子之间的关系还未见报道,推测hHO-1可能与血管内皮细胞再生有一定关系。此外,在hHO-1启动子区未证实的转录因子结合位点还有多种,如c-Ets-2、c-Myb、ELF-1、GATA-1、Id3、LEF-1、MEB-1、NF-AT1等。在今后的研究中,可通过构建荧光素报告载体的方法证实其他转录因子结合位点,为更深入地了解hHO-1基因功能及转录调控机制奠定基础。
DNA甲基化是一种表观遗传修饰,可在组织特异性基因表达、X染色体失活、基因组印记、细胞增殖及衰老、胚胎发育等生物学进程中起重要作用。哺乳动物的DNA甲基化主要发生在转录起始点附近的CpG二核苷酸胞嘧啶残基上,即CpG岛。一般情况下,正常细胞的CpG岛由于被保护而处于非甲基化的状态。在肿瘤细胞中,抑癌基因的CpG岛表现为高甲基化,肿瘤抗原表达缺失,抑癌基因表达下调,最终导致肿瘤发生[16-17]。本研究预测结果显示,hHO-1基因的CpG岛位于启动子区末端,外显子1及部分内含子1上游序列,hHO-1表现出的多种功能可能与其CpG岛的甲基化状态有一定关系。针对CpG岛序列特点可以设计用于DNA甲基化分析的PCR引物,这还有待今后进一步实验分析。随着生物信息学的不断发展,关于启动子功能元件的预测将更准确可靠,可为研究基因的功能及转录调控提供更多有价值的信息。

