30例伴BCR-FGFR1融合基因阳性8p11骨髓增殖综合征患者诊疗分析*
赵一帆,苏永忠,白 雪,吴禹宏,冯志金,林绍泽,邢学仰
(汕头大学医学院第一附属医院血液科,广东汕头 515041)
8p11骨髓增殖综合征(EMS)是一类十分罕见的侵袭性血液系统恶性肿瘤。在2016年WHO修订的造血及淋巴组织肿瘤分类中EMS被定义为“伴嗜酸粒细胞增多和成纤维细胞生长因子受体1(FGFR1)重排的髓系/淋系肿瘤”[1]。目前已发现FGFR1与15种伙伴基因发生融合后导致EMS的发病,而不同类型的EMS也因为伙伴基因的不同而表现出明显的差异性[2-4]。本文将对1例类似T淋巴母细胞性淋巴瘤(TLBL)及慢性髓系白血病(CML)表现起病的伴B细胞受体(BCR)-FGFR1融合基因阳性EMS进行病例报道,并通过收集国内外共29例已发表的伴BCR-FGFR1阳性EMS病例[4-29],从一般资料、临床表现、治疗效果等方面总结其特征,以期对后续临床诊断及治疗提供参考。
1 资料与方法
1.1 一般资料
选取2020年2月本院血液内科就诊的伴BCR-FGFR1阳性EMS患者1例,通过病历检索的方式搜集其住院期间的临床资料、实验室检查结果,以及外送至第三方检验结构进行的细胞遗传学、分子生物学检查结果。
1.2 方法
以“8p11骨髓增殖综合征”“FGFR1重排”“8p11 myeloproliferative syndrome”“EMS”“BCR-FGFR1”“FGFR1 Rearrangement”为关键词在中国知网、万方、维普及Pubmed等数据库中检索1992-2020年已发表的文献。纳入标准:明确诊断的伴BCR-FGFR1阳性EMS。排除标准:(1)诊断依据不足;(2)病例资料欠缺过多;(3)无法获取全文。根据纳入、排除标准,共获取文献26篇,相关病例29例,发表时间为2001-2020年。采用病例资料回顾性分析方法,总结并分析文献报道的29例及本中心确诊的1例伴BCR-FGFR1阳性EMS患者初诊时外周血常规、骨髓细胞学、细胞遗传学、分子生物学等检查结果及治疗过程、预后等资料。随访截止时间为所纳入文献发表日期。总生存时间(OS)定义为 EMS诊断确立之日至死亡或随访截止时间。
2 结 果
2.1 本院确诊的1例伴BCR-FGFR1阳性EMS患者相关资料
患者,男,60岁,2020年2月发现双侧颈部肿物。至外院查血常规显示:白细胞153.40×109/L,单核细胞13.20×109/L,嗜酸性粒细胞(EOS)1.50×109/L,血红蛋白96 g/L,血小板101×109/L,遂至本院就诊。入院查体:轻度贫血貌。双侧颈根部、下颌区、左侧腹股沟区可扪及大小不等的多个肿大淋巴结,最大者约2 cm×3 cm,部分连接成片。右侧扁桃体Ⅲ°肿大,表面未见出血及脓点。胸骨无压痛。肝肋下1横指,脾肋下2横指。骨髓细胞学:增生极度活跃;粒系占78.50%,原粒细胞5.50%,EOS 2.00%,嗜碱性粒细胞0.50%;红系6.00%,形态轻度大小不均;淋巴细胞15.00%;巨核细胞21个/片,血小板散在或小簇分布;碱性磷酸酶(NAP)染色阳性率9.00%,积分9分;考虑CML骨髓象(图1A)。骨髓病理:骨髓轻度增生,伴B淋巴细胞反应性增生,可见少量T 淋巴母细胞;免疫组织化学(IHC)检测:CD20(部分+)、髓过氧化物酶(MPO,多数+)、CD235a(部分+)、CD3(个别+)、TDT(少量+)、CD117-、CD7(少量+),网状纤维组织染色1+,见图1B、C。右侧扁桃体病理:可见片状小至中等大小淋巴样细胞弥漫分布,部分可见小核仁;IHC:CD3+、CD7+、CD79a+、CD99+、TDT(部分+)、Ki-67(70%+)、CD20-、MPO-、CD15-、CD5-、PAX-5-、CD10-。考虑右侧扁桃体TLBL/白血病(图1D~I)。BCR/ABL融合基因基因检测:未检测到BCR/ABL1融合基因,检测到BCR基因数目异常。染色体核型:46,XY,t(8;22)(p11.2;q11.2)平衡易位,见图2。荧光原位杂交(FISH)检测到FGFR1基因重排(图3)。综合临床表现及实验室检查,最终诊断为伴BCR-FGFR1融合基因阳性的EMS。确诊后给予1个疗程CHOPE方案(环磷酰胺1.40 g第1天,长春地辛5 mg第1天,表柔比星130 mg第1天,泼尼松90 mg第1~5天,依托泊苷0.10 g 第2~6天)化疗。化疗后患者全身淋巴结均有不同程度缩小,出院后患者因个人原因未按时返院化疗并失访。
2.2 30例伴BCR-FGFR1阳性EMS患者的临床特征及诊疗情况
2.2.1患者基线资料
30例伴BCR-FGFR1阳性EMS患者中,男18例,女12例。年龄8~75岁,中位年龄为55.50岁。30例患者中,可查到初诊时外周血白细胞、血红蛋白、血小板计数的分别有30、30、28例,其中位值分别为52.30×109/L、106.50 g/L、142×109/L。20例患者病历资料中的外周血EOS中位值为0.80×109/L。19例可查到数据的患者外周血单核细胞中位值为1.60×109/L。30例患者的骨髓细胞学中,28例患者骨髓增生活跃,1例增生减退,1例未描述骨髓增生状态。可查到数据的28例患者骨髓中原始细胞数的中位值为17%。
2.2.2诊断资料 30例EMS患者的染色体核型分析均提示存在8号和22号染色体融合,其中13例患者所有受检的细胞均表现为t(8;22)(p11.2;q11.2);4例患者受检细胞中部分呈t(8;22)(p11.2;q11.2),部分呈正常核型;另有13例(43.33%)患者初诊时染色体核型即表现为合并有其他异常的复杂核型。27例患者使用FISH技术检测FGFR1基因重排的结果呈阳性,3例患者未行此项检查。17例患者通过逆转录PCR(RT-PCR)或sequence测序等方式在分子生物学层面明确了BCR及FGFR1的融合位点,另13例患者通过染色体核型分析及FISH等细胞遗传学检查明确诊断后未行上述检查。在30例患者中,有9例是以CML的临床表现起病,6例是类似急性淋巴细胞白血病(ALL)起病,5例表现为骨髓增殖性肿瘤(MPN),4例同时表现为ALL及MPN,表现为混合表型急性白血病/淋巴瘤(MPAL)和急性髓系白血病(AML)各有2例,剩余包括本中心新近确诊患者在内的2例表现为CML及TLBL同时起病。
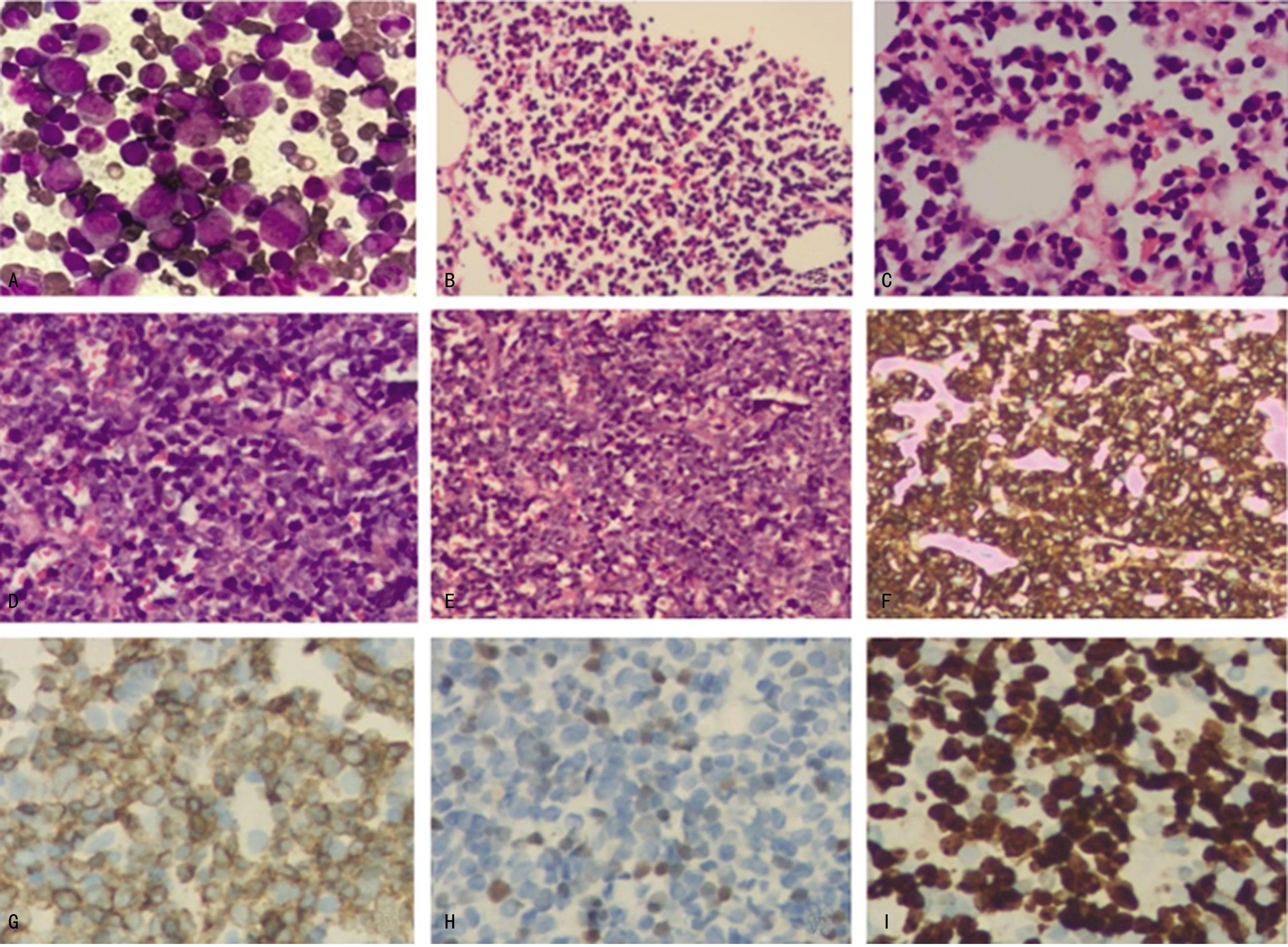
A:骨髓细胞学检查(瑞氏-吉姆萨染色,×1 000);B、C:骨髓病理学检查(苏木素-伊红染色,×40、×200);D、E:右侧扁桃体病理学检查(苏木素-伊红染色,×200、×40);F:右侧扁桃体肿瘤细胞CD7+(IHC,×100);G:右侧扁桃体肿瘤细胞CD3+(IHC,×200);H:右侧扁桃体肿瘤细胞TDT部分+(IHC,×200);I:肿瘤细胞Ki-67指数为70%+(IHC,×200)。
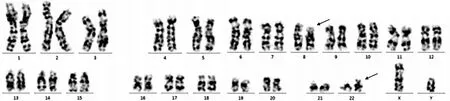
图2 特征性的t(8;22)(p11.2;q11.2)平衡易位(箭头所指)
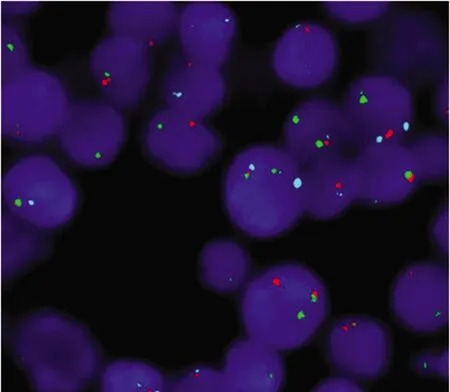
图3 特征性的FGFR1基因重排
2.3 治疗及预后分析
30例伴BCR-FGFR1阳性EMS患者中,14例患者接受了移植治疗[异基因造血干细胞移植(allo-HSCT)11例,单倍体造血干细胞移植(hap10-HSCT)2例,脐带血移植1例],在截止文献发表时11例存活,2例患者在疾病进展时接受抢救性移植仍无法逆转病情而死亡,1例患者移植复发后采用氟哒拉滨、阿糖胞苷、粒细胞集落刺激因子和去甲氧柔红霉素(FLAG-IDA)化疗,但最终因严重感染死亡。16例未行移植的患者中8例存活,8例死亡。初诊时具有复杂核型异常的13例患者在截止文献发表时的病死率为53.85%(7/13),非复杂核型异常组病死率23.53%(4/17)。27例患者可查到的随访时间为2~60个月,中位随访时间为10个月。其中13例接受移植患者中位OS为22.00个月(2~60个月),14例未行移植患者中位OS为6.00个月(2~31个月)。13例初诊具有复杂核型异常患者中位OS为9.00个月(2~60个月),14例非复杂核型异常组患者中位OS为16.50个月(2~31个月)。但考虑病例较少且不同文献报道的随访时间差异性较大,未能进行有效的统计学分析。
3 讨 论
EMS的定义最早是由MACDONALD等[30]在1995年总结并提出的一类伴有EOS增多和淋巴结肿大的慢性骨髓增殖性肿瘤,多数患者在短时间内进展为AML或淋巴母细胞淋巴瘤/白血病,并具有特异性的染色体8p11易位。EMS的具体发病机制尚未明确,分子学研究显示位于8号染色体短臂(8p11)上的FGFR1基因发生断裂重排后,与不同的伙伴基因发生相互易位而产生融合基因。融合基因会以非配体依赖方式介导FGFR1胞内部分二聚化,并持续性地激活酪氨酸激酶活性,导致下游多条信号传导途径受到影响,并使细胞异常增殖而最终导致肿瘤的发生[2]。在目前已报道的超过100例EMS病例中,来自不同染色体的伙伴基因与FGFR1大部分以平衡易位的形式产生融合基因,偶有插入易位形式的病例报道[2-3]。目前统计显示,接近半数的EMS患者检测出ZNF198-FGFR1融合基因阳性,伴BCR-FGFR1阳性的病例数次之。EMS根据融合基因的不同可表现出不同的起病特点:伴ZNF198-FGFR1阳性EMS常表现为淋巴结肿大和TLBL;伴CEP110-FGFR1阳性EMS常以扁桃体肿大、皮疹、浅表淋巴结及肝脾肿大等表现及类似慢性粒单核细胞性白血病的骨髓象起病;伴FGFR1OP-FGFR1阳性EMS常合并有红细胞增多;伴MYO18A-FGFR1阳性EMS有外周血白细胞、中性粒细胞、嗜碱性粒细胞增多及骨髓象类似CML的特点[2,31-33]。伴BCR-FGFR1阳性EMS患者区别于其他类型的部分主要有:(1)发病年龄较大,中位年龄接近60岁;(2)外周血白细胞、中性粒细胞、嗜碱性粒细胞计数增多及EOS计数降低;(3)骨髓象类似CML;(4)通常不伴有淋巴结肿大[2,10-11]。本中心新近确诊的1例伴BCR-FGFR1阳性EMS患者同时具有骨髓象类似CML、扁桃体肿大、淋巴结肿大且淋巴结病理活检及IHC结果接近TLBL的特点,实属罕见。
本研究纳入的30例患者完善染色体核型分析后均提示存在8号和22号染色体融合,其中17例患者表现为全部或部分受检细胞染色体发生t(8;22)(p11.2;q11.2)的平衡易位,13例患者合并其他异常的复杂核型。有研究指出,具有复杂核型的伴BCR-FGFR1阳性EMS患者相较于单纯发生8号和22号染色体异位的患者进展为急性白血病风险更大,这类患者接受HSCT后也有更大的复发概率[11]。本研究统计后也发现在截止文献发表时,复杂核型组患者相较非复杂核型组病死率更高(53.85%vs.23.53%),中位OS更短(9.00个月vs.16.50个月)。EMS患者染色体核型检测到特异性异常及FISH技术发现FGFR1基因重排即可确诊。目前有研究通过RT-PCR或基因测序的方法检测出BCR-FGFR1融合基因多发生于BCR的4号外显子和FGFR1的9号外显子上[6],但KONISHI等[7]报道,部分患者BCR-FGFR1的融合片段来自BCR的1、2号外显子和FGFR1的2、3号外显子之间。更深层次的分子生物学检测可能会对伴BCR-FGFR1阳性EMS患者的治疗和预后提供新的判断依据。
EMS的预后极差,allo-HSCT是目前公认唯一有效的治疗手段,多数未接受移植的患者在起病1年内即因疾病进展而死亡[2,34]。在EMS慢性期时采用羟基脲、干扰素或以Hyper-CVAD为代表的化疗可能部分有效但无法达到细胞遗传学层面的完全缓解,如无序贯移植治疗病情多在4~6个月发生进展,而接受移植患者中位OS大于未接受移植组患者(22个月vs. 6个月)。目前关于EMS治疗的研究多聚焦在靶向药物如FGFR1酪氨酸激酶抑制剂上。CHASE等[35]指出Ponatinib可通过抑制FGFRl激酶活性并影响下游通路激活进而抑制细胞增殖、促进细胞凋亡。有研究提取伴BCR-FGFR1阳性EMS患者的原代细胞进行药物抑制试验发现,Ponatinib、Dovitinib、Dasatinib均能在不同程度上抑制细胞生长[12]。KHODADOUST等[15]更是通过移植后序贯使用Ponatinib维持治疗,成功地使1例伴BCR-FGFR1阳性EMS进展为MPAL的患者持续性地达到完全缓解状态。此外,目前还有FGFR1-3 激酶抑制剂Pemigatinib、胰岛素样生长因子1受体抑制剂GSK1838705A等药物应用于EMS患者治疗后被证实有效[6,36]。
综上所述,EMS是一种罕见的伴有EOS增多的血液系统恶性肿瘤,常因其临床起病表现多变易被误诊为其他疾病。伴BCR-FGFR1阳性EMS患者具有不同于其他类型的起病特点,一旦染色体核型发现特异性的8号和22染色体融合即可确诊。EMS患者尤其是伴有复杂核型异常者预后极差且对常规化疗不敏感,条件允许时应尽早行allo-HSCT治疗。FGFR1酪氨酸激酶抑制剂为不能耐受移植和移植后需行巩固维持治疗的患者提供了一种新的治疗选择。

