miR-92a-3p靶向调控NOTCH信号通路对T-ALL细胞增殖的影响机制
胡敏利,应双伟,罗文达
(温州医科大学附属台州医院血液肿瘤内科,浙江台州 317000)
急性淋巴细胞白血病(ALL)是一种儿童常见的血液系统恶性肿瘤,其中约有15%为急性T淋巴细胞白血病(T-ALL)[1-2],而T淋巴细胞恶性增殖是T-ALL的重要特征之一[3-4]。微小RNA(miRNA)是一类广泛存在于真核生物体内的非编码RNA,可通过靶向相关基因调控细胞增殖,与包括T-ALL在内的多种疾病的发生、发展密切相关[5-8]。miR-92a-3p在T-ALL中异常低表达[9],但其是否参与T-ALL细胞增殖过程并不清楚。本研究通过上调和下调miR-92a-3p表达观察miR-92a-3p对T-ALL SupT1细胞增殖的影响,并探讨其可能的分子机制,旨在揭示miR-92a-3p在T-ALL发病中的作用。
1 材料与方法
1.1 材料
miR-92a-3p模拟物及其抑制剂(货号:M-01-S、M-02,上海吉玛),果蝇翅膀边缘出现缺口(NOTCH)信号通路相关蛋白NOTCH1、Jagged1、Hes1和β-肌动蛋白(β-actin)抗体(货号:ab194123、ab85763、ab108937、ab179467,英国Abcam),噻唑蓝(MTT)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶制备试剂盒(货号:M8180、P1200,北京索莱宝),SYBR Premix Ex Taq试剂盒(货号:DRR420A,日本TAKARA)。
1.2 方法
1.2.1分组与处理
实验分为4组,未转染组:正常培养;阴性对照组:转染阴性对照;模拟物组:转染miR-92a-3p模拟物;抑制剂组:转染miR-92a-3p抑制剂,每组设置3个复孔。将T-ALL SupT1细胞解冻复苏后,用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI-1640培养基在5% CO2、湿度饱和的37 ℃恒温培养箱内培养。将对数生长期的SupT1细胞种植到6孔板上后,培养至70%~80%融合度时,按照脂质体2000说明书根据实验分组分别将miR-92a-3p模拟物、miR-92a-3p抑制剂和阴性对照转染至SupT1细胞中。转染48 h后,收集各组细胞进行后续实验。
1.2.2实时荧光定量PCR(RT-qPCR)检测
Trizol试剂提取细胞总RNA,行逆转录;以逆转录产物为模板,根据上海生工生物合成的引物,上RT-qPCR仪进行扩增,具体步骤参照SYBR Premix Ex Taq试剂盒说明书。以U6为内参,采用2-ΔΔCt法计算miR-92a-3p表达水平。实验重复3次。引物序列,miR-92a-3p正向:5′-CAC TTG TCC CGG CCT GTA AA-3′,反向:5′-TAT TGC ACT TGT CCC GGC CTG-3′;U6正向:5′-GCT TCG GCA GCA CAT ATA CTA AAA T-3′,反向:5′-CGC TTC ACG AAT TTG CGT GTC AT-3′。
1.2.3MTT检测
将对数生长期的SupT1细胞种植到96孔细胞板上后,培养至70%融合度时,按照1.2.1中的分组处理细胞;转染24、48、72、96 h后,每孔加入MTT工作液孵育4 h;再加入二甲基亚砜工作液震荡反应15 min。采用多功能酶标仪在450 nm波长处检测各组细胞光密度值。实验重复3次。
1.2.4流式细胞仪检测
收集各组SupT1细胞,以预冷的磷酸盐缓冲液(BPS)漂洗2遍后,在4 ℃下使用70%乙醇固定过夜;BPS漂洗后,加入核糖核酸酶A避光温浴30 min;经碘化丙啶4 ℃下染色30 min后,上流式细胞仪检测各组细胞周期分布情况。实验重复3次。
1.2.5Western blot检测
抽提待测SupT1细胞总蛋白后,采用考马斯亮蓝染色法检测蛋白浓度与纯度。将变性后的蛋白样品行SDS-PAGE电泳后,转膜;室温下以5%脱脂奶粉封闭2 h后,加入一抗工作液(NOTCH1 1∶800、Jagged1 1∶200、Hes1 1∶200和β-actin 1∶1 000)孵育2 h;室温下辣根过氧化酶标记的二抗(1∶2 000)孵育2 h后,使用化学发光剂显影,以β-actin为内参,采用凝胶成像分析系统扫描分析SupT1细胞中NOTCH1、Jagged1和Hes1蛋白表达水平。实验重复3次。
1.2.6双荧光素酶报告基因(DLR)实验
将与miR-92a-3p互补结合的NOTCH1 3′UTR序列片段及定点突变后的NOTCH1 3′UTR序列片段克隆重组至pGL3-basic荧光素酶报告基因载体上,分别作为NOTCH1野生型(NOTCH1-Wt)和NOTCH1突变型(NOTCH1-Mut)载体质粒。将NOTCH1-Wt、NOTCH1-Mut分别与阴性对照、miR-92a-3p模拟物、miR-92a-3p抑制剂共转染至SupT1细胞中,其中每组设3个复孔。转染48 h后,检测各组细胞荧光素酶活性,具体步骤参照DLR检测试剂盒说明书。实验重复3次。
1.3 统计学处理
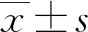
2 结 果
2.1 各组SupT1细胞中miR-92a-3p表达水平比较
未转染组、阴性对照组、模拟物组、抑制剂组细胞中miR-92a-3p表达水平分别为0.97±0.07、1.02±0.09、16.48±2.16、0.19±0.02。与未转染组比较,阴性对照组SupT1细胞中miR-92a-3p表达水平差异无统计学意义(P>0.05);与阴性对照组比较,模拟物组SupT1细胞中miR-92a-3p表达水平明显升高,而抑制剂组SupT1细胞中miR-92a-3p表达水平明显降低(F=478.458,P<0.001)。
2.2 各组SupT1细胞增殖活力比较
与未转染组比较,阴性对照组不同时间SupT1细胞增殖活力无明显变化(P>0.05);与阴性对照组比较,模拟物组48、72、96 h后SupT1细胞增殖活力明显减弱,而抑制剂组48、72、96 h后SupT1细胞增殖活力明显增强(P<0.05),见表1。
2.3 各组SupT1细胞周期分布情况
与未转染组比较,阴性对照组SupT1细胞在G0/G1期、S期和G2/M期所占百分比比较差异无统计学意义(P>0.05);与阴性对照组比较,模拟物组SupT1细胞在G0/G1期所占百分比明显升高,且在S期和G2/M期所占百分比明显降低(P<0.05);而抑制剂组SupT1细胞在G0/G1期所占百分比明显低于阴性对照组,且在S期和G2/M期所占百分比明显高于阴性对照组(P<0.05),见图1、表2。
2.4 各组SupT1细胞中NOTCH信号通路相关蛋白表达水平比较
与未转染组比较,阴性对照组SupT1细胞中NOTCH信号通路相关蛋白NOTCH1、Jagged1和Hes1表达水平差异均无统计学意义(P>0.05);与阴性对照组比较,模拟物组SupT1细胞中NOTCH1、Jagged1和Hes1表达水平明显降低(P<0.05),而抑制剂组SupT1细胞中NOTCH1、Jagged1和Hes1表达水平明显升高(P<0.05),见图2、表3。

表1 各组SupT1细胞增殖活力比较
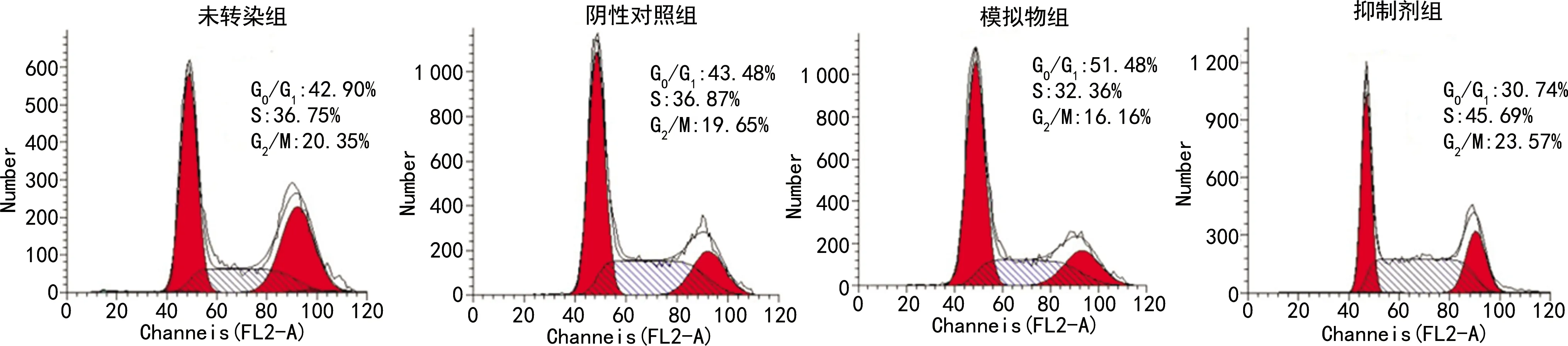
图1 流式细胞仪检测各组SupT1细胞周期分布情况

表2 各组SupT1细胞周期分布情况比较

1:未转染组;2:阴性对照组;3:模拟物组;4:抑制剂组。
2.5 miR-92a-3p和NOTCH1靶向关系预测及验证
miR-92a-3p与NOTCH1 3′UTR存在互补的结合位点(图3)。与阴性对照和NOTCH1-Wt共转染细胞比较,miR-92a-3p模拟物和NOTCH1-Wt共转染细胞的荧光素酶活性明显降低,而miR-92a-3p抑制剂和NOTCH1-Wt共转染细胞的荧光素酶活性明显升高(P<0.05);但miR-92a-3p模拟物和miR-92a-3p抑制剂对转染NOTCH1-Mut细胞的荧光素酶活性无明显影响(P>0.05),见表4。

表3 各组细胞NOTCH1、Jagged1及Hes1蛋白表达水平比较

表4 各组细胞荧光素酶活性比较
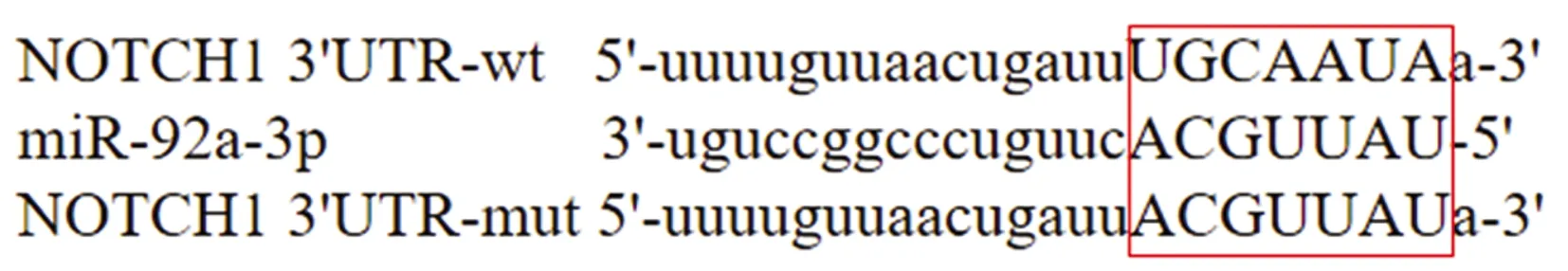
图3 miR-92a-3p与NOTCH1靶向结合位点
3 讨 论
T-ALL中细胞增殖影响疾病进程,因此,发现影响T-ALL的基因对于T-ALL疾病治疗意义重大。miRNA作为短RNA序列,在疾病发生、发展过程中发挥重要作用,其中miR-92a-3p是miR-17-92家族成员,可通过调控细胞生物学行为参与多种疾病的发生、发展[10];有研究发现,在结直肠癌中miR-92a-3p表达受阻可减弱癌细胞增殖能力,miR-92a-3p可能是结直肠癌治疗的重要靶点[11];miR-92a-3p可抑制前体脂肪细胞增殖和促进细胞分化,与肥胖症的发生密切相关[12]。有学者在T-ALL中发现miR-92a-3p表达下调[9],但作用机制尚不清楚。本研究中发现,上调miR-92a-3p人T-ALL SupT1细胞增殖活力明显降低,G0/G1期所占百分比明显升高;下调miR-92a-3p后SupT1细胞增殖活力明显增强,且细胞在S期和G2/M期所占百分比明显升高。表明上调miR-92a-3p可通过诱导细胞周期阻滞于G0/G1期抑制SupT1细胞增殖,而下调miR-92a-3p可通过加速细胞周期于S期促进SupT1细胞增殖。提示miR-92a-3p可能通过调控细胞增殖在T-ALL发生、发展过程中发挥着作用。
NOTCH信号通路是细胞内重要的信号转导途径之一,可激活下游Hes家族和p21等靶基因,进而在细胞增殖、分化和凋亡等过程中发挥着重要作用[13-14],且与T-ALL的发生、发展密切相关。NOTCH信号通路的活化在T-ALL细胞增殖过程中发挥着重要的促进作用[15]。靶向抑制NOTCH1表达可影响下游相关基因转录,诱导细胞周期阻滞于G0/G1期,抑制细胞增殖[16]。本研究发现,上调miR-92a-3p表达可引起SupT1细胞中NOTCH1、配体Jagged1及下游Hes1蛋白表达水平明显降低,而下调miR-92a-3p表达则出现相反的结果。提示在T-ALL中miR-92a-3p可能通过抑制NOTCH信号通路活化进而发挥抑制细胞增殖的作用。miR-92a-3p与NOTCH1 3′UTR存在互补的结合位点。提示miR-92a-3p可能通过靶向NOTCH1抑制NOTCH信号通路活化进而抑制细胞周期阻滞于G0/G1期,从而抑制T-ALL细胞增殖。
综上所述,miR-92a-3p靶向调控NOTCH信号通路诱导细胞周期阻滞,进而发挥抑制SupT1细胞增殖的作用,本文验证miR-92a-3p在T-ALL中的机制,以为临床上miR-92a-3p的靶向治疗提供依据。

