MTA1通过HIF-1α上调MTDH基因表达促进肺癌细胞增殖与活力*
杨淑慧,周 琳,李银珍,廖罗飞,谭彩云,丁 宇,杜日昌
(汕头大学医学院附属粤北人民医院:1.病理科;2.胸外科,广东韶关 512025)
肿瘤转移相关蛋白1(MTA1) 在肿瘤增殖、转移和侵袭等方面发挥重要的调控作用,被视为肿瘤发生、发展过程中的关键分子,其主要作用机制是通过募集组蛋白去乙酰化酶复合物于靶基因的启动子序列进行转录水平的调控[1]。而最早发现于乳腺癌患者的异黏蛋白(MTDH),又名星形胶质细胞上调基因1(AEG-1),也与肿瘤发生、侵袭、转移关系密切,并在乳腺癌、肝癌、前列腺癌等肿瘤中呈现高表达,MTDH表达水平与肿瘤病理分级、分期、复发呈正相关[2-4]。然而,MTA1和MTDH在肺癌中表达水平及二者之间是否存在相关性,目前尚不明确,本研究围绕上述问题展开研究。
1 资料与方法
1.1 一般资料
本研究所采用组织标本来源于2018年1月至 2019年12月于本院胸外科确诊肺癌并行手术切除的Ⅰ~Ⅲ期癌组织石蜡包埋固定标本,选取50份肺癌标本肿瘤组织与癌旁组织(距瘤体边缘大于3 cm),其中腺癌32例,鳞癌16例,小细胞肺癌2例。
1.2 方法
1.2.1细胞株及主要试剂
(1)细胞株:肺腺癌细胞系A549购自中科院上海细胞库,小细胞肺癌细胞系SBC-5购自ATCC细胞库。MTA1干扰序列(siRNA)、MTA1过表达质粒由上海吉玛基因公司设计合成。 (2)主要试剂:RNA组织保存液、组织蛋白抽提试剂盒、二喹啉甲酸(BCA)法蛋白浓度测定试剂盒、脂质体3000、蛋白质免疫沉淀法试剂盒均购自赛默飞世尔科技(中国)有限公司; RNAiso试剂、PrimeScript RT Master Mix,TB Green Premix Ex Taq Ⅱ购自日本TaKaRa公司;抗-MTDH抗体购自英国Abcam公司;抗-MAT1、抗-缺氧诱导因子-1α(HIF-1α)、抗-增殖细胞核抗原(PCNA)、抗-β-actin抗体购自上海帛龙生物科技公司;二抗及二氨基联苯胺(DAB)染色液购自罗氏诊断产品(上海)有限公司;胎牛血清购自美国Gibco公司;CCK-8 试剂购自碧云天生物技术公司;抑制剂CAY10585购自英国Abcam公司。
1.2.2免疫组织化学(IHC)检测
利用切片机制成厚度约4 μm的石蜡切片备用。将石蜡切片进行二甲苯脱蜡、梯度乙醇复水处理,采用柠檬酸盐缓冲液微波加热法进行抗原修复。3%过氧化氢灭活处理后经羊血清封闭4 h后,抗体(MTA1抗体、MTDH抗体)稀释后4 ℃孵育过夜。漂洗后二抗孵育2 h,行DAB染色,并复染细胞核,显微镜下拍照。IHC染色评分根据染色程度给予0~5分,每张切片由3名人员独立评分,取平均分进行统计学分析。
1.2.3RNA提取及实时荧光定量PCR检测
所取组织标本置于RNA组织保存液中,避免RNA降解。转移至实验室后采用化学试剂法提取总RNA,并采用逆转录试剂盒将RNA逆转录为cDNA,具体操作参见说明书进行。采用荧光嵌合PCR法检测目的基因的相对表达水平。
1.2.4蛋白质提取与蛋白Western blot实验
组织蛋白抽提试剂加入1%的蛋白酶和磷酸酶抑制剂,4 ℃下匀浆并离心保留上清液。BCA法测定蛋白浓度,并稀释蛋白浓度至2 μg/μL。蛋白煮沸进行变性处理,然后进行蛋白电泳、转膜、封闭、抗体孵育、漂洗后行化学发光显色。
1.2.5细胞培养与转染
A549、SBC-5用含10%胎牛血清的DMEM-F12培养基进行培养。当细胞密度达到80%~90%时进行细胞转染,siRNA和过表达质粒转染条件按照脂质体3000说明书进行处理,转染48 h后收集细胞进行后续实验。
1.2.6细胞活力测定
收集转染48 h后的各组细胞,接种至96孔板,调整细胞浓度约每孔5×103个细胞,每组设4个复孔,将培养板置于37 ℃,5% CO2的培养箱培养24 h,每孔中加入10 μL的CCK-8试剂后孵育2 h,用酶标仪记录450 nm波长处吸光度。
1.2.7乙酰化蛋白的富集
采用抗乙酰化蛋白的抗体富集样本中所有乙酰化的蛋白,然后采用MTDH抗体进行检测,得到乙酰化的MTDH水平。乙酰化蛋白的免疫沉淀采用磁珠法进行,具体操作参考说明书。
1.3 统计学处理
实验数据采用Graphpad Prism8.0统计软件进行分析,相关性分析采用线性回归分析,两组间差异比较采用t检验,多组间比较采用方差分析加每组间差异分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组标本组织中MTA1、MTDH表达水平比较
IHC染色结果显示,MTA1、MTDH在癌旁组织表达水平较低,而在癌组织中高表达,且二者表达水平存在正相关(r2=0.809 3),见图1。实时荧光定量PCR检测结果显示,癌组织中MTA1、MTDH的mRNA表达水平明显增高(P<0.001),且二者的mRNA表达水平存在正相关(r2=0.774 1),见图2。Western blot实验显示,MTA1、MTDH在癌组织中高表达,且二者的表达水平正相关(r2=0.551 9),见图3。
2.2 肺癌细胞系中MTA1对MTDH表达水平的影响
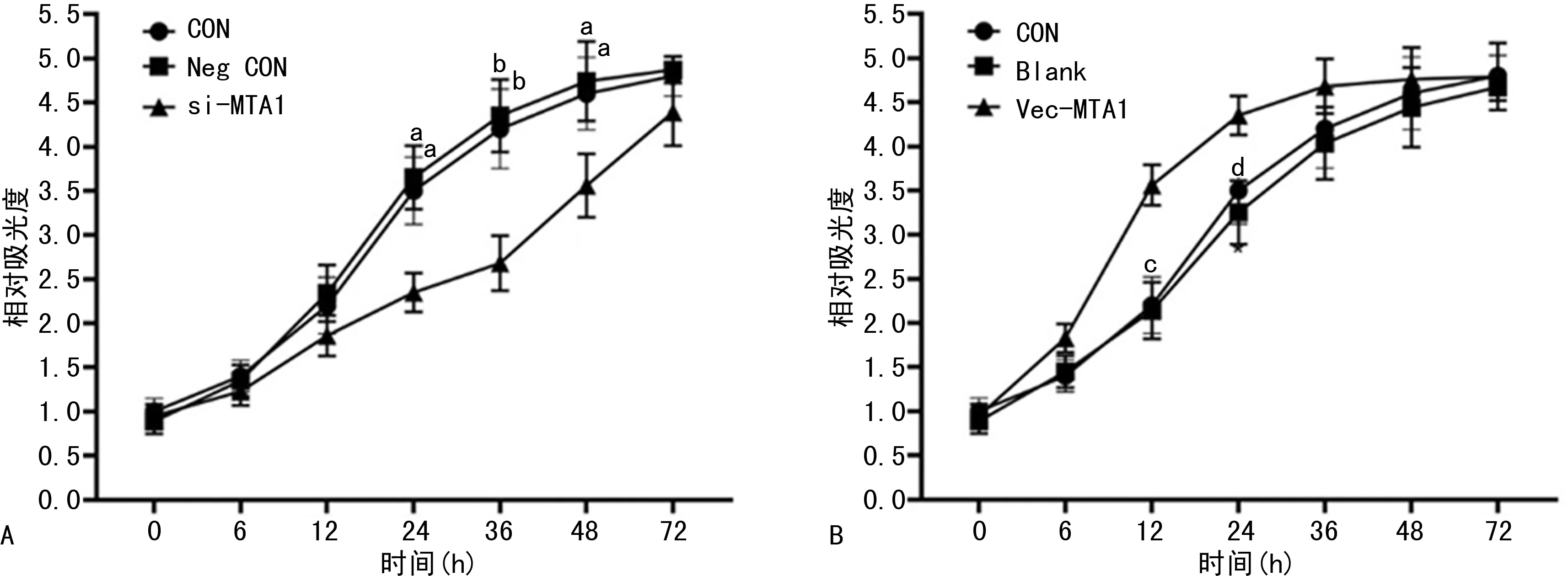
Western blot实验结果显示,在A549和SBC-5中,转染MTA1干扰序列抑制MTA1表达的同时也引起MTDH、PCNA蛋白表达下降,见图4。CCK-8实验结果显示,转染MTA1干扰序列后的A549细胞活力下降。相反,转染过表达MTA1质粒的A549和SBC-5细胞,MTA1表达上调的同时,MTDH和PCNA的表达均呈现上调,见图5。CCK-8实验结果显示,抑制MTA1表达后A549细胞活力受抑制,过表达MTA1时A549细胞活力增强,见图6。
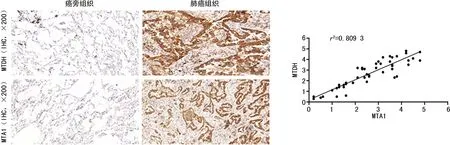
图1 两组标本组织中MTA1、MTDH的表达水平及肺癌组织中MTA1、MTDH表达水平相关性分析
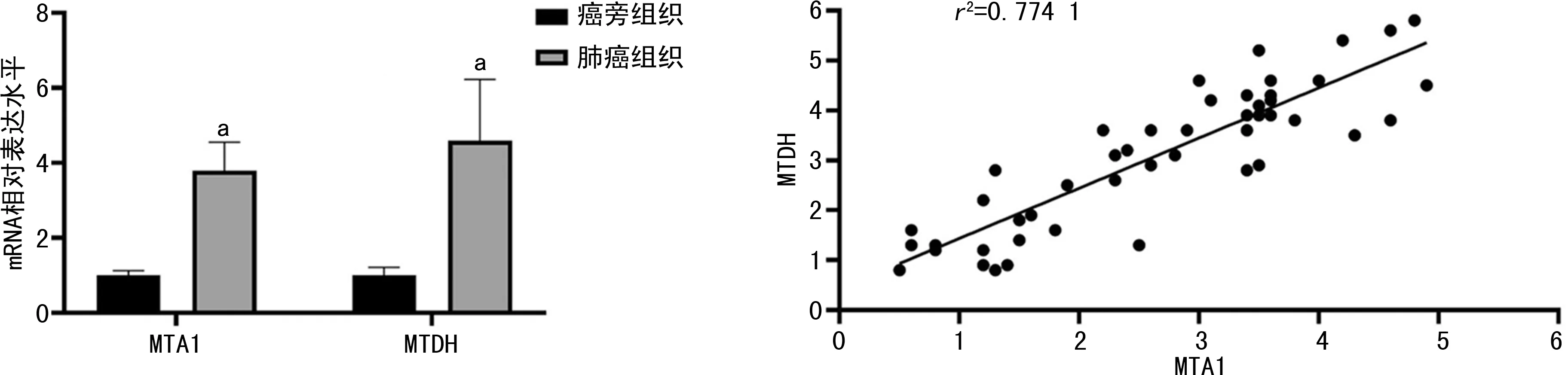
a:P<0.001,与癌旁组织比较。

a:P<0.05,与癌旁组织比较。
2.3 MTA1通过非直接乙酰化修饰途径上调MTDH的表达
在A549细胞系中过表达MTA1后MTDH表达上调,但Western blot实验分析显示,过表达MTA1并未影响MTDH的乙酰化水平,见图7。
2.4 MTA1通过HIF-1α上调MTDH的表达
Western blot实验结果显示,过表达MTA1引起A549细胞的HIF-1α表达上调,而抑制MTA1引起A549细胞的HIF-1α表达下调。给予HIF-1α通路抑制剂CAY10585(5 μmol/L),结果显示CAY10585可以减弱MTA1对MTDH表达的促进作用,见图8。
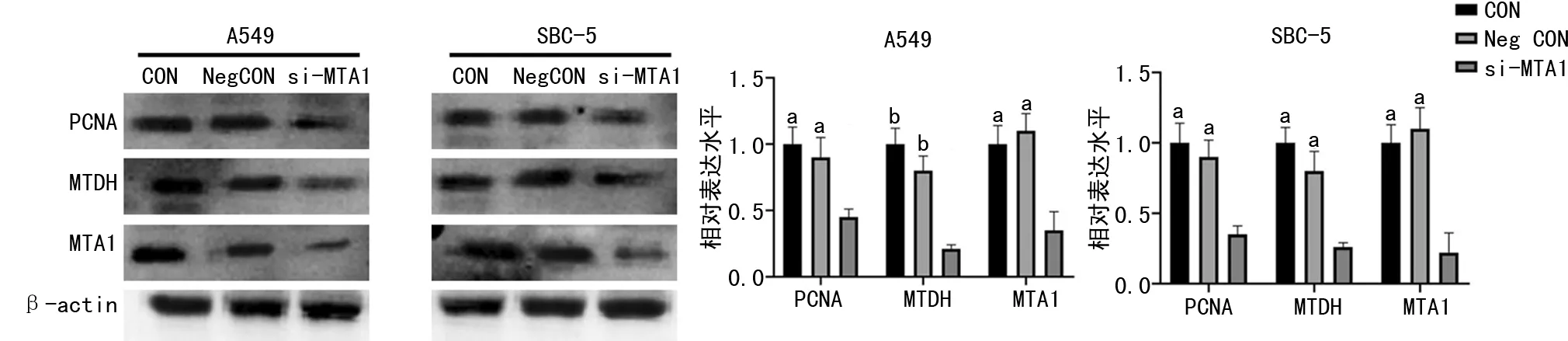
a:P<0.05,b:P<0.01,与si-MTA1比较。
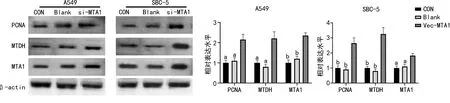
a:P<0.05,b: P<0.01,与Vec-MTA1比较。
a:P<0.05,b: P<0.01,与si-MTA1比较,c:P<0.01,d:P<0.05,与Vec-MTA1比较。

图7 A549细胞中MTA1对MTDH乙酰化水平的影响
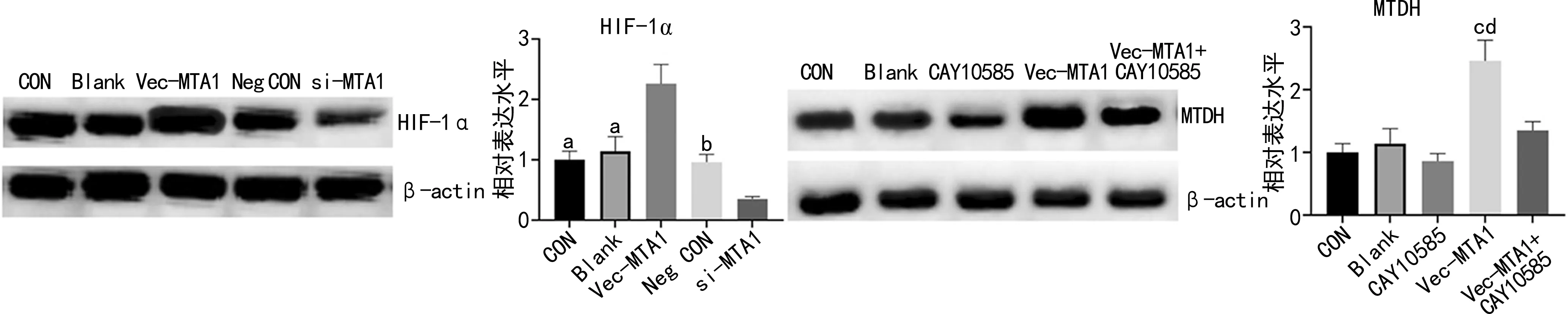
a:P<0.05,与Vec-MTA1比较;b:P<0.05,与si-MTA1比较;c:P<0.01,与CAY10585比较;d:P<0.05,与Vec-MTA1+CAY10585比较。
3 讨 论
MTA1、MTDH作为“促癌蛋白”在多种恶性肿瘤,如肺癌、结肠癌、乳腺癌、胶质瘤和头颈鳞状细胞癌中被充分证明。肿瘤中MTA1、MTDH表达水平的异常可能介导了肿瘤的增殖、进展和对放化疗的敏感性[5-7]。
本研究收集了50份手术切除的肺癌组织标本,经IHC染色、实时荧光定量PCR和Western blot实验证实了肺癌组织中MTA1、MTDH表达上调,且二者的表达呈正相关。细胞学实验证实MTA1正向调控MTDH在肺癌细胞系中的表达,然而这种调控作用并非通过直接乙酰化调节实现的,而是可能通过增强HIF-1α的表达,间接上调了MTDH的表达。本研究证实了MTA1、MTDH在肺癌中的调控关系,发现MTA1通过HIF-1α-MTDH通路促进肺癌细胞增殖的作用,可为后续肺癌的靶点特异性治疗打下基础。
基因表达调控是通过募集大分子调控复合物到特定的基因位点修饰DNA和组蛋白的表观调控位点,进而影响染色质结构实现。MTA1是核小体重构和去乙酰酶复合物(NuRD)的一个重要组成部分[8]。MTA1包括4个特征性的结构域、一系列相互作用的模体和部分无序的区域。ELM2-SANT域是MTA1的最具特征性的区域之一,招募组蛋白去乙酰酶1(HDAC1)并磷酸肌醇存在的情况下激活该酶[9]。MTA蛋白调节一系列癌症促进过程,包括侵袭、上皮间质转化、DNA损伤反应、血管生成、转移和耐药[6]。从机制上讲,MTA蛋白在癌细胞中的这些不同作用主要是通过调控靶基因表达和(或)调控MTA相互作用蛋白的活性而实现。如MTA1的上调通过刺激转化生长因子β(TGF-β)、ErbB2和转录激活因子3(STAT3)信号通路,或者作为核内原癌基因(c-Myc)介导转化的下游效应因子及拮抗肿瘤抑制因子p53等途径促进肿瘤发生过程[10-11]。本研究结果发现,MTA1在肺癌中高表达,也提示MTA1可能是肺癌发生的关键调控分子,并且体外实验也证实抑制MTA1可明显抑制肺癌细胞的增殖和活力。
MTDH是肿瘤研究中的热点分子,因为其在多种肿瘤中高表达而在正常组织中表达量很低,提示MTDH参与肿瘤的发生并且具有成为肿瘤生物标志物的潜能[12]。另外,有研究对比分析了不同临床分期的肿瘤中MTDH的表达水平,结果提示MTDH的高表达与增殖、转移和预后不良密切相关[13]。功能分析研究发现,MTDH的表达受多种信号通路调控,其中较为关键的是磷脂酰肌醇3激酶(PI3K)-蛋白激酶β(Akt)和糖原合成酶激酶3β(GSK-3β)通过ras信号通路激活经典的原癌基因c-Myc,随后导致MTDH的高表达[14]。另有研究发现,MTDH的高表达还与肿瘤的化疗药物耐药有关,人为抑制MTDH的表达能增强肿瘤细胞对顺铂、培美曲塞等化疗药物的敏感性[15-16]。
MTA1与MTDH相关性的研究多集中于下游共有的多个靶基因调控,二者具有相同的下游信号通路,到目前为止,MTA1直接调控MTDH基因表达的证据尚无报道。本研究分别通过抑制和过表达肺癌细胞系A549和SBC-5中MTA1的表达,检测MTDH、PCNA表达水平,结果显示MTA1对MTDH、PCNA的表达具有正向调控作用。本研究进一步验证这种调控作用是否通过直接乙酰化修饰实现,实验结果显示,MTA1对MTDH的乙酰化水平没有影响。有研究发现,MTA1可通过HDAC1去乙酰化HIF-1α,从而增强HIF-1α的稳定性和活性[17]。本研究在A549细胞内调控MTA1的表达后,发现HIF-1α也出现相应的变化,提示在A549肺癌细胞系中MTA1也能调控HIF-1α的表达。有研究证实,MTDH的表达受HIF-1α的调控,MTDH介导了HIF-1α引起的肿瘤对缺氧的适应性改变[18]。因此,本研究在A549细胞系中进行验证,结果发现阻断HIF-1α,消除了MTA1对MTDH的上调作用,提示MTA1可能通过HIF-1α间接调控MTDH的表达,解释了在不同肺癌标本中MTA1和MTDH的表达增加且存在正相关性。
综上所述,MTA1和MTDH在肺癌组织表达上调且存在正相关,而内在的调控通路可能是通过HIF-1α介导的。MTA1-HIF-1α-MTDH通路可能在肺癌的发生中起关键的调控作用,可能成为未来肿瘤治疗的靶点。

