不同贮运时间对中华绒螯蟹成蟹活力和肝胰腺营养品质的影响
倪康达,刘庆华,侯 鑫,张凯军,陈海红,王 军,王成辉
(1.上海海洋大学农业农村部淡水水产种质资源重点实验室/水产科学国家级实验教学示范中心/ 上海水产养殖工程技术研究中心,上海 201306;2.上海福岁乐生物科技有限公司,上海 200433)
中华绒螯蟹(Eriocheirsinensis)俗称河蟹,是我国重要的水产经济生物。近年来,我国河蟹养殖业发展迅速,全国28个省市区养殖,2019年全国成蟹产量达77.9万吨[1],已成为特种水产品中最具竞争力的产业之一。由于中华绒螯蟹具有较长时间的离水存活能力,鲜活个体可达全国各地甚至海外销售,消费区域和版图不断扩大。特别是近年来随着互联网和电商经济的快速发展,越来越多的中华绒螯蟹产品销售从线下转移到线上[2-3],这就要求贮运期间既要保持河蟹鲜活,又要节约成本。但中华绒螯蟹在贮运过程中的活力与营养价值会发生怎样的变化,如何确定最佳的贮运时间尚缺乏研究。
近年来,水产品在贮运流通过程中的品质变化已引起术界的广泛关注[4-6]。贮运环节是中华绒螯蟹供应链中极为重要的一环,但当前主要对其贮藏过程中的品质变化作了较多研究。刘小莉等[7]研究发现中华绒螯蟹蟹肉经冻藏后,生物胺含量明显降低。朱勤等[8]的研究表明,更低的冻结温度能有效减缓中华绒螯蟹蟹肉蛋白质变性和脂肪酸氧化。邵俊杰等[9]研究发现,低温冻结中的液氮速冻法可以最大限度保持蟹肉的品质。陈舜胜等[10]发现蟹肉冻藏超过2周后会导致品质下降,建议中华绒螯蟹的冻结时间不宜太久。然而,作为电商贮运高度发达的中华绒螯蟹,其在活体物流贮运过程中的品质变化尚未见报道。
本研究模拟当前中华绒螯蟹电商贮运过程中的基本条件,分析了分别贮运24、48和72 h后中华绒螯蟹商品蟹的活力情况;同时,重点比较了不同贮运时间下肝胰腺(蟹黄)的营养品质变化,以便为其产业供应链中的商品蟹合理贮运提供指导。
1 材料与方法
1.1 试验材料与贮运设计
试验蟹来源于上海海洋大学水产动物种质试验站的中华绒螯蟹“江海21”二龄成蟹。随机挑选体重120~150 g的雌蟹45只,150~200 g的雄蟹45只,共90只。选用上海福岁乐生物科技有限公司商品蟹泡沫包装盒9个,规格为27 cm×13 cm×18 cm,同时在每个泡沫箱底部放置单重250 g的冰袋2个。先对每只实验蟹进行背甲的个体编号,干露空气10 min后,电子天平称量其体质量(精确度至0.01 g),游标卡尺测量其壳长(精确至0.01 mm)。然后用同等规格绳索捆扎河蟹,每个泡沫箱放置雌、雄各5只蟹(共10只蟹),正常姿态放置(即背上腹下,雄下雌上)。同时在每个泡沫箱上层蟹背处放置一个温度记录仪(购自江苏精创电气股份有限公司,型号RC-4),设置每3 min自动记录一次箱内温度。最后用胶带纸密封泡沫箱,参照快递物流中运输非冷链运输环境,转存室内阴凉干燥处保存,周边放置温度记录仪3个,记录室温。
本试验设置24、48和72 h共三个保贮时间梯度,每个时间梯度3个重复。当各贮运时间结束时,观察并统计河蟹死亡率和活力大小然后称重,活体解剖前在冰上进行麻醉,沿蟹壳侧面将蟹壳与躯体分离,取出全部肌肉和肝胰腺并准确称量。为保证后续分析所需的足够样本量,本实验将雌、雄蟹各2只(共4只)的肝胰腺组织混合成一个分析样本,肝胰腺样品利用真空冷冻干燥机(购自上海力辰邦西仪器科技有限公司,型号LC-10N-50A)进行冷冻干燥,最后将样品研磨至粉末,干燥密封低温保存备用。
通过如下公式计算保贮河蟹的肝胰腺指数(HIS)、出肉率(MY)和肥满度(CF):
HIS=(HW/BW1)×100%
MY=(BW2/BW1)×100%
CF=BW1/L×100%
式中:HW为肝胰腺质量,g;BW1为河蟹体质量,g;BW2为河蟹肌肉质量,g;L为河蟹壳长,cm。
1.2 不同贮运时间的中华绒螯蟹死亡率与活力评价
各试验时间段结束后,首先利用感官评价法,判断中华绒螯蟹是否死亡,统计死亡率。然后根据翻身所需时间、触碰眼柄的回弹速度以及爬行情况等对每只中华绒螯蟹的活力进行评价[11],具体方法如表1所示。最后,统计比较不同贮运时间中华绒螯蟹各活力等级的百分率。
1.3 不同贮运时间的肝胰腺基本营养指标测定
肝胰腺的水分含量采用冷冻干燥法进行测定;粗蛋白含量测定参考凯氏定氮法(GB/T5009.5-2016);粗脂肪含量测定参考索氏提取法(GB/T14772-2016);灰分含量测定参考高温灰化法(GB5009.4-2016)。

表1 本研究中的中华绒螯蟹活力评价标准Tab.1 The standard of vigor state evaluation in the studied E.sinensis
1.4 不同贮运时间的肝胰腺氨基酸与脂肪酸组成测定
准确称取经冷冻干燥后的样品0.10 g,移至15 mL水解管中,加入5 mL 6 mol/L盐酸溶液,用氮气充满水解管,在酒精喷灯下快速密封,将水解管放在(110±1) ℃的电热鼓风恒温箱中水解22 h后,取出冷却至室温。之后移至容量瓶,用蒸馏水定容至50 mL,期间用蒸馏水反复洗涤水解管三次,然后准确吸取1 mL滤液进行冷冻干燥,滴入1.0 mL 0.02 mol/L HCl将样品溶解,使用孔径为22 μm的水相微孔滤膜过滤该溶液。最后应用氨基酸自动分析仪(日本株式会社日立高新技术科学,型号LA8080)测定氨基酸的组成。
准确称取经冷冻干燥后的样品0.50 g,移至100 mL烧杯中,加入10 mL氯仿-甲醇溶液浸泡30 min,用滤纸过滤至250 mL的蒸馏瓶中,重复上述步骤三次。将滤液蒸干得到粗脂肪后,继续加入2 mL 2%氢氧化钠甲醇溶液,85 ℃水浴锅中皂化30 min,冷却至室温后,加入3 mL 14%三氟化硼甲醇溶液进行甲脂化处理。然后在离心管中加入正己烷1 mL,震荡萃取2 min,静置等待分层,取上层清液100 μL,用正己烷定容到1 mL。最后用0.45 μm滤膜过膜后,使用气相色谱仪(Agilent,型号7890A)测定脂肪酸的组成。
1.5 统计分析
所有试验数据用平均数±标准差(M±SD)的形式表示,方差齐性用Levene检验,显著性差异使用单因素方差分析(ANOVA)和多重比较(LSD),设置P<0.05为差异显著性,相关作图应用Origin8.0pro软件。
2 结果与分析
2.1 不同贮运时间的贮运箱内温度变化
通过对贮存箱内温度的连续监测,发现在12 h内,箱内温度维持在(10.7±1.2) ℃。12 h后箱内温度开始高攀式增长,至30 h左右时,达到箱外温度水平,接着继续升高并超过箱外温度,直到试验结束,箱内温度始终高于箱外温度(图1)。综上可得,当前贮运河蟹所用冰袋只能维持12 h左右的低温状态。
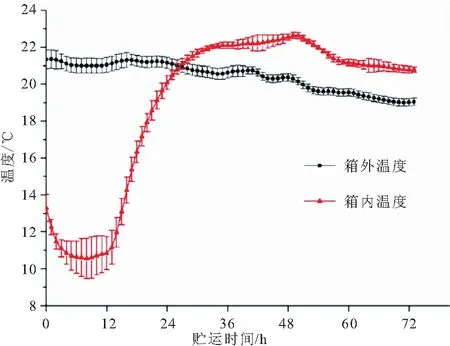
图1 不同贮运时间的箱内外温度变化Fig.1 The changes of inbox and outbox temperature at different storage and transportation times
2.2 不同贮运时间的中华绒螯蟹死亡率与活力变化
在本试验中,贮运24 h的中华绒螯蟹未见死亡,贮运48 h后死亡3只,死亡率为10.0%;贮运72 h后死亡12只,死亡率达40.0%,表明随着贮运时间的延长,河蟹的死亡率会急剧上升。
活力评价发现中华绒螯蟹经过24 h贮运后,活力达4级的有28只,占93.33%,其余2只的活力均达3级。经48 h后,活力达4级的有18只,占60.00%,3级的有5只,占16.67%,2级的有4只,占13.33%。但经过72 h后,活力达4级的仅有1只,只占3.33%,3级的有3只,占10.00%,2级和1级的总数达14只,占46.67%,活力低迷。具体如表2所示。
2.3 中华绒螯蟹体质量、可食组织指数、肥满度和肝胰腺基本营养成分变化
河蟹经过不同时间贮运后,均存在体重下降现象(即失重率),贮运时间越长,失重率越高(表3)。同样,水分和灰分也相应下降,特别是贮运72 h后的灰分下降显著。其它营养指标,如肥满度、肝胰腺指数、出肉率、粗脂肪,没有随着贮运时间的延长而发生显著变化。

表2 不同贮运时间中华绒螯蟹的活力分布Tab.2 The distribution of vigor state of E.sinensis at different storage and transportation times
2.4 不同贮运时间的肝胰腺氨基酸组成变化
本试验共检测出肝胰腺中的17种氨基酸(表4),其中7种为必需氨基酸(EAA),10种为非必需氨基酸(NEAA)。除苏氨酸(Thr)、蛋氨酸(Met)和丙氨酸(Ala)外,其余14种氨基酸的含量均表现为贮运48 h和72 h后显著低于24 h,但48 h和72 h间不存在显著差异,这与表2中粗蛋白含量下降规律一致。因而,包括EAA、NEAA和总氨基酸量(TAA),也表现为贮运48 h和72 h均显著低于24 h,而贮运48 h和72 h间没有显著性差异。
2.5 肝胰腺脂肪酸组成变化
本试验共检测到肝胰腺中的24种脂肪酸(表5),包括10种饱和脂肪酸(SFA)、6种单不饱和脂肪酸(MUFA)和8种多不饱和脂肪酸(PUFA),其中MUFA含量最高,约占SFA总量的44%。除了二十二碳酸(C22:0)含量在72 h显著低于24 h外,其余23种脂肪酸含量在三个贮运时间均无显著性差异,这与表2中粗脂肪含量无明显变化规律一致。因而,包括ΣSFA、ΣMUFA、ΣPUFA、ΣFA、Σn-3PUFA、Σn-6PUFA和Σn-3/Σn-6,也表现为不同贮运时间均无显著性差异。
3 讨论
3.1 不同贮运时间对中华绒螯蟹成活率和活力的影响
冰藏是将水产品包埋于冰块中进行贮藏[12],也是河蟹最常用的贮运保鲜方法。但随着贮运时间延长,冰块逐渐融化,环境温度也随着升高,无法长期维持低温状态。当前的河蟹贮运均是利用泡沫箱为贮运容器,冰袋或冰瓶作为降温介质,一旦冰块全部融化,箱内温度升高,就会对河蟹生存造成严重威胁。有研究发现河蟹死亡10 h后腐败气味发生,体内有毒物质开始累积,品质败坏,失去食用价值[13],故贮运时间对河蟹成活率和营养品质具有重要影响。本试验比较了不同贮运时间内中华绒螯蟹的死亡率和活力,结果显示:随着贮运时间延长,河蟹死亡率急剧上升,活力也随之降低,特别是超过48 h后,河蟹死亡率从10%升至40%,活力大幅度减弱。这是因为河蟹自身代谢旺盛,呼吸作用消耗氧气,冰块融化无法继续维持低温环境,导致贮运箱内温度增高,氧气渐渐耗尽,河蟹受到低氧胁迫和高温威胁。相关研究表明,低氧胁迫会影响水生动物的生长和生理机能,导致抗逆能力下降甚至死亡[14-15],高温会使甲壳动物代谢紊乱,机体免疫力下降[16-17]。故贮运时间越长,越不利河蟹生存,这与谢雅雯[18]的研究结果相似。由此可知,若想提高河蟹贮运存活率或延长理想贮运时间,需寻找比冰袋更好的降温介质或更好的保温措施,使得箱内温度尽可能长时间维持在低温状态,并确保箱内含氧量充裕。综上,本试验认为河蟹理想的贮运时间为48 h以内,期间河蟹成活率和活力都较强。
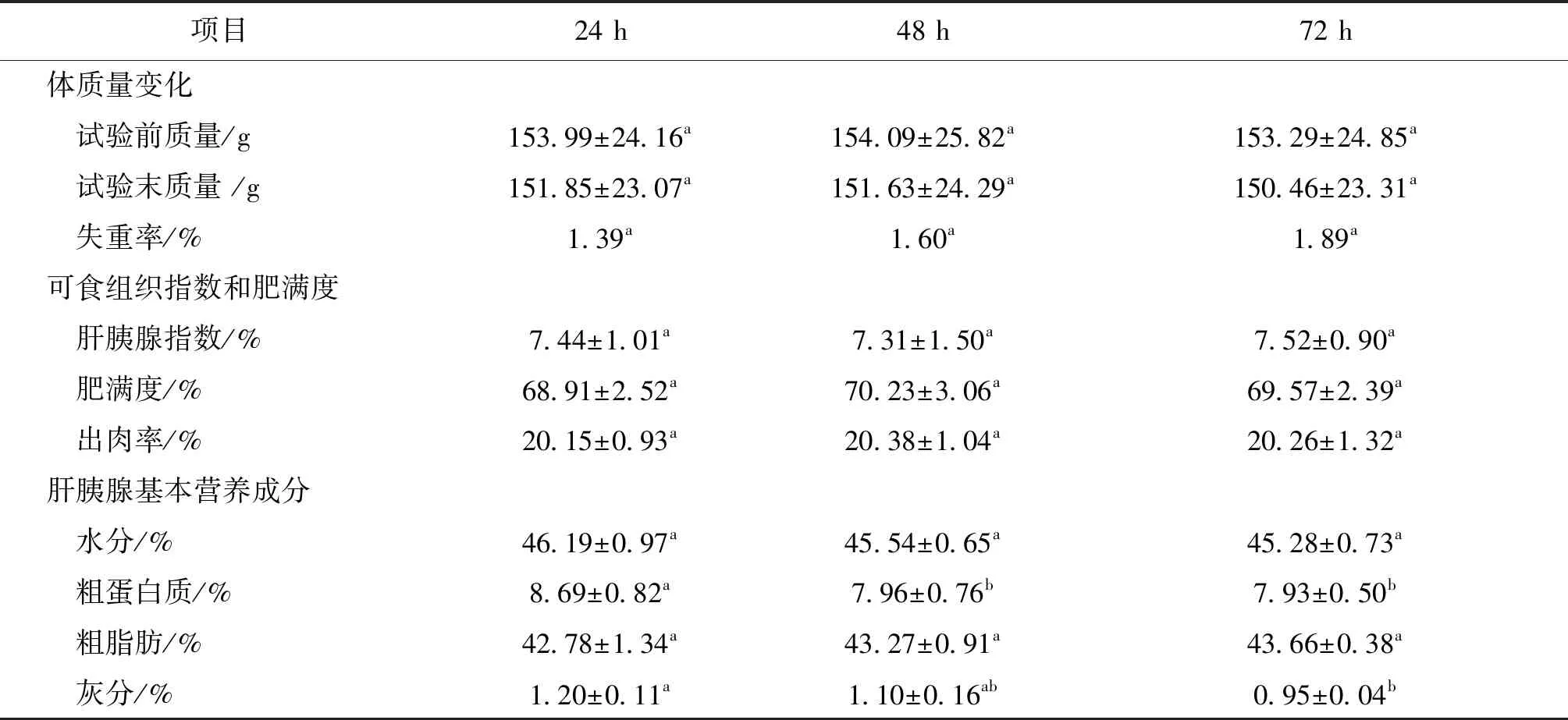
表3 不同贮运时间中华绒螯蟹的体质量、可食组织指数、肥满度和肝胰腺营养成分变化Tab.3 The changes of body weight,edible tissue indices,condition factor and hepatopancreas nutrients of E.sinensis at different storage and transportation times

表4 不同贮运时间中华绒螯蟹肝胰腺氨基酸的组成(mg/g 干重,n=6混样)Tab.4 Amino acid composition in the hepatopancreas of E.sinensis in different storage and transportation times (mg/g dry weight,n=6)
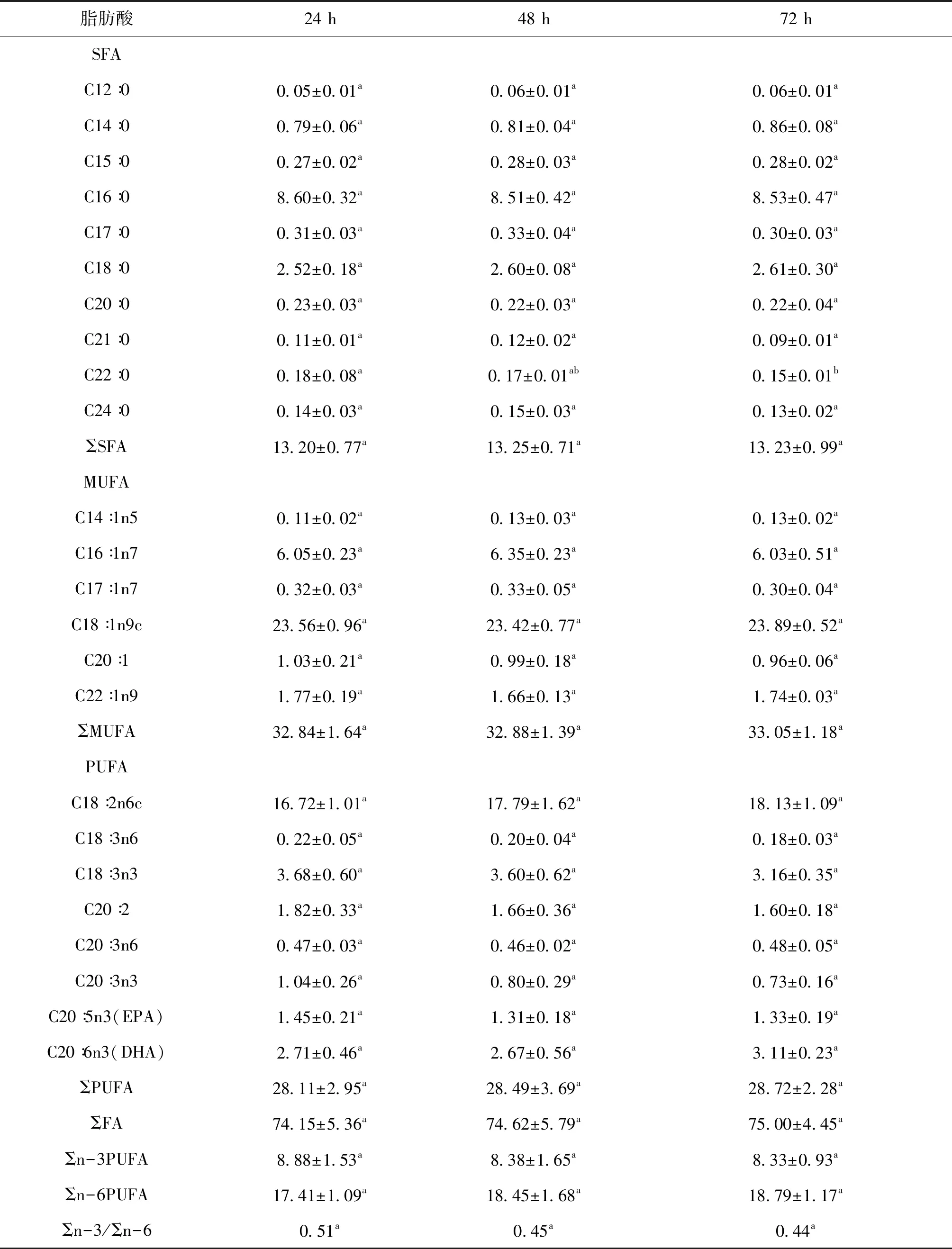
表5 不同贮运时间中华绒螯蟹肝胰腺脂肪酸的组成(mg/g干重,n=6混样)Tab.5 Fatty acid composition in the hepatopancreas of E.sinensis in different storage and transportation times (mg/g dry weight,n=6)
3.2 不同贮运时间中华绒螯蟹体质量、出肉率和肝胰腺基本营养成分比较
在本试验中,河蟹经过不同时间贮运后,体质量和肝胰腺水分含量均存在下降现象,但均无显著差异,说明随着贮运时间延长,河蟹机体的水分正不断流失。另外,贮运期间河蟹肝胰腺指数和出肉率无明显变化,这一方面表明贮运期间河蟹体质量减少主要是因为机体水分参与呼吸作用而水分含量下降,另一方面也表明河蟹在贮运过程能量消耗低,代谢较慢,抗饥饿能力较强。肝胰腺是蟹类营养物质(尤其是脂质)储备的主要组织,为机体能量代谢和卵巢发育提供能量来源。本试验中河蟹肝胰腺的粗蛋白质含量很少,而粗脂肪含量却很高,这是因为河蟹肝胰腺富含大量脂质,而绝大部分蛋白质存在于蟹肉,这与Wu等[19]的研究结果相似。
3.3 不同贮运时间中华绒螯蟹肝胰腺氨基酸、脂肪酸组成比较
蟹类可食组织中的氨基酸、脂肪酸组成和含量是评价其营养价值的重要指标[20]。本试验共检测出17种氨基酸,其中14种在贮运48 h和72 h后显著低于24 h,由于氨基酸是构成蛋白质的基本单位,因此粗蛋白质和总氨基酸含量变化也符合上述规律,推测可能由于内源酶和外源微生物的共同作用[21],导致氨基酸分解,肝胰腺品质在贮运24 h后迅速下降;也有可能是在贮运时间内,河蟹优先利用蛋白质或氨基酸作为主要消耗源来应对饥饿,这与斑节对虾(Penaeusmonodon)应对饥饿的方式相似[22]。故本试验认为肝胰腺氨基酸营养价值在贮运0~24 h内最佳,超过24 h后下降明显。脂肪酸是人体主要能源来源之一[23],本研究中,河蟹肝胰腺中MUFA总含量最多,约占脂肪酸总量的44%,这与孙远明[24]的研究相似,平衡充裕的MUFA对人体营养健康十分重要[25-26]。另外,河蟹肝胰腺中23种脂肪酸的含量表现为在不同贮运时间均无显著性差异,由于脂肪酸是构成脂肪的主要成分,因此粗脂肪和总脂肪酸含量变化也符合上述规律,推测是河蟹在贮运期间代谢缓慢,肝胰腺中的脂类物质只有微量或没有被机体代谢使用,或是其他组织中的脂肪酸优先消耗,使得肝胰腺中各脂肪酸含量在贮运时间0~72 h内没有出现明显变动,也表明了贮运期间0~72 h肝胰腺的脂肪酸营养价值变化不大,具体原因则需进一步的探究。
综上,贮运时间0~48 h内,河蟹成活率高,活力强劲。超过48 h后,河蟹的成活率和活力将明显下降,严重影响河蟹的食用价值;超过24 h后,河蟹肝胰腺的氨基酸含量下降明显,而脂肪酸含量在0~72 h均无明显变化。故综合成活率、活力和肝胰腺营养品质,认为当前流通环境下,河蟹的最佳贮运时间为0~24 h。

