低氧胁迫对鲢抗氧化酶活性及SODs基因表达的影响
凌 晨,张美东,沙 航,邹桂伟,罗相忠,梁宏伟
(1.水产科学国家级实验教学示范中心(上海海洋大学),上海 201306; 2.中国水产科学研究院长江水产研究所,武汉 430223; 3.农业农村部淡水水产种质资源重点实验室(上海海洋大学),上海 201306)
溶解氧(dissolved oxygen,DO)是影响鱼类生存和生长发育的重要环境因子。在水产养殖过程中影响水体溶解氧的因素有光照[1]、水温[2]等。水体中溶解氧水平过高或过低均会引起鱼体发生强烈的应激反应从而导致其氧化抗氧化平衡发生改变[3],过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPX)是生物体中三种主要的抗氧化酶,也是反映鱼体健康与否的重要指标,其组成的抗氧化系统用来抵御低氧胁迫过程中产生的多余氧自由基。西伯利亚鲟(Acipenserbaerii)在低氧胁迫下肝脏CAT和SOD酶活显著降低[4];大口黑鲈(Micropterussalmoides)受低氧胁迫时其肝脏的 CAT和GPX活性明显升高[5];在卵形鲳鲹(Trachinotusovatus)[6]、团头鲂(Megalobramaamblycephala)[7]、黄颡鱼(Pelteobagrusfulvidraco)[8]中均发现低氧胁迫能诱导抗氧化酶活性发生变化。
鲢(Hypophthalmichthysmolitrix),俗称白鲢,属鲤科鲢属,2019年全国养殖总产量达381.03万吨,仅次于草鱼[9],是我国重要的大宗淡水养殖鱼类之一,也是长江增殖放流的主要鱼类[10]。由于鲢性情急躁,应激刺激后反应强烈,易出现浮头,泛塘现象,是一种极不耐低氧的鱼类,在高密度运输、气温骤变过程中非常容易引起低氧应激、死亡等现象,造成严重经济损失。目前对鲢低氧相关的研究主要集中在低氧相关基因的cDNA克隆与表达变化分析等方面[11-13],仅见胡利双[14]对低氧胁迫下鲢组织氧化应激指标进行了研究。本试验从酶活性和基因表达水平分析低氧胁迫对鲢应激的生理响应过程,研究了鲢对溶氧变化的适应性调节机制,为其健康养殖及耐低氧品种选育提供科学依据。
1 材料与方法
1.1 试验鱼来源
试验用鲢取自农业农村部鲢遗传育种中心,体长为(22.1±0.8) cm,体重为(200±12.4) g,在选育车间的玻璃缸中暂养一周后,挑选外观健康,活力正常,规格相对一致的个体用于试验。
1.2 实验设计及样品采集
将暂养后的鲢随机分为4组(常氧组和3个低氧胁迫实验组),分别放入80 L的透明水箱中,每组设3个平行,每箱放入10尾,总计120尾,实验水温维持在(23.0±0.53) ℃。常氧组鲢保持正常溶氧[T0,DO值为(6.42±0.3) mg/L],试验组用保鲜膜和塑料盖密封,试验期间用溶氧仪测定各试验组水中溶氧量。其中常氧组在低氧胁迫前进行采样;浮头组[T1,DO值为(0.76±0.03) mg/L]在试验鱼全部浮头时采样;半窒息组[T2,DO值为(0.58±0.06) mg/L]在缸内半数鱼死亡时,采未死亡试验鱼作为样本;窒息组[T3,DO值为(0.27±0.06) mg/L]在试验鱼全部死亡时采样。每组随机采5尾,采样前用150 mg/L的MS-222麻醉试验鱼以降低应激反应,然后用一次性灭菌注射器在尾椎静脉采血,放入离心管中,混匀,4 ℃下血液经3 500 r/min离心10 min,吸取上清液制备血清,所得血清为无色或是淡黄色,将血清放于-20 ℃冰箱保存备用。采血后迅速解剖鱼体,取出鳃、肝脏等组织用干净无菌的冻存管装样本,液氮速冻后置于-80 ℃冰箱保存备用。
1.3 酶液制备
取采样时所得的血液上清待测,并称取冻存的肝脏组织0.5 g左右,按照重量体积比为1∶9的比例加入9倍体积的预冷生理盐水(0.86%),用全自动组织破碎仪制备10%的组织匀浆,冰水浴条件下,2 500 r/min离心10 min,所得上清液用于SOD、CAT和GPX活性的测定,所有样品在12 h内测定完毕。
1.4 酶活性测定方法
酶活均使用南京建成生物有限公司试剂盒进行测定。SOD活性用黄嘌呤氧化酶法测定,其定义为1 mg组织蛋白(1 mL血清)在1 mL反应液中SOD抑制率达到50%时所对应的SOD量为1个酶活力单位。CAT活性采用钼酸铵显色测定法,其定义为1 mg组织蛋白(1 mL血清)1 s分解1 mol的过氧化氢(H2O2)的量为1个酶活力单位。GPX活性采用DTNB直接法测定,其定义为1 mg组织蛋白(0.1 mL血清)在37 ℃反应5 min,扣除非酶反应的作用,使反映体系中GSH浓度降低1 mol/L为一个酶活力单位。
1.5 总RNA提取及实时荧光定量PCR检测
取0.1 g鲢肝脏、鳃组织按照Trizol法提取总RNA,用超微量分光光度计NP80(德国,IMPLEN) 测定RNA在260~280 nm下吸光光度比值(OD260 nm/OD280 nm) 检测RNA的质量、纯度以及浓度,并用1%琼脂糖凝胶电泳检测总RNA的完整性。使用HiScript cDNA Synthesis Kit试剂盒(南京诺唯赞生物科技有限公司)将其反转录合成cDNA,-20 ℃保存备用。使用本课题已发表的Mn-SOD、Cu/Zn-SOD基因引物序列,以β-actin为内参基因(表1),由武汉天一辉远生物科技有限公司合成,实时荧光定量PCR反应体系20 μL:2 × ChamQ Universal SYBR qPCR Master Mix 10.0 μL,上、下游引物各0.4 μL,cDNA模板0.8 μL,ddH2O 8.4 μL。扩增程序:95 ℃预变性5 min,95 ℃ 15 s,60 ℃ 30 s,72 ℃ 32 s,进行40个循环;95 ℃ 15 s、60 ℃ 1 min、95 ℃ 15 s。以2-ΔΔCt法换算目的基因的相对表达量。

表1 实时荧光定量PCR扩增引物序列Tab.1 Primer sequences used in the real-time fluorescence quantitative PCR
1.6 数据处理和统计分析
实验数据采用Excel 2013和SPSS 22.0统计软件进行数据分析进行统计整理,并以SPSS 22.0分别进行单因素方差分析(One-way ANOVA)和Duncan’s多重比较。
2 结果
2.1 低氧胁迫对鲢血清抗氧化酶活性的影响
随着氧浓度的降低,鲢血清CAT酶活性呈现出先升高后降低的变化,在半窒息时CAT酶活力达到最大(12.84±0.56) U/mL,显著高于正常溶氧、浮头和窒息时的酶活力(P<0.05),窒息点时酶活降至最低(图1);低氧胁迫过程中,血清中的SOD酶活在浮头至窒息的过程中先升高后降低,浮头时酶活相比于常氧组显著降低,半窒息点时SOD又显著升高随后降至最低(51.2±1.24) U/mL,与其它各点均具有显著性差异(图1);GPX酶活力在整个低氧胁迫过程中呈先升高后降低的趋势,但均高于正常溶氧,且在浮头时GPX酶活力达到最大值(248.35±28.36) U/mL,随后一直降低,在整个过程中无显著差异(P>0.05)。
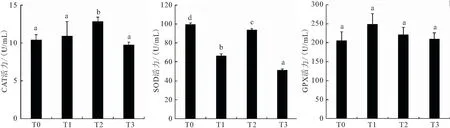
图1 低氧胁迫下鲢血清酶活性的变化Fig.1 Changes of serum enzyme activity under hypoxia stress in H.molitrix T0表示常氧组,T1表示浮头组,T2表示半窒息组,T3表示窒息组。柱上标不同小写字母 表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。下同。
2.2 低氧胁迫对鲢肝脏组织抗氧化酶活性的影响
随着氧浓度的降低,鲢肝脏SOD、CAT、GPX 3种酶活力均呈先升高后降低的变化趋势(图2)。CAT在低氧胁迫至浮头时,酶活力升高且达到最大值(43.61±1.79) U/mg,相比于常氧组无明显变化,随着溶解氧的降低,CAT酶活力一直呈降低的趋势,到窒息时降至最低(29.31±4.30) U/mg,显著低于正常溶氧、浮头和半窒息时的酶活力。SOD在低氧胁迫过程中活力先升高后降低,在浮头时酶活力达到最大(87.57±2.91) U/mg,与常氧相比无明显差异,随后一直呈下降趋势,窒息时显著低于其它各点的酶活力;GPX酶活力在低氧胁迫过程中先上升后下降,半窒息时达到最大值(132.92±44.62) U/mg,随后在窒息组时降低至(102.15±36.69) U/mg,与其他各点的酶活均无显著差异。

图2 低氧胁迫下鲢肝脏酶活性的变化Fig.2 Changes of liver enzyme activity under hypoxia stress in H.molitrix
2.3 低氧胁迫对超氧化物歧化酶基因(SODs)表达的影响
在肝脏中,Cu/Zn-SOD基因在整个低氧胁迫过程中的相对表达量呈先升高再降低的变化趋势,在浮头时Cu/Zn-SOD相对表达量达到最高,随后一直呈下降趋势,在窒息时显著低于常氧组。Mn-SOD基因在浮头时表达量升高,之后在半窒息时显著低于常氧组,窒息时Mn-SOD基因的表达量又出现升高,相较于常氧组无显著性差异(图3)。在鳃中,Cu/Zn-SOD和Mn-SOD基因在常氧组时表达量最高,随着氧浓度的降低,Cu/Zn-SOD和Mn-SOD基因在浮头时的相对表达量均显著降低,半窒息时Cu/Zn-SOD基因的表达量显著上升后在窒息时下降,与其它各点相比均有显著性差异。Mn-SOD基因的相对表达量从浮头到窒息一直呈下调趋势,与常氧组相比均具有显著性差异。

图3 低氧胁迫对鲢肝脏和鳃中Cu/Zn-SOD、Mn-SOD基因相对表达量的影响Fig.3 Effects of hypoxia stress on the relative expression of Cu/Zn-SOD、Mn-SOD gene in liver and gill of H.molitrix
3 讨论
3.1 鲢血清和肝脏组织中抗氧化酶活力在低氧胁迫下的变化
在低氧胁迫初期(浮头),鲢血清CAT和GPX酶活力上升,SOD酶活力显著下降,此时已经开始引起氧化应激,机体开始产生抗氧化反应。随着氧浓度的降低,在半窒息时SOD 和CAT酶活力显著上升,GPX酶活力下降,此时由于低氧胁迫导致鱼体内产生大量的氧自由基,CAT和SOD活力升高以清除这些氧自由基,从而保护体内细胞免受损伤;窒息时CAT、SOD和GPX酶活力都发生下降,与张勇等[15]在美洲鲥(Alosasapidissima)中的研究结果一致,表明氧浓度过低会影响鲢抗氧化系统的功能,降低其抗氧化能力并破坏体内原有的自由基代谢平衡,产生氧化损伤,使机体细胞的正常生理功能被破坏,最终导致试验鱼死亡。肝脏中,在整个低氧胁迫过程中CAT、SOD酶活力整体呈下降趋势,GPX呈上升的趋势。张志伟[16]也发现在鲢肝脏中低氧可抑制SOD的产生,但在鳃中的结果相反。浮头时CAT、SOD和GPX出现升高,表明低氧水平可诱导抗氧化酶活性的升高,以清除多余的氧自由基,从而降低氧化应激造成的危害,与卵形鲳鲹[17]、青田田鱼(Cyprinuscarpiovar.qingtianensis)[18]的研究结果相吻合。随着氧浓度的降低,肝脏中CAT、SOD酶活力在窒息点时显著降低,GPX酶活力降至与正常组几乎持平,与团头鲂[19]、西伯利亚鲟[20]在低氧胁迫后结果相类似,以往研究发现低氧环境下大头兔脂鲤(Leporinusmacrocephalus)[21]肝胰脏中SOD活性和CAT活性显著降低;细鳞肥脂鲤(Piaractusmesopotamicus)[22]和葛氏鲈塘鳢(Perccottusglenii)[23]在低氧胁迫下肝胰脏CAT活性和GPX活性也显著降低,与本研究结果相似。窒息点的溶氧量太低导致鱼体的肝脏功能受到影响,难以通过提高自身抗氧化酶活力来清除体内过量活性氧分子,最终致使鱼体死亡。本研究中鲢血清和肝脏在氧浓度持续降低过程中,表现出不同的抗氧化响应模式,这与陈世喜[6]的研究结果类似。
3.2 低氧胁迫对超氧化物歧化酶基因表达的影响
本研究中Cu/Zn-SOD和Mn-SOD基因在肝脏和鳃组织都有表达,是由于Cu/Zn-SOD和Mn-SOD可以在各种功能细胞中发挥作用[24],然而两个基因在肝脏和鳃组织中的表达方式却不同。在低氧胁迫过程中Cu/Zn-SOD和Mn-SOD在肝脏大量表达,而在鳃中表达量相对较低,说明肝脏对于低氧胁迫的影响要比鳃更为敏感,这可能与不同组织执行的生理功能不同有关。肝脏作为一种重要的免疫组织,是排毒和体外生物代谢的重要器官,能够维持鱼类的稳定状态和正常生理功能。在肝脏中,Cu/Zn-SOD和Mn-SOD的mRNA表达水平在浮头时均升高,随着氧浓度的降低Cu/Zn-SOD和Mn-SOD的表达水平受到抑制,与SOD酶活力的变化趋势相一致。浮头时Cu/Zn-SOD和Mn-SOD表达量的升高,超氧化物歧化酶活力也升高,表明SOD酶系统的抗氧化应激反应在很短的时间内就会被激活。此时低氧胁迫诱导细胞内ROS增加,SOD抗氧化酶系统则需要增加表达水平来维持细胞内的氧化应激平衡状态[25]。董国凯[26]在大鼠的研究中认为,氧自由基本身可以发挥信号转导作用,过量生成或SOD活性下降有可能触发细胞的内在代偿调节机制,激活胞浆中的基因调控蛋白,使Cu/Zn-SODmRNA相对表达量增加。在低氧胁迫后期,肝脏中SODs mRNA表达的被抑制,导致肝脏细胞中ROS的大量积累,细胞内氧化平衡状态被打破,从而加速了肝细胞功能的紊乱甚至丧失。鳃作为鱼类的主要呼吸器官,在进行新陈代谢和渗透压调节等方面具有重要的功能,同时由于鳃直接暴露于外部环境中,因此是对外界刺激最敏感的器官。在鲢鳃组织中,随着低氧胁迫的进行,Cu/Zn-SOD和Mn-SOD的mRNA表达水平在浮头时均显著降低而后持续低表达,低氧胁迫对鳃组织造成了一定的氧化应激损伤,导致其抗氧化系统紊乱,无法维持细胞内的氧化应激平衡状态。
4 结论
低氧胁迫对鲢不同组织中抗氧化酶及Cu/Zn-SOD和Mn-SOD基因表达均产生显著影响。虽然鲢能通过自我调节抗氧化酶活力和上调SODs基因表达来抵御氧化应激反应,但在严重低氧胁迫下,氧化压力超过了机体组织的抗氧化调节能力,鱼体内环境遭到破坏,组织发生损伤,自身的抗氧化防御机制受到影响,最终导致机体免疫能力降低,甚至出现死亡现象。

