基于网络药理学探讨清肠化湿方治疗溃疡性结肠炎的作用机制
屈 芸,朱 磊,胡 静怡,左 武琪,沈 洪
(1.南京中医药大学,江苏 南京,210023;2.南京中医药大学附属医院,江苏 南京,210029;3.江苏省中医院,江苏 南京,210029;4.南京中医药大学附属中西医结合医院,江苏 南京,210028)
溃疡性结肠炎(ulcerative colitis,UC)是一种病因未明的慢性非特异性胃肠道炎症性疾病,临床表现为腹泻、腹痛、黏液脓血便及不同程度的全身病变[1]。UC 典型的临床表现除黏液脓血便或血性腹泻、里急后重之外,可伴有乏力发热、食欲减退等全身症状,病程多在6 周以上[2]。近20 年来,我国此病就诊患者人数呈快速上升趋势[3,4]。祖国医学本无“溃疡性结肠炎”之名,结合本病临床表现,常归属中医记载之“肠澼”、“久痢”、“泄泻”范畴。临床治疗时,西医多用传统药物(5-氨基水杨酸类药物、糖皮质激素、免疫抑制剂)、生物制剂、营养支持治疗与外科手术治疗等[5],但患者病情仍有反复且预后控制一般;中医药治疗本病优势独特,包括口服、灌肠及多种方式联合治疗,疗效甚佳。清肠化湿方是岐黄学者—南京中医药大学附属医院沈洪教授临床治疗UC 验方,本方经国家“十一五”科技支撑计划项目多中心、随机、对照研究,治疗UC 疗效可靠[6]。清肠化湿方由黄芪、白芍、地榆、白头翁、白芷、黄芩6 味药物组成。UC 中医病因多责之湿热,二者壅滞肠道,气血失调,伤及脂络,最终成为脓血。清肠化湿方集“白头翁汤”、“芍药汤”、“黄芩汤”于一体,方中白头翁清热止痢、解毒凉血;白芍健脾柔肝、调气和血;黄芩清肠化湿,止痢凉血;白芷排脓消肿;地榆敛疮凉血;黄芪益气健脾,共奏清热除湿、调和气血、止痢凉血之效。然本方成分复杂,治疗UC 的作用机制尚不明确。因此,本文通过网络药理学,构建“潜在活性成分-作用靶点-疾病”网络,探讨其治疗UC 的药物关键成分及分子作用机制,以期为未来研究清肠化湿方治疗UC 的药效物质基础和信号通路提供理论依据。
1 资料与方法
1.1 潜在活性成分的筛选和作用靶点预测
应用中药系统药理学技术平台(TCMSP)[7]检索清肠化湿方中的6 味中药的化学成分,同时以类药性(drug-likeness,DL)及生物利用度(oral bioavailability,OB)作为筛选指标,按照DL≥0.18,并且OB≥30%[8,9]的要求得出有效成分的化合物信息。 最 后 通 过 Uniprot(https://www. uniprot.org/)[10]校正基因名。
1.2 UC 疾病靶点的选取
运用GeneCards(https://www.genecards.org/)数据库进行UC 疾病靶点的选取,输入“ulcerative colitis”进行检索,得到相关靶点。应用R 软件将得到的疾病靶点和之前筛选出的活性成分及潜在靶点进行比较,得到二者共同基因靶点并制作韦恩图。
1.3 潜在活性成分-作用靶点-疾病网络的构建
应用Cytoscape3.7.1 软件,将前述药物潜在活性成分、共同基因的数据构建“潜在活性成分-作用靶点-疾病”网络图。
1.4 蛋白相互作用(PPI)网络的构建
在String(https://string-db.org/)数据库[11]导入共同基因数据,选择“Homo sapiens”物种,将medium confidence(0.4)设置为低相互作用分数,其余参数默认,导出PPI 网络互作图和TSV 文件。
1.5 GO 功能富集分析和KEGG 通路富集分析
运用R 软件3.6.3“clusterProfiler”软件包对活性成分和疾病的共同靶点进行GO 功能富集分析和KEGG 通路富集分析,设置P<0.05,得到相应柱状图和通路图。
2 结果
2.1 清肠化湿方潜在活性成分和作用靶点
应用TCMSP 检索清肠化湿方中6 味中药的化学成分,按照DL≥0.18,并且OB≥30% 的条件得出有效成分的化合物信息。其中黄芪20 个、白芍13个、地榆13 个、白头翁11 个、白芷22 个、黄芩36 个,去重后共得到100 个化学成分。同时在TCMSP 平台上获取每个活性成分的潜在靶点1 409 个,去重后得到210 个。
2.2 UC 疾病基因
在GeneCards 数据库中,以“ulcerative colitis”为检索词,共找到4 213 个疾病基因,与清肠化湿方潜在活性成分的作用靶点比较,共有143 个共同基因。见图1。
2.3 清肠化湿方活性成分-靶点-疾病网络图
应用Cytoscape3.7.1 软件,将得到的活性成分-靶点关系进行导入,制作网络图,见图2。图2 中共包括212 个节点(67 个活性成分、143 个靶点、1 个疾病靶点、1 个复方节点)和721 条边,有33 个活性成分未参与网络构建。图2 中绿色代表靶点,浅蓝色代表活性成分,深蓝色代表复方,红色代表疾病。其中Degree 值排名前4 位的活性成分是:槲皮素(quercetin)、山奈酚(kaempferol)、汉黄芩素(wogonin)、黄芩素(baicalein)。Degree 值排名前4 的靶点是:一氧化氮合酶2(NOS2)、雌激素受体α(ESR1)、丝氨酸/苏氨酸蛋白激酶Chk1(CHEK1)、过氧化物酶体增殖物激活受体γ(PPARG)。
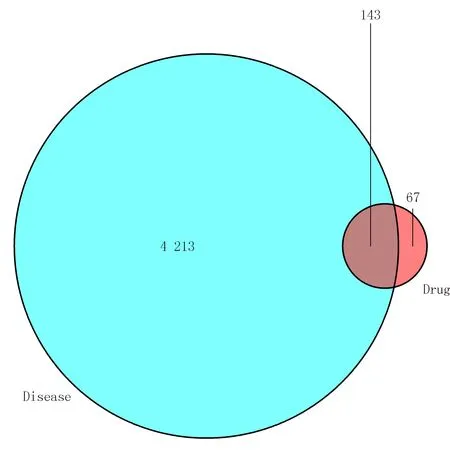
图1 QCHSD 与UC 的共同基因韦恩图Fig 1 Venn diagram of common genes of QCHSD and UC
2.4 关键靶点互作图
运用String 网站,将前述143 个共同靶点导入其中,得到相互作用图,见图3。在PPI 网络图中,共有143 个节点,2 758 条边,平均节点度为38.6,图中网络节点代表基因蛋白,每个节点之间的线条代表蛋白之间的联系,线条粗细代表蛋白互作关系的强弱。网络节点颜色反应作用的不同证据类型。利用R 软件计算各基因靶点Degree,同时制作核心靶点柱状图,见图4。其中,前4 个靶点是:RAC-α-丝氨酸/苏氨酸蛋白激酶(AKT1)、白细胞介素-6(IL-6)、血管内皮生长因子A(VEGFA)、半胱天冬氨酸蛋白酶-3(CASP3)。

图2 活性成分-作用靶点-疾病互作网络Fig 2 Network diagram of component-target-disease

图3 靶点蛋白-蛋白相互作用图Fig 3 Protein-protein interaction(PPI)network of targets
2.5 GO 功能富集分析和KEGG 通路富集分析
运用R 软件“clusterProfiler”对清肠化湿方与UC 的共同靶点进行GO 功能富集分析和KEGG 通路富集分析。在GO 功能富集分析图中,X 轴和气泡面积大小表示靶基因集中于GO 的数量,其中气泡颜色代表P 值,富集显著性;Y 轴表示GO 的名称,可以看出靶基因主要明显富集于核受体活性、转录因子活性,直接配体调节的序列特异性DNA结合、类固醇激素受体等分子功能,对脂多糖的反应、对细菌来源分子的反应、氧化应激反应等生物过程以及膜筏、膜微区、膜区等细胞组分。见图5 。

图4 靶点互作关系barplot 图Fig 4 Barplot diagram of interaction relationship between targets
在KEGG 通路富集分析图中,X 轴代表靶基因集中在该通路上的数量,条形的颜色代表P 值,富集显著性,Y 轴代表各通路名称,可以看出靶点主要集中在糖尿病并发症AGE-RAGE 信号通路、乙型肝炎、流体剪切应力与动脉粥样硬化、IL-17 信号通路、卡波西肉瘤相关疱疹病毒感染、TNF 信号途径等。见图6。
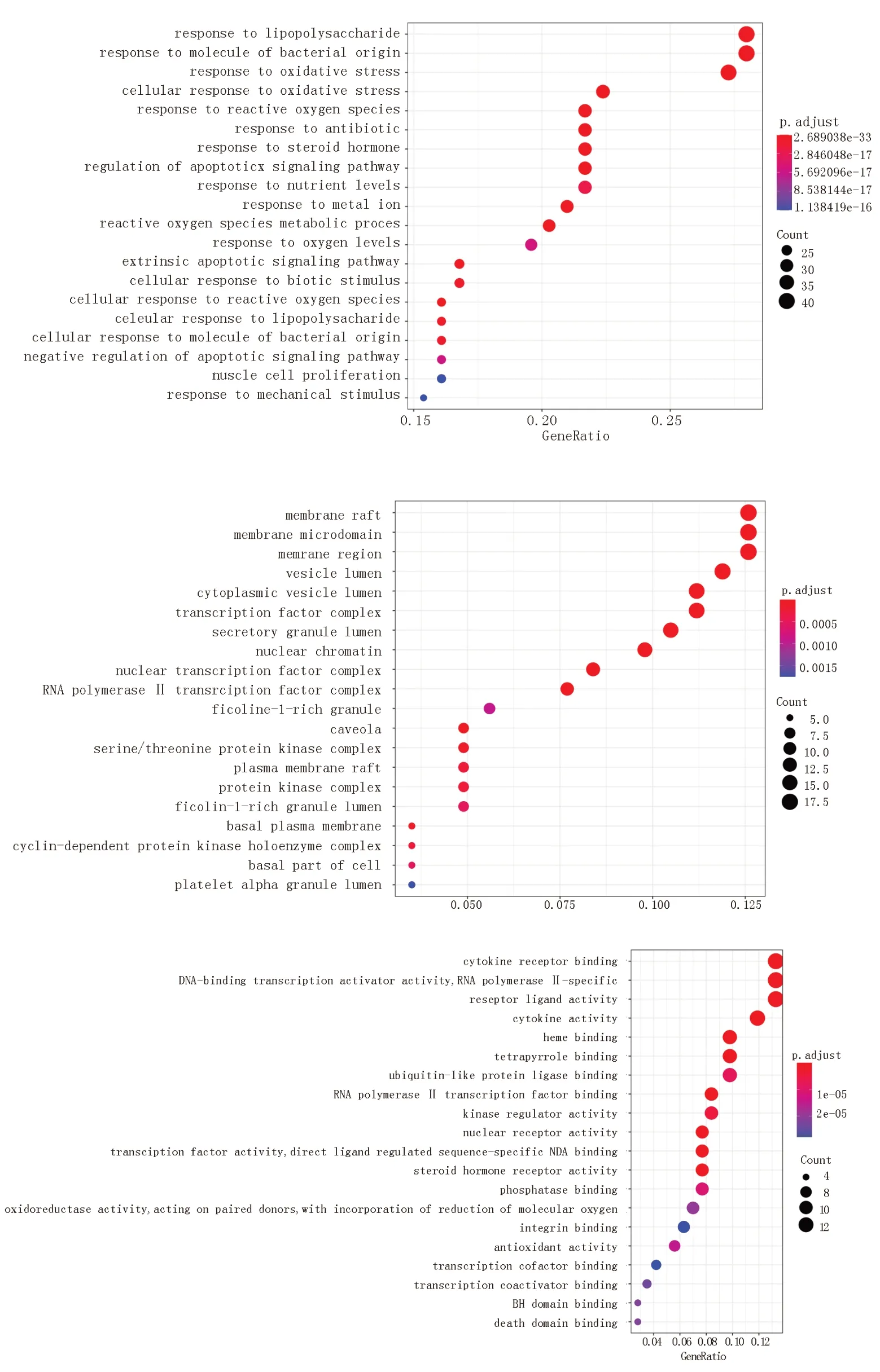
图5 分子功能GO 富集分析Fig 5 GO enrichment analysis of molecular function

图6 相关通路KEGG 富集分析Fig 6 KEGG enrichment analysis of related pathways
3 讨论
目前认为,UC 有家族遗传易感性的特点,同时环境、免疫、心理、饮食等因素互作发病[12-14]。祖国医学称此病为“肠澼”、“久痢”等,认为其与脾、肝、肺、肾功能失调密切相关,沈洪教授认为脾为后天之本,可运化水湿;肝主疏泄,与情绪密切相关;肺与大肠相表里,肺金之胜,亦生腹鸣溏泄;久病及肾,此病具有反复发作、迁延难愈的特点,最终累及肾脏。UC 病因多与湿热之邪相关,湿热壅滞,伤及脂络,最终成为脓血。清肠化湿方所含中药集清热除湿、调和气血、止痢凉血功效于一体,治疗UC 有坚实的理论基础和良好的临床疗效。
笔者对清肠化湿方潜在活性成分-作用靶点-疾病网络进行分析,方中关键化学成分主要为quercetin(槲皮素)、kaempferol(山奈酚)、wogonin(汉黄芩素)、baicalein(黄芩素)等。槲皮素是膳食中抗氧化剂-黄酮类化合物的主要代表。Ju 等[15]实验表明,槲皮素可以部分地通过血红素加氧酶-1(H M O X 1,H O-1)依赖的途径调节巨噬细胞的抗炎和杀菌能力,从而改善实验性结肠炎。表明槲皮素可能通过重新平衡肠巨噬细胞的促炎、抗炎和杀菌功能,恢复肠道宿主-微生物的正常关系,从而改善结肠炎。Chen 等[16]研究山奈酚改善了实验性结肠炎小鼠结肠缩短、脾脏肿胀的情况,改善了结肠绒毛、腺结构和隐窝的结构,并且抑制相关炎性细胞因子的活性,尤其是IL-1β 的表达;山奈酚还改变了结肠炎小鼠的肠道微生物结构,表明异杆菌和类杆菌的数量显著减少,乳酸杆菌的数量显著增加。通过提高机体抗氧化能力、减轻炎症反应、调节肠道菌群等途径,保护结肠免受右旋糖酐硫酸钠(DSS)诱导的结肠炎的侵袭。此外,山奈酚可以通过抑制细胞增殖和侵袭,诱导细胞凋亡,其作用机制包括活性氧清除、免疫调节、细胞周期调控和DNA 甲基化、组蛋白脱乙酰等表观遗传修饰[17]。汉黄芩素在体外通过抑制巨噬细胞和上皮细胞的NF-κB 和ERK 信号通路来预防炎症已被证实[18]。汉黄芩素可降低结肠和脾脏中CD4、CD25、CD127 和CD4 CD25Foxp 3 细胞的频率,下调调节性T 细胞ERK 和STAT3-Y705 磷酸化,促进核因子-κB(NF-κB)和STAT3-S727 活化,并证明大剂量汉黄芩素治疗可以通过刺激效应T 细胞和下调调节性T 细胞来增强免疫活性。在DSS 诱导的结肠炎模型中,黄芩素可减轻结肠炎的病情,黄芩素可促进结肠上皮细胞(CEC)的体外增殖。揭示黄芩素对JAK-STAT 信号通路中信号转导子和转录激活子STAT3 和STAT4 的mRNA 表达下调,有助于其对T 细胞增殖的调节。然而,在DSS 模型中,作为肠道活化T 细胞靶细胞的CECs 中STAT4 的转录被黄芩素下调,提示黄芩素在自身免疫性疾病不同细胞类型中介导了相似的STAT 表达[19]。
活性成分-作用靶点-疾病网络图中Degree 值排名靠前的靶点是:一氧化氮合酶2(NOS2)、丝氨酸/苏氨酸蛋白激酶Chk1(CHEK1)、过氧化物酶体增殖物激活受体γ(PPARG),这些靶点是治疗UC 的关键。NOS2 又被称为iNOS,在静息状态下不表达,在炎症等病理状态下大量产生,继而产生大量NO,NO 可激活COX-2,参与COX-2 的致病过程。Song 等[20]试验表明,溃疡性结肠炎组织中iNOS 表达与组织炎症程度有关,炎症越重iNOS 表达越高。有研究表明[21],在UC 相关异型增生和UC 相关肿瘤患者中,CHEK1 通过抑制JNK 的激活,促进细胞周期的进展,与DNA 损伤反应旁路联系在一起。同时激活的CHEK1 可与染色质结合,触发了组蛋白乙酰化以及组蛋白乙酰转移酶和转录因子与染色质的结合。PPARG 是一种核受体,在结肠上皮细胞中表达最高;体外研究表明,PPARG 可以通过限制髓样细胞和上皮细胞分泌的趋化因子和细胞因子的产生来抑制炎症反应,在胃肠道的动态平衡方面起着重要作用。PPARG 可以抑制NF-κB 活性。UC 患者会出现结肠上皮细胞的PPARG 表达降低,肠黏膜中NF-κB 水平升高,表现为慢性肠道炎症,使免疫系统与肠腔细菌维持动态平衡的能力受损[22]。
从String 平台构建的靶点互作图中看出,AKT1、IL-6、VEGFA、CASP3 等 是 重 要 靶 点。AKT1 是AKT 家族的一部分,可以调节细胞功能,包括细胞存活、增殖、分化、参与中间代谢等。有研究表明过表达的AKT1 促进了细胞因子信号转导抑制因子(SOCS1)的激活,从而抑制了NF-κB 的磷酸 化、p65 的 磷 酸 化[23]。AKT1 是P13K 的 下 游 靶点,可以通过磷酸化下游底物来控制调节细胞功能,P13K-AKT 通路是经典的细胞周期控制通路之一,在调节炎症反应作用重大。IL-6 主要由活化的T 细胞分泌,作为促炎性细胞因子之一,主要参与炎症免疫过程,在肠道疾病中,IL-6 与生物体的肠道菌群关系密切,其过表达会导致肠道发生炎性反应[24]。VEGFA 作为胱氨酸生长因子超家族一员,可以通过与RTKs 结合,进而激活其下游底物P13K产生生物学作用,参与一系列信号转导过程。CASP3 属于细胞中的凋亡基因之一,是整个凋亡级联反应的重要调节点,能够激活特定的信号通路,进而导致DNA 片段形成,促进凋亡。在生物体中,CASP3 与抑制因子共存,在肠道炎癌转化过程中,会导致细胞凋亡和抗凋亡紊乱[25]。
通过GO 功能富集分析,可以看出清肠化湿方的活性成分主要通过核受体活性、转录因子活性,直接配体调节的序列特异性DNA 结合、类固醇激素受体、细胞因子受体结合、细胞因子活性等重要靶点发挥作用。核受体是配体依赖性的转录因子,其在细胞内广泛存在,主要包括激素类受体和孤儿核受体(Nur77)。它们在生物体的成熟发育,细胞增殖、分化、凋亡,肿瘤形成以及生理代谢等过程中起着基因调控的作用[26]。有研究表明,Nur77 在UC患者病变组织中的表达明显低于正常组织,并且证实Nur77 可作为负性调节因子参与调控炎症性肠病的发生发展[27]。细胞因子包括炎性因子、生长因子和趋化因子等。炎性反应增强是UC 患者病情变化的关键机制之一,炎症介导的多种细胞通路活化,多种促炎因子IL-6、IL-8 等可以反应炎症程度[28]。KEGG 通路富集分析表明,糖尿病并发症AGERAGE 信号通路、乙型肝炎、IL-17 信号通路、TNF等信号途径富集性较高。AGE 与RAGE 配体结合,通过激活氧自由基、蛋白激酶C、蛋白酪氨酸激酶、p38MAPK 和NF-κB 等影响信号传导。有研究表明,在体外,IL-10 促进p38MAPK 磷酸化的核转位,从而调节糖皮质激素受体-α、IL-10-受体-α 和桥粒芯糖蛋白-2 的表达。这些结果提示,p38MAPK介导的IL-10 与糖皮质激素的协同作用改善了UC的桥粒直度,有助于肠上皮的恢复,减少了肠腔抗原与固有层的接触[29]。IL-17 是促炎因子,在炎症反应中发挥作用,有研究表明,通过抑制NF-κB 入核,调节Th17 细胞炎症反应,抑制促炎因子IL-17等分泌,通过增加抑炎因子IL-10 分泌,可以减轻炎症反应,同时增加UC 大鼠结肠MUC-2、ZO-1 的表达,修复肠黏膜紧密连接[30]。可以看出,清肠化湿方可能通过核受体、细胞因子等途径以及AGERAGE 信号通路、IL-17 信号通路、TNF 等通路起到抑制炎症、促进凋亡的作用。
综上所述,本研究通过运用网络药理学的方法,系统阐述了清肠化湿方治疗UC 的作用机制,发现清肠化湿方治疗UC 的可能潜在活性成分是槲皮素、山奈酚、汉黄芩素、黄芩素等,其关键基因是AKT1、EGFR、VEGFA、CASP3 等,通过核受体、细胞因子等途径以及AGE-RAGE 信号通路、IL-17信号通路、TNF 等通路起到抑制炎症、促进凋亡的作用,从而达到治疗UC 的作用。然而,本研究仍存在一定的局限性,在未来的研究中,应当通过具体实验验证预测的活性成分、关键靶点及通路,为清肠化湿方治疗UC 提供有效的论证。

