基于网络药理学探究三七治疗玻璃体积血的作用机制
韩梦雨,刘自强,农璐琪,王志军,金 明
(1.北京中医药大学;2.中日友好医院,北京100029)
玻璃体积血(vitreous hemorrhage,VH)是一种常见的导致患者严重失明的眼科疾病,可由多种视网膜血管性疾病或眼外伤引起,给医生和患者均带来挑战[1]。睫状体平坦部玻璃体切除术联合(或不联合)全视网膜光凝是VH 的首选治疗方法,但严重的手术并发症如玻璃体再出血、视网膜脱离、眼内炎等限制了其应用[2]。常作为手术辅助手段的玻璃体腔注射抗血管内皮生长因子药物治疗VH 也有应用,但目前尚无明确的临床指南[3]。
网络药理学的研究思路为中药有效成分的研究提供了一条独特而创新的途径,阐明了药物治疗疾病信号途径的多通道调控,强调药物与疾病靶基因之间的彼此作用及关联,这与中药多种成分、多靶点及治疗疾病的多通道调控等特性相类似[4,5]。三七,药性甘、微苦、温,为“血证要药”,为中医眼科治疗VH 等眼底血症的常用组分药物。有研究提示单味中药三七对VH 具有良好的疗效,但关于三七治疗VH 的深入药理作用机制或信号途径尚未得到阐明[6,7]。因此,本研究进一步探索了三七治疗VH的网络药理学机制,为三七治疗VH 的分子途径等内容提供更加全面的认识,以期为三七治疗VH 的基础和临床研究提供参考依据。
1 资料与方法
1.1 三七活性成分及其靶点获取
通过TCMSP 数据库[8]检索三七的有效成分,根据药物口服生物利用度(oral bioavailability,OB)>30%及药物相似性(drug likeness,DL)>0.18 筛选出主要有效活性成分,并在该数据库中获取主要有效成分的相关作用靶点。
1.2 疾病相关靶点的检索与筛选
以“vitreous hemorrhage”为检索词,Gene Cards(https://www.genecards.org/)及OMIM(https://data.omim.org/)数据库被用来检索获得VH 相关的疾病靶点。随后将VH 相关靶点与三七有效成分靶点进行交集映射,获得三七治疗VH 的潜在靶点。
1.3 构建蛋白互作(protein-protein interaction ,PPI)网络和“三七-活性成分-VH-靶蛋白”可视化网络图
将上述获得的VH-三七有效活性成分共同靶点输入到STRING(https://string-db.org/)平台建立三七活性成分靶蛋白和VH 相关靶蛋白的PPI 网络图;使用Cytoscape 3.7.2 软件构建“三七-活性成分-VH-靶蛋白”可视化网络图。
1.4 富集分析
为更深入探究三七治疗VH 的多生物过程情况,利 用R 软 件 和DAVID(https://david.ncifcrf.gov/)对三七治疗VH 潜在靶点进行基因本体(Gene ontology,GO)生物过程富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)的代谢通路富集分析[9]。
2 结果
2.1 三七有效成分筛选
将三七关键词输入到TCSMP 数据库后,将三七有效成分经OB 及DL 条件进行过滤,最终得到8种有效活性成分,见表1。
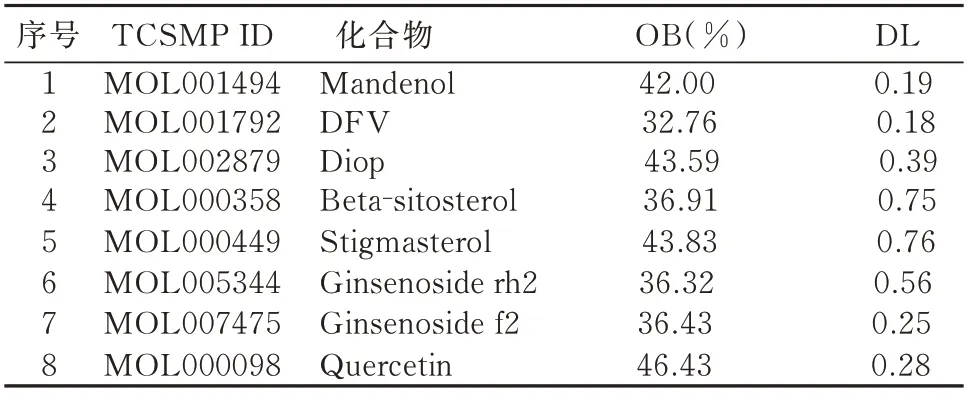
表1 三七有效成分筛选结果Tab 1 Active ingredients from panax notoginseng
2.2 疾病靶点筛选
Gene Cards 和OMIM 数据库进行检索后获取VH 的疾病靶点1 387 个,将获取的VH 疾病靶点与三七成分相关靶点通过软件取交集后过滤出共同靶蛋白75 个,韦恩图见图1。
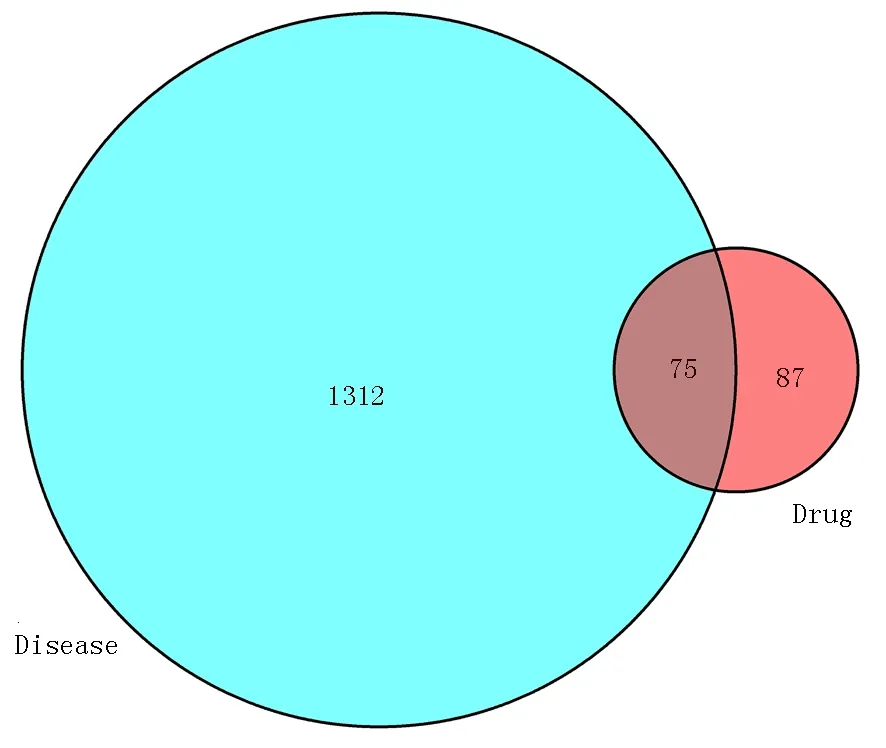
图1 三七与VH 疾病靶点的韦恩图Fig 1 Venn diagram of notoginseng and VH disease targets
2.3 PPI 网络构建
将VH-三七有效成分共同靶点输入STRING 平台进而建立靶蛋白互作网络图,见图2。根据Count值筛选出前30 位核心作用靶基因,如图2 柱状图,前5 位分别为蛋白激酶B(AKT1)、CASP3、血管内皮生长因子A(VEGF-A)、白细胞介素6(IL-6)和基质金属蛋白酶9(MMP-9),涉及的信号途径包括血管生成、炎症、氧化应激、细胞凋亡等。
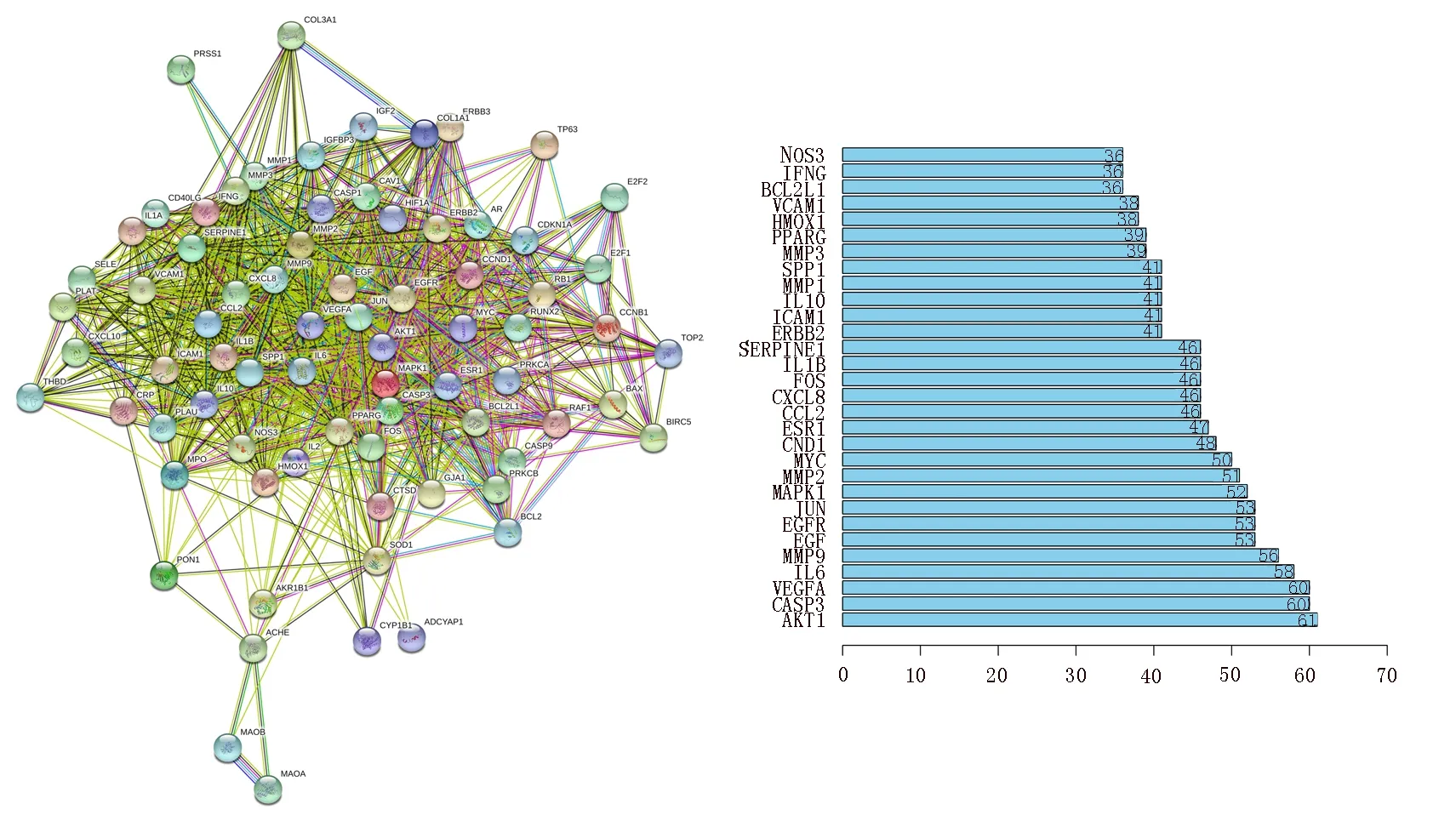
图2 三七与VH PPI 网络图Fig 2 Notoginseng and VH PPI network diagram
2.4 “三七-活性成分-VH-靶蛋白”可视化网络的构建
使用Cytoscape 3.7.2 构建三七治疗VH 的“三七-活性成分-VH-靶蛋白”可视化网络图,见图3。在该网络中,共包含节点82 个,其中三七、VH 节点各1 个,三七有效成分节点5 个(表1 内8 个三七有效成分中,有3 个成分无对应的VH 靶点),三七治疗VH 的潜在靶点75 个,含边170 条。其中槲皮素(quercetin)、人参皂苷RH2(ginsenoside rh2)、β-谷甾醇(beta-sitosterol)等成分节点相关的节点数较多,是三七治疗VH 的主要有效成分。
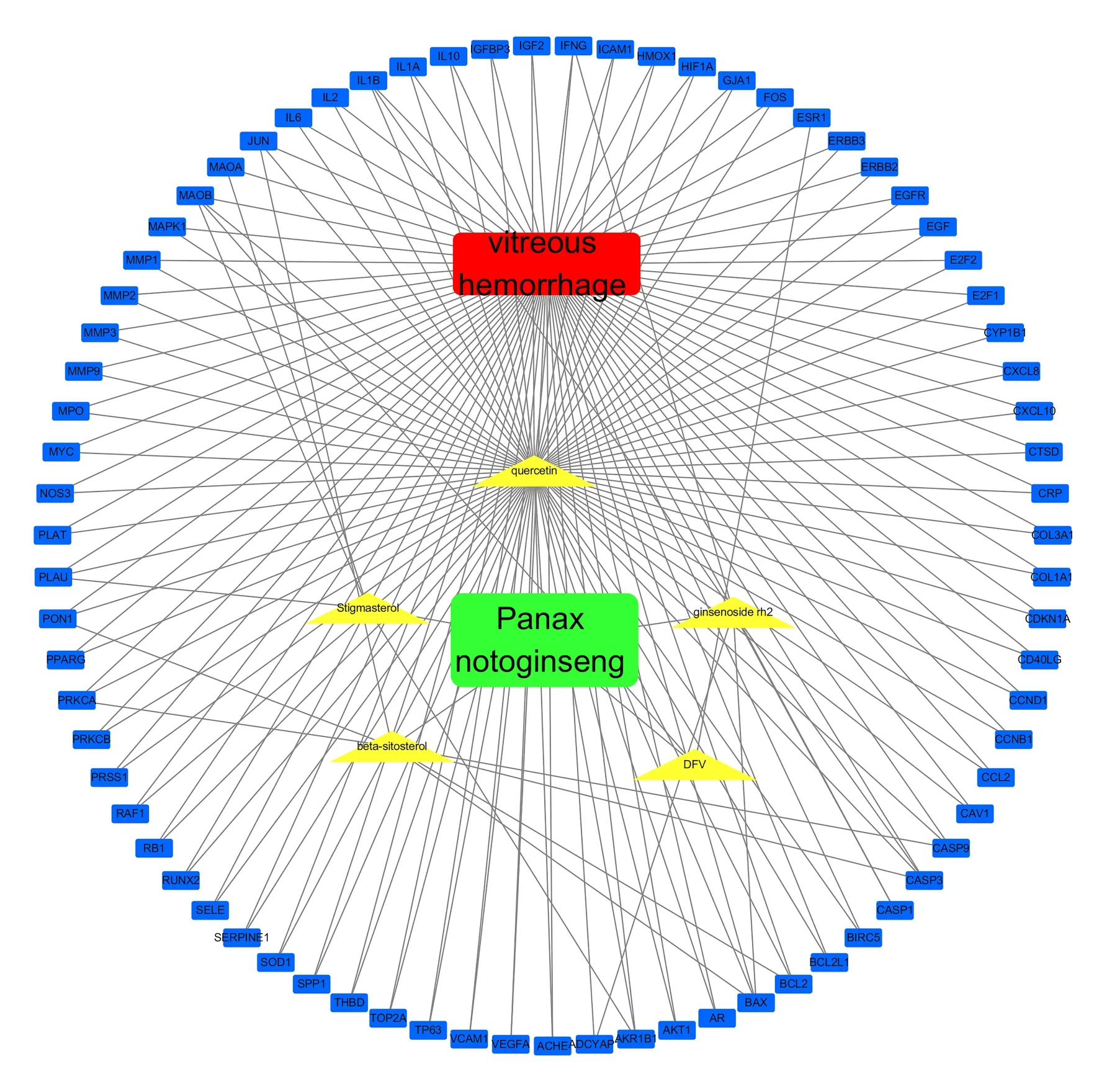
图3 三七治疗VH 的“药物-活性成分-疾病-靶蛋白”网络Fig 3 “drug‑active component‑disease‑target protein”network of panax notoginseng in the treatment of VH
2.5 GO 功能富集分析
GO 富集结果显示,三七治疗VH 的靶点影响了包括细胞因子活性、受体配体活性、细胞因子受体结合、生长因子受体结合等81 个生物学过程,见图4(前20 位)。
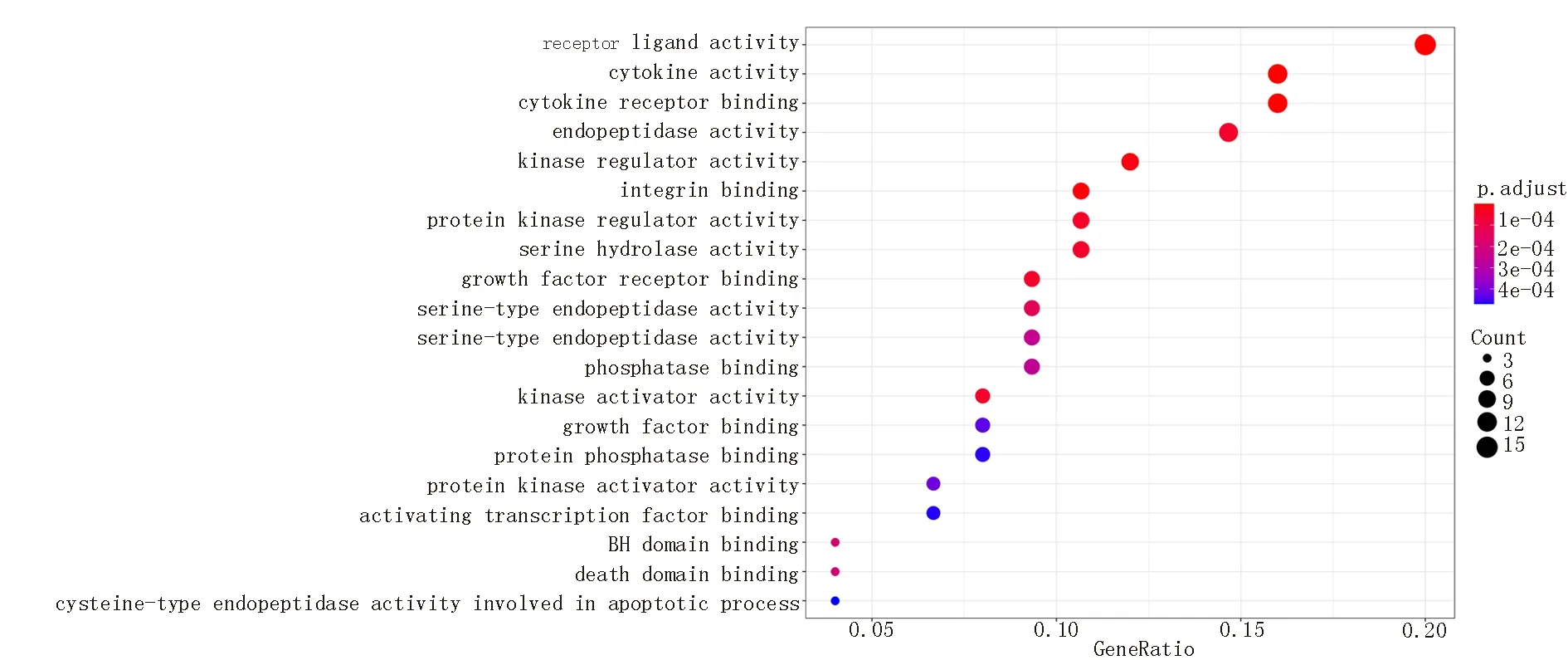
图4 三七和VH 共同靶蛋白GO 功能富集分析气泡图(前20 位)Fig 4 Bubble diagram of GO functional enrichment analysis of notoginseng and VH co‑target protein(top 20)
2.6 KEGG 通路富集分析
本过程筛选出的信号途径共143 条,主要富集的通路包括有糖尿病并发症的AGE-RAGE 信号通路、乙型肝炎、流体剪切应力与动脉粥样硬化、内分泌抵抗、缺氧诱导因子-1 信号途径、肿瘤坏死因子信号通路等,见图5。
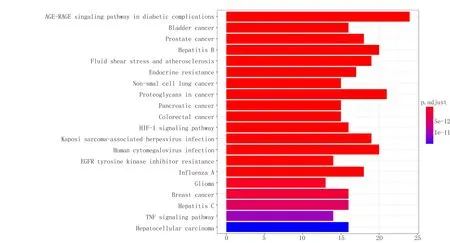
图5 三七和VH 共同靶蛋白KEGG 富集分析(前20 位)Fig 5 KEGG enrichment analysis of notoginseng and VH co‑target protein(top 20)
3 讨论
VH 是临床上引发患者视功能下降甚至致盲的最常见的疾患之一,其病理特点是视网膜缺血、缺氧 和 异 常 新 生 血 管(neovascularization,NV)形成[1,10,11],炎症、NV、氧化应激等是非外伤性玻璃体积血形成的关键病理因素[12,13]。
本研究确定了三七治疗VH 的主要药物成分是槲 皮 素(quercetin)、人 参 皂 苷RH2(ginsenoside rh2)、β-谷甾醇(beta-sitosterol)等。三七治疗VH 的PPI 网络分析结果显示,AKT1、CASP3、VEGF-A、IL-6、MMP-9 等可能是三七发挥治疗作用的潜在关键靶点。槲皮素是黄酮类化合物家族黄酮醇亚类的主要代表,具有强大的抗炎、抑制NV 形成、抗氧化应激等作用[14-16]。相关研究也表明β-谷甾醇能发挥抗炎、抗氧化等作用[17]。人参皂苷RH2 既往研究多集中在抗肿瘤、抗过敏及调节免疫等方面,在玻璃体积血相关研究中涉及甚少[18]。
Akt 是PI3K 的下游效应因子,由于Akt 通路在促进细胞存活、抑制细胞凋亡等生物过程中的整合作用,其被称为生存激酶[19]。caspase-3 水平是检测细胞凋亡的可靠标志[20]。相关研究提示槲皮素可通过降低视网膜中caspase-3 水平、增加Bcl-2 的表达、增强视网膜中Akt 的表达等发挥其抗凋亡作用[21]。细胞外基质(extracellular matrix ,ECM)在内皮细胞的移行、黏附、管腔重构等异常新生血管的发生中起关键作用[4]。VEGF 已被证明是NV 形成的重要介质,与糖尿病性视网膜病变(diabetic retinopathy ,DR)关系密切[11]。VEGFA 是目前研究最多的VEGF 家族成员,它被认为是介导DR 进展的关键因素之一,在增强血管通透性和刺激NV 方面起着关键作用[11]。VEGF-A 还可活化下游PI3K/Akt 途径发挥促NV 形成功能[22]。有研究提示槲皮素及其衍生物8-methyl pentamethyl 可通过抑制VEGF 受体2 的活化,从而抑制PI3-K/Akt 活化和Ras 下游级联,发挥抑制NV 的作用[23]。基质金属蛋白酶(matrix metalloproteinase ,MMP)是参与ECM 降解和结缔组织重塑的关键蛋白酶,能发挥调控组织修复和细胞信号传导等生物学功能。研究证明MMP-9 通过由Ang2 调控或定位细胞凋亡相关蛋白(如CASP3)诱导细胞凋亡,在DR 进展中扮演着一个重要角色[24]。再者,在高血糖状态下,MMP-9 的活性增加,基底膜的降解加快,疏松细胞结构,为NV 的形成提供营养和生长空间[25,26]。IL-6可通过调节VEGF 表达、激活转录因子STAT3 等途径参与调控VH 等眼内疾病的炎症、血管生成等信号途径[27,28]。槲皮素通过抑制氧化应激和阻断炎性细胞因子如IL-6 的产生,可以减轻糖尿病患者视网膜的血管渗漏和NV 的形成[29,30]。
生物信息富集结果发现三七治疗VH 作用较大的分子功能包括细胞因子活性、受体配体活性、细胞因子受体结合等[10,11,31]。发挥关键功能的信号有AGE-RAGE、HIF-1、TNF 等;AGE-RAGE 信号通路可通过氧化应激、炎症反应等加重DR 患者血管损伤,AGEs 通过影响ECM,改变细胞内信号传导,进而改变靶组织中蛋白质的结构和功能,与系膜细胞、内 皮 细 胞 等 特 异 性 受 体 结 合[32,33]。HIF-1 信 号途径中的HIF-1 是机体维持内环境氧稳态重要的细胞因子,其在组织如视网膜缺血、缺氧时,表达会急剧上调,从而通过诱导VEGF 等细胞因子发挥促血管新生及加剧血管渗漏的作用,导致玻璃体积血等病变产生;巨噬细胞介导的慢性炎症是VH 的另一大病理特征,巨噬细胞可分泌产生TNF 信号途径最关键的细胞因子TNF-α,其可激活磷脂酶A2 进而导致视网膜血管等组织通透性增加,致使红细胞、细胞因子、血清蛋白等渗漏到组织间隙,引发玻璃体积血[34]。相关文献报道三七提取物通过清除羟自由基和超氧自由基,可以防止视网膜色素上皮细胞凋亡,说明三七具有抗氧化能力[35]。另有研究指出三七可通过抗氧化作用改善微循环障碍,从而增加血液流动,消除血瘀[36];三七的抗炎作用可能是其主要成分之一的槲皮素通过干扰MAPKs 和Akt进一步减弱NF-κB 信号,从而减轻炎症[37]。三七也可通过抑制玻璃体中VEGF 等细胞因子表达而达到治疗VH 作用[4],但通过何种信号途径发挥上述作用尚未得到解释,以上网络药理学研究结果则可能为其带来相应的答案。
本研究探讨了三七的有效成分及其治疗VH 的可能药理学机制,发现三七治疗VH 可能与抗血管生成、抗炎症及调控细胞凋亡和氧化应激等生物学过程密切相关。笔者在这些生物过程的相关途径中确定了AKT1、CASP3、VEGF-A、IL-6、MMP-9等五个关键核心靶点。本研究为三七治疗VH 的有效成分及靶蛋白的筛选提供了预测理论依据,但仍需结合体内外实验进一步验证有效成分及靶标的作用机制。

