基于VEGFR2 介导的Ras/MAPK 信号通路探讨补肾安胎冲剂治疗复发性流产的作用机制
常 韦,李伟莉,陆莎莎
(1.安徽中医药大学,安徽 合肥230012;2.安徽中医药大学第一附属医院妇产科,安徽 合肥230031)
复 发 性 流 产(recurrent spontaneous abortion,RSA)是指连续发生3 次或3 次以上与同一性伴侣并于妊娠28 周前的胎儿丢失,其中包括非肉眼所见的妊娠[1]。但近年发现曾有过2 次自然流产史的患者,第3 次妊娠的流产率高达50%左右,故有学者认为可将2 次流产史也归为RSA[2]。RSA 病因十分复杂,包括染色体异常、解剖异常、内分泌紊乱、自身免疫异常、血栓前状态、男方精液异常等多方面因素,同时与女性生活环境、心理压力呈现出一定的相关性。临床上有许多病人反复自然流产找不到具体病因[3],对其家庭生活及心理带来了较大的压力。近年关于RSA 的研究及笔者前期研究均表明,母胎界面血管生成障碍与RSA 有着密不可分的联系[4]。本院内制剂补肾安胎冲剂对RSA 患者保胎效果显著。笔者前期研究证明补肾安胎冲剂可通过增加RSA 小鼠蜕膜组织的血管数量,同时提高其血管管壁的通透性来发挥保胎的功效[5]。本研究通过体外实验,观察补肾安胎冲剂含药血清对胎盘微血管内皮细胞Ras/MAPK 信号通路的影响,从分子层面探讨补肾安胎冲剂治疗RSA 的作用机制。
1 材料与方法
1.1 胎盘微血管内皮细胞
标本来自就诊于安徽中医药大学第一附属医院妇科的健康孕妇行人工流产术后的绒毛组织,孕龄为6~8 周。根据《医疗机构管理条例》,在实验进行前将实验方案告知对方,并签署知情同意书。
1.2 实验动物
8 周 龄SPF 级 雄 性 大 鼠20 只,体 重 为(230±20)g,由安徽医科大学实验动物中心提供。动物合格证号scxk(皖)2017-001,饲养于安徽中医药大学动物实验中心。饲养条件:实验中心通风干燥,温度控制在22℃左右,相对湿度约为50%,每天采光与避光饲养各12 h,自由饮食及饮水。所有动物在正式给药前适应性喂养1 周。本实验通过安徽中医药大学实验动物伦理委员会审查。
1.3 实验药物
补肾安胎冲剂为安徽中医药大学第一附属医院院内制剂,组成药物有:菟丝子、桑寄生、川断、熟地、炒白术、白芍、党参、炙黄芪、黄芩等,批号:皖药制字BZ20080017。
1.4 主要试剂与仪器
DMEM(批 号:AE27369264),PBS(批 号:AE27429763),内皮细胞专用培养基(厂家武汉原生原 代),双 抗(批 号:20190530),percoll(货 号:WX0181),RPMI1640 培养基(批号:AE24464298),MTT 检测试剂盒(批号:BB18121),Transwell 小室(批号:28218051),基质胶(批号:8113007),TGF-α(批号:31606),Salirasib(批号:5685),IGF-1(批号:331323),LY294002(批号:40419191010),RIPA 细胞裂解液(货号:P0013B),SDS(批号:1029H032)、Glycine(批号:709R064);PAGE 胶促凝 剂(批 号:1020F024)、Tris(批 号:1124Z071)、Tween-20(批号:505Q016)均购于Solarbio 公司;PVDF 膜(批号:R8KA7385);山羊抗小鼠IgG(批号:142637)、山羊抗兔IgG(批号:136080);β-Actin(批号:19AW0404);Ras(批号:00022);MAPK(批号:GR3215674-1);Western 一抗二抗去除液(批号:051418180626),Trizol(批号:204403),DEPC-H2O(批 号:1803G26),Novostart SYBR qPCR Super-Mix Plus(批号:0512841),RevertAidTMfirst Strand cDNA Synthesis Kit(批号:00691399),进口羊血清工作液(批号:WK173310),PBS 缓冲液粉末(批号:18070201),荧光二抗(批号:AlexaFluor®488)-绿色(批 号:GR3203087-1),DAPI 染 色 液(批 号:071618190213),抗荧光淬灭封片液(批号:111318190306)。
移液枪(型号:KE0003087/KA0056573),离心机(型号:80-2),培养箱(型号:3111),倒置显微镜(型号:CKX31);普通电泳仪、电泳槽、转膜仪均购于Tanon 公司;普通PCR 仪(批号:K960),低速迷你离心机(批号:LX 300),高速台式冷冻离心机(批号:JW-3021HR),荧光定量PCR 仪(批号:PIKOREAL 96),微孔板迷你离心机(批号:MINI-P25),PIKO Plate Illuminator(批号:10212432C)。
1.5 方法
1.5.1 培养构建胎盘微血管内皮细胞 将用生理盐水冲洗过的绒毛组织置于灭菌离心管中,加入预冷的含青霉素与链霉素的PBS 缓冲液,浸泡30 min后置于加入了抗生素的DMEM 培养基中,剔除掉结缔组织,留取三级绒毛及末端,并将其剪碎。用配制好的含有0.1%的Ⅰ型胶原酶及0.2%分散酶的DMEM 培养基将组织碎片吸取到灭菌离心管中,37℃水浴,振荡消化40 min。取混合液用灭菌的200 目滤膜过滤,收取滤膜上组织,用配制好的含0.02%Ⅰ型DNA 酶的0.25%的胰酶溶液吸取到另一个灭菌离心管中,37℃振荡消化20 min 后加入5 mL 血清。所得混合液用200 目滤膜过滤,滤液置于4℃,1 000 r/min,离 心10 min,弃 上 清。 1 mL DMEM 培养基重悬细胞,沿管壁加入到25%、30%、35%的不连续percoll 梯度中,20℃400 r/min,离心20 min。收集白色絮状层细胞,将其加入DMEM 培养基,4℃下1 000 r/min 离心5 min,弃上清。使用内皮细胞专用培养基重悬细胞,接种到12孔板,静置于37℃、5% CO2的细胞培养箱培养。24 h 后换液,以后每2~3 d 半量换液。培养的细胞单层融合至70%左右即可传代,加入1 mL 胰酶37℃消化2 min,加入适量含血清培养基终止消化,将细胞吹打下来。4℃1 000 r/min 离心5 min,弃上清,重悬细胞沉淀接种到6 孔板,置于培养箱静置后,将培养液置于另一培养孔中继续培养,纯化内皮细胞。
1.5.2 药物血清制备及筛选 补肾安胎冲剂含药血清的制备:选择正常健康SPF 级SD 大鼠20 只,随机分为两组分别为含药血清组和空白组,含药血清组予以补肾安胎冲剂灌胃,补肾安胎冲剂给药剂量根据“人和动物体表面积折算的等效剂量比率表”换算后得出为11.7 g/kg,空白组予以等量的生理盐水,每日给药2 次,连续7 d,于末次给药后1 h腹主动脉采血,操作过程严格无菌,3 000 r/min 离心15 min,分离得出血清。血清以56℃水浴灭活30 min,用0.22 μm 无菌滤膜过滤除菌并组内进行混合,置-80℃保存以备体外实验使用。筛选:胰酶消化对数期细胞,终止后离心收集,制成细胞悬液,每孔加入100 μL,将接种好的细胞培养板放入培养箱中培养,5% CO2、37℃孵育过夜,倒置显微镜下观察。加入不同浓度的含药血清,培养24 h,每孔加入10 μL MTT 溶液,继续培养4 h。终止培养后溶解结晶,在酶联免疫检测仪检测OD 值。
1.5.3 细胞转染siRNA 及筛选 本实验根据血管内皮生长因子受体2(Vascular Endothelial Growth Factor Receptor 2,VEGFR2)在GenBank 中的序列设计合成3 对相应的小干扰RNA(siRNA),和一对与大鼠基因无同源性的阴性对照组分为以下4 组:siRNA1 组、siRNA2 组、siRNA3 组、siRNA-NC 组进行转染,以期获得对VEGFR2 抑制作用较明显的siRNA,供后续实验进行(具体引物序列见表1)。取对数生长期的胎盘微血管内皮细胞以2.5×105个/孔接种在6 孔板上,置于37℃、5%CO2细胞培养箱内培养,细胞生长至50% 左右开始转染;取出siRNA 各组,0.50 D siRNA-NC 用62.5 μL 超纯水溶解,10 D siRNA 组 用125 μL 超 纯 水 溶 解 使 其 终 浓度为20 μmol/L;配置转染试剂:取2 个无菌离心管,分别加入250 μL 无血清培养基,然后一管加入5 μL空载,另一管加入5 μL Lip2000,分别混匀静置5 min 后再将两管混匀,室温放置20 min;其他各组同上;将混匀后的培养基(500 μL)加入到经过无血清培养基洗涤3 次后的6 孔板中,轻轻摇晃2 min,放到培养箱培养48 h 检测转染效率。
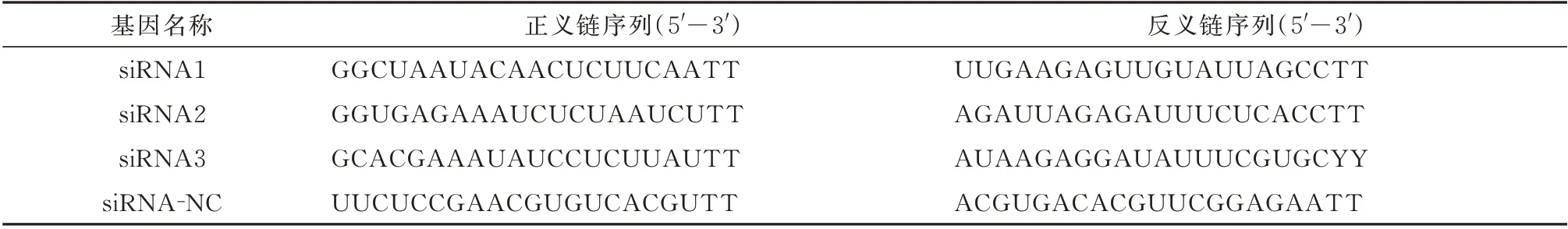
表1 引物序列Tab 1 Primer sequence
1.5.4 分组及干预方法 取对数生长期的胎盘微血管内皮细胞以2.5×105个/孔接种于96 孔板,细胞生长至50%~60% 时,分为5 组:正常血清组、siRNA-NC 正常血清组、药物血清组、siRNA 正常血清组、siRNA 药物血清组。正常血清组加入正常大鼠血清培养;siRNA-NC 正常血清组转染了siRNANC,加入正常血清;药物血清组加入含20%补肾安胎冲剂含药血清;siRNA 正常血清组转染了siRNA,加入正常血清;siRNA 药物血清组转染SiRNA1,培养液中加入药物血清,各组均培养24 h。
1.5.5 实时荧光定量PCR 技术检测胎盘微血管内皮细胞Ras、MAPK mRNA 的相对表达量 各组血清干预培养细胞24 h 后,收集各组细胞沉淀,加入1 mL TRIzol 及0.2 mL 氯仿,剧烈振荡15 s,室温放置5 min,4℃12 000 r/min 离心10 min,取上清液加入到另一EP 管中,加入0.5 mL 预冷的异丙醇,温和混匀,冰上孵育30 min,离心15 min,弃去上清,加入1 mL 预冷的75℅乙醇漂洗2 次,待室温干燥RNA 沉淀,加入20 μL DEPC 水,微量核酸仪检测RNA 浓度。利用Primer-Script 反转录试剂盒将RNA 反转录为cDNA,按照荧光定量试剂盒说明配制反应体系,置于定量PCR 仪检测mRNA 的相对表达水平。所用引物序列见表2。
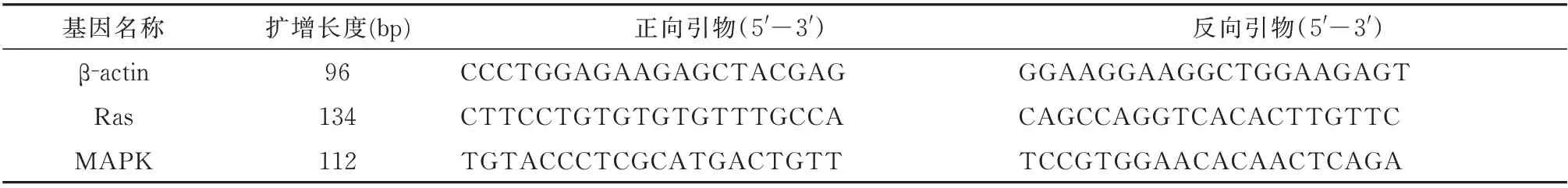
表2 引物序列Tab 2 Primer sequence
1.5.6 Western blot 技术检测胎盘微血管内皮细胞Ras、MAPK 蛋白的表达 各组血清干预培养细胞24 h 后,2 500 r/min,10 min,每106细胞加入RIPA细胞裂解液1 mL(内含1 mmol/L PMSF)后置于冰上进行裂解30 min,12 000 r/min 离心10 min,取上清。按照1∶4 加入5× SDS-PAGE 蛋白上样缓冲液。水浴加热10 min,待样品冷却到室温后,把蛋白样品直接上样到SDS-PAGE 胶加样孔内。将滤纸和PVDF 膜,浸入转膜缓冲液中5 min。接通电源,300 mA 恒流转膜。转膜完毕后,立即把蛋白膜放置到预先准备好的Western 洗涤液中,漂洗后加入Western 封闭液,水平摇床室温封闭2 h。参考一抗的说明书,分别按照合适的比例用一抗稀释液进行稀释,4℃缓慢摇动孵育过夜。 加入洗涤液(PBST),每次洗涤10 min,共洗涤3 次。参考二抗的说明书,按照1∶10 000 用二抗稀释液稀释辣根过氧化物酶标记的二抗。室温孵育2 h。加入洗涤液(PBST),每次洗涤10 min,共计3 次。参考相关说明书,使用ECL 发光试剂盒来检测蛋白。
1.5.7 免疫荧光技术检测胎盘微血管内皮细胞中Ras、MAPK 蛋白的表达 培养好各组细胞后,吸除培养基,PBS 轻洗2×3 min,4% 多聚甲醛固定20 min,PBS 轻洗3×3 min;0.3% TritonX-100(PBS 配制)室温通透20 min;除去TritonX-100,使用PBS 轻洗细胞;山羊血清37℃封闭30 min,按说明滴加一抗,37℃孵育60 min,使用PBS 轻洗除去一抗;滴加足够量的二抗37℃避光孵育30 min,使用PBS 轻洗除去二抗;DAPI 复染细胞核避光5 min;使用PBS洗去多余的DAPI;将爬片取出,抗荧光淬灭剂封片;荧光显微镜下观察。根据荧光二抗的荧光颜色,通过荧光显微镜观察细胞核在紫外的激发下为蓝色,阳性表达为相应荧光素标记的绿光。
1.6 统计学处理
结果采用SPSS 21.0 统计软件处理,实验数据用均数±标准差(±s)表示,多组间比较采用单因素方差分析或秩和检验,两组间比较采用t 检验分析,P<0.05 为差异具有统计学意义。
2 结果
2.1 补肾安胎冲剂含药血清最佳作用浓度筛选
根据各组OD 值均值绘制如下曲线,可见补肾安胎冲剂含药血清在20%浓度时达到最佳作用效果,后浓度继续增加,作用效果不再增强。故本实验研究选用20%药物浓度为后续药物干预浓度。见图1。
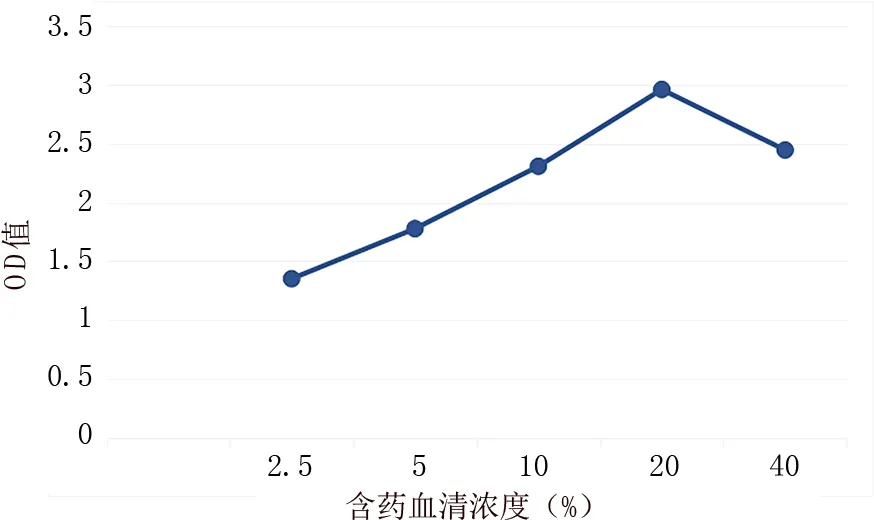
图1 补肾安胎冲剂含药血清治疗浓度筛选折线图Fig 1 Line diagram of treatment concentration screening of BSAT Granule containing drug serum
2.2 细胞转染siRNA 筛选结果
在各组内参β-actin mRNA 的表达水平一致时,细胞正常对照组、siRNA-NC 组中的VEGFR2 mRNA 表达几乎无变化(P=0.948),而siRNA1(P=0.000)、siRNA2(P=0.028)、siRNA3(P=0.01)表现出不同程度的抑制作用,其中以siRNA1 组对VEGFR2 的沉默作用最为明显。见表3。
表3 siRNA 筛选结果(±s)Tab 3 siRNA screening results(±s)
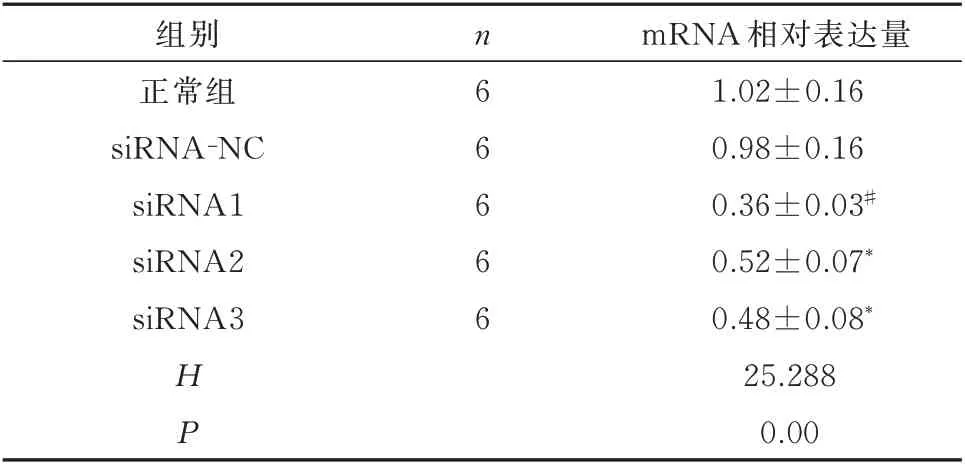
表3 siRNA 筛选结果(±s)Tab 3 siRNA screening results(±s)
注:与正常组比较,*P<0.05,#P<0.01。
组别正常组siRNA-NC siRNA1 siRNA2 siRNA3 mRNA 相对表达量1.02±0.16 0.98±0.16 0.36±0.03#0.52±0.07*0.48±0.08*25.288 0.00 n 6 6 6 6 6 HP
2.3 实时荧光定量PCR 技术检测补肾安胎冲剂含药血清对Ras、MAPK mRNA 表达水平的影响 正常 组 和 阴 性 对 照 组Ras(t=0.963,P=0.358)、MAPK(t=1.485,P=0.168)mRNA 的表达无明显差异(P>0.05);药物血清组细胞Ras(t=-6.085,P<0.001)、MAPK(t=-6.913,P<0.001)mRNA 的表达明显高于正常血清组(P<0.01);siRNA1 正常血清组较正常血清组相比Ras(t=8.910,P<0.001)、MAPK(t=7.109,P<0.001)mRNA 的表达明显下降(P<0.01),表明siRNA1 对Ras、MAPK mRNA 的沉默效果十分明显;siRNA1 药物血清组与SiRNA1 正常血 清组Ras(t=6.475,P<0.001)、MAPK(t=5.395,P<0.001)mRNA 的表达相比有明显差异(P<0.01),表明补肾安胎冲剂可以上调VEGFR2 siRNA1 内 皮 细 胞 的Ras、MAPK mRNA的表达。见表4。
表4 RT-qPCR 技术检测Ras、MAPK mRNA 表达水平(n=6,±s)Tab 4 Ras and MAPK mRNA expression levels detected by RT-qPCR(n=6,±s)
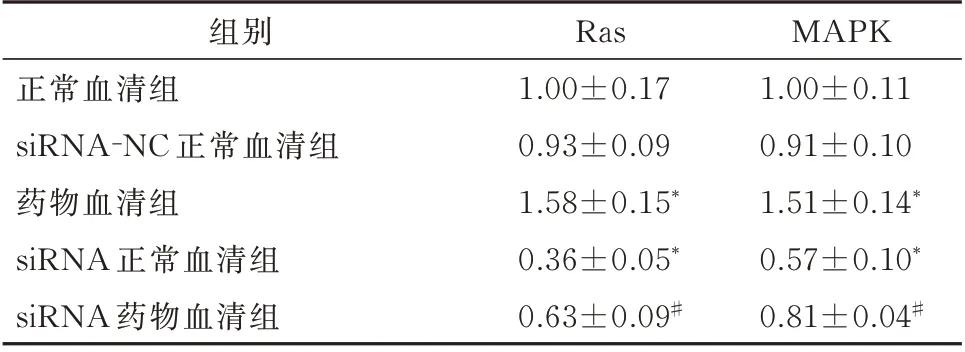
表4 RT-qPCR 技术检测Ras、MAPK mRNA 表达水平(n=6,±s)Tab 4 Ras and MAPK mRNA expression levels detected by RT-qPCR(n=6,±s)
注:与正常组比较,*P<0.01;与siRNA1 正常血清组比较,#P<0.01。
MAPK 1.00±0.11 0.91±0.10 1.51±0.14*0.57±0.10*0.81±0.04#组别正常血清组siRNA-NC 正常血清组药物血清组siRNA 正常血清组siRNA 药物血清组Ras 1.00±0.17 0.93±0.09 1.58±0.15*0.36±0.05*0.63±0.09#
2.4 Western blot 技术检测补肾安胎冲剂含药血清对Ras、MAPK 蛋白表达水平的影响
正常组和阴性对照组Ras(t=-0.191,P=0.858)、MAPK(t=0.054,P=0.959)蛋白无明显差异(P>0.05);药 物 血 清 组Ras(t=-3.106,P=0.036)、MAPK(t=-2.905,P=0.044)蛋白的表达明显高于正常血清组(P<0.05);siRNA1 正常血清组较正常血清组相比Ras(t=14.284,P<0.001)、MAPK(t=9.589,P<0.001)蛋白的表达明显下降(P<0.01),表明siRNA1 对VEGFR2 的沉默效果十分明显;siRNA1 药物血清组与siRNA1 正常血清组相比Ras(t=10.727,P<0.001)、MAPK(t=10.854,P<0.001)蛋白的表达有明显差异(P<0.01),表明补肾安胎冲剂可以上调转染了VEGFR2 siRNA1 的内皮细胞的Ras、MAPK 蛋白的表达。 见表5、图2。
表5 Western blot 技术检测Ras、MAPK 蛋白表达水平(n=6,±s)Tab 5 The expression levels of Ras and MAPK proteins detected by Western blot technology(n=6,±s)
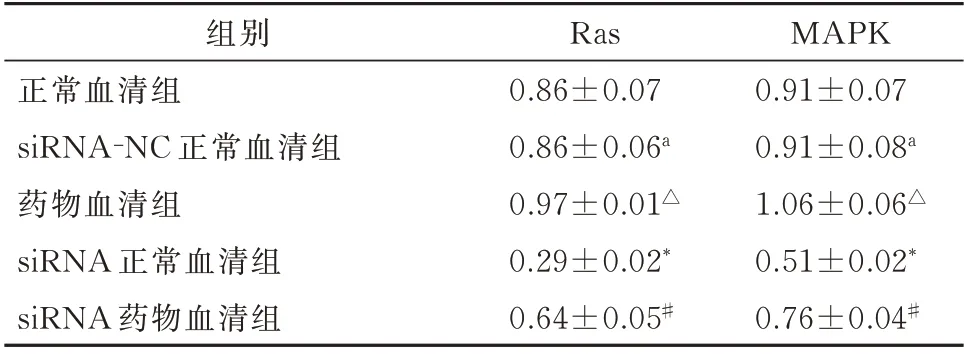
表5 Western blot 技术检测Ras、MAPK 蛋白表达水平(n=6,±s)Tab 5 The expression levels of Ras and MAPK proteins detected by Western blot technology(n=6,±s)
注:与正常组比较,*P<0.01,△P<0.05;与siRNA1 正常血清组比较,#P<0.01。
MAPK 0.91±0.07 0.91±0.08a 1.06±0.06△0.51±0.02*0.76±0.04#组别正常血清组siRNA-NC 正常血清组药物血清组siRNA 正常血清组siRNA 药物血清组Ras 0.86±0.07 0.86±0.06a 0.97±0.01△0.29±0.02*0.64±0.05#
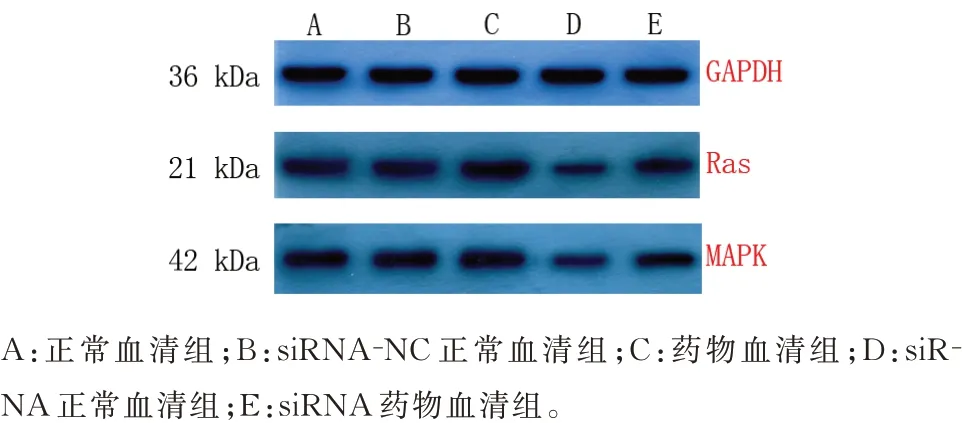
图2 各组细胞Ras、MAPK 蛋白表达条带Fig 2 Ras and MAPK protein expression bands in each group
2.5 免疫荧光技术检测补肾安胎冲剂含药血清对Ras、MAPK 蛋白表达水平的影响
正常组和阴性对照组Ras(t=0.221,P=0.829)、MAPK(t=0.371,P=0.726)蛋白无明显差异(P>0.05);药物血清组细胞Ras(t=-2.380,P=0.049)、MAPK(t=-2.247,P=0.048)蛋白的表达明显高于正常血清组(P<0.05);siRNA1 正常血清组较正常血清组Ras(t=6.355,P<0.001)、MAPK(t=7.144,P<0.001)蛋白的表 达 明显下降(P<0.01),表明siRNA1 对VEGFR2 的沉默效果十分明显;siRNA1 药物血清组与siRNA1 正常血清组Ras(t=3.391,P=0.007)、MAPK(t=5.726,P<0.001)相比有明显差异(P<0.01),表明补肾安胎冲剂可以上 调VEGFR2 siRNA1 内 皮 细 胞 的Ras、MAPK 蛋白的表达。见表6。胎盘微血管内皮细胞细胞核在紫外的激发下为蓝色,而阳性表达则为Ras、MAPK相对应荧光素标记的绿光,可见正常组和阴性对照组Ras、MAPK 的阳性表达无明显差异;药物血清组与siRNA1 正常血清组相比,Ras、MAPK 的阳性表达增强;siRNA1 药物血清组与siRNA1 正常血清组相比,Ras、MAPK 阳性表达增强表明加入了补肾安胎冲剂药物血清后相对应的Ras、MAPK 蛋白表达明显增多,在图中表现为绿色标记的荧光增强。见图3。
表6 免疫荧光技术检测Ras、MAPK 蛋白表达水平(n=6,±s)Tab 6 Ras and MAPK protein expression levels detected by immunofluorescence technology(n=6,±s)
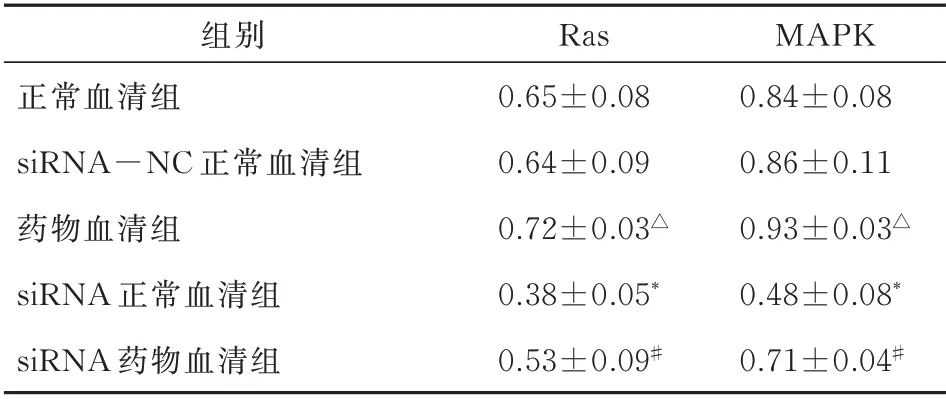
表6 免疫荧光技术检测Ras、MAPK 蛋白表达水平(n=6,±s)Tab 6 Ras and MAPK protein expression levels detected by immunofluorescence technology(n=6,±s)
注:与正常组比较,*P<0.01,△P<0.05;与siRNA1 正常血清组比较,#P<0.01。
MAPK 0.84±0.08 0.86±0.11 0.93±0.03△0.48±0.08*0.71±0.04#组别正常血清组siRNA-NC 正常血清组药物血清组siRNA 正常血清组siRNA 药物血清组Ras 0.65±0.08 0.64±0.09 0.72±0.03△0.38±0.05*0.53±0.09#
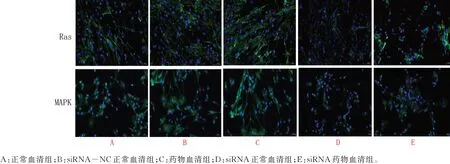
图3 各组细胞Ras、MAPK 蛋白表达荧光图Fig 3 Fluorescent images of Ras and MAPK protein expression in each group
3 讨论
RSA 为临床妊娠较常见的并发症,发病率呈现上升趋势,严重影响患者甚至家庭成员的生活质量。其病因复杂多样,部分患者目前尚未发现具体原因,治疗方案上也存在一些争议[6]。目前RSA 的防治机制研究为国内外研究的热点。有研究表明重铸的母胎界面血管是维持妊娠的关键,其本质是血管新生[7]。血管生成与多种调节因子有关,包括促血管生成因子和抑制因子[8-10]。因此如何改善RSA 患者母胎界面血管重铸,将成为治疗RSA 的重要途径。笔者前期研究也表明补肾安胎冲剂能通过调控相关血管因子有效改善RSA 小鼠蜕膜血管生成,从而促进母胎界面的血管形成,降低胚胎丢失率[11]。补肾安胎冲剂治疗RSA 的作用机制可能是通过上调VEGF 信号通路下游的Ras、MAPK的 表 达 水 平[12-14]。Ras/MAPK 信 号 通 路 为VEGF下游的一个常见的信号通路,是细胞内传导的主要途径,在胚胎的生长、细胞的分化过程中发挥重要的 调 控 作 用[15,16]。在 补 肾 安 胎 冲 剂 上 调RSA 小 鼠Ras、MAPK 表达的研究结果基础上,本研究观察其含药血清对Ras、MAPK 表达的影响,以验证补肾安胎冲剂是否通过Ras/MAPK 信号通路影响母胎界面血管生成而发挥保胎作用。
Ras 家 族 包 括K-Ras,H-Ras,N-Ras 3 个 成 员,位于不同染色体上,由不同基因编码。Ras 蛋白为细胞传导通路的重要蛋白,参与了细胞的生长、分化过程[17]。在VEGF 信号通路下游,当机体GTP取代GDP 并与Ras 结合后,Ras 蛋白处于一种活性状态,调控机体细胞周期、细胞分化和血管生成,从而促进细胞的增殖。一方面,在正常机体内,Ras 与GTP 结合后一般处于较低水平,不至于导致细胞过度增殖,保证维持在正常水平;另一方面,Ras 又可与Raf 的N 端作用并使其激活,使得活化后的Raf 磷酸化MAPK 激酶(MAPKK)并相互结合,促使MAPKK 也发生活化,MAPKK 又反过来激活MAPK,二者相互作用。而MAPK 存在人体大部分的细胞内,能使细胞外刺激信号传递至细胞核内,致使细胞增殖等现象发生。活化的MAPK 进入细胞核,增加细胞裂解,使基因表达明显增多,大量的转录因子活化,从而对血管生成等各方面产生影响[12]。本研究运用不同方法检测了胎盘微血管内皮细胞中Ras、MAPK mRNA 及蛋白的表达情况,结果显示,正常组和阴性对照组Ras、MAPK 表达无明显差异,从而排除siRNA 的内源性干扰,保证本研究结果的严谨性;药物血清组细胞Ras、MAPK 的含量明显高于正常血清组,说明补肾安胎冲剂可上调胎盘微血管内皮细胞Ras、MAPK 的表达,这与笔者前期动物实验研究结果相符合;siRNA1 正常血清组相对于正常血清组Ras、MAPK 的表达明显下降,说明筛选后的siRNA1 对VEGFR2 的沉默效果显著,可模拟RSA 患者VEGFR2 下降的一个状态;与siRNA1 正常血清组相比,siRNA1 药物血清组Ras、MAPK 含量明显上升,转染了VEGFR2 siRNA1 后其表达下降,加入了药物血清后明显上升,表明补肾安胎冲剂含药血清可以上调转染了siRNA1 的内皮细胞Ras、MAPK 的表达。与血管生成相关的因子除了VEGF,还包括低氧诱导因子和转化生长因子等,本实验仅检测了VEGF,后续研究可增加其他血管因子指标的检测,以提高实验结果可信度。
综上所述,排除siRNA 等可能干扰的因素,发现经过补肾安胎冲剂含药血清干预后的Ras、MAPK 含量均上升,说明补肾安胎冲剂可能是通过提 高Ras、MAPK 含 量 来 激 活Ras/MAPK 信 号 通路,从而促进母胎界面血管生成,最终发挥其固肾养血安胎的作用。
作者贡献度说明:
常韦:主要撰写人,完成相关资料的收集和分析及论文初稿的写作;李伟莉:项目的构思者及负责人,指导论文写作;陆莎莎:参与相关资料的分析、整理。全体作者都阅读并同意最终的文本。

