当归芍药散加味黄芪对阿霉素诱导的肾病综合征大鼠的治疗作用
范胜楠,欧美凤,王运来,杨 沫,宣自华,许 钒
(安徽中医药大学药学院,安徽 合肥230011)
肾病综合征(nephrotic syndrome,NS)是一种常见的肾脏疾病,临床表现为水肿、蛋白尿和低白蛋白血症,常伴高脂血症[1]。治疗多使用激素和免疫抑制剂,但长期使用会干扰免疫系统,易引发并发症和感染,复发率较高[2]。中医药治疗肾脏疾病历史悠久,以中医理论为基础,在治疗NS 方面具有独特优势。当归芍药散出自张仲景的《金匮要略》,具有养血活血、健脾行水的功效。课题组前期实验研究证实,当归芍药散可降低NS 大鼠尿蛋白,改善电解质紊乱,恢复肾功能[3]。当归芍药散与黄芪配伍可益气、活血、利水,临床治疗NS 疗效显著,但其研究多为临床经验总结,缺少实验研究支持。本文采用尾静脉注射阿霉素建立NS 大鼠模型,并引入生物电阻抗法(Bioelectrical impedance analysis,BIA)评估NS 大鼠各组间水液分布差异,结合尿蛋白、血液生化指标、电解质、免疫功能和肾组织形态学变化,评价当归芍药散、黄芪、当归芍药散加味黄芪对NS 大鼠的治疗效果。
1 材料与方法
1.1 实验动物
动物:SPF级雄性SD 大鼠,体重为(200±20)g,购于安徽省实验动物中心。合格证号:SCXK(皖)2013-002。饲养条件:湿度(45±15)%,温度(23±1.5)℃,12 h 光照和暗照循环,普通饲料,自由饮水。
1.2 主要试剂及仪器
试剂:当归、芍药、川芎、白术、茯苓、泽泻、黄芪均购自安徽协和成药业饮片有限公司,经安徽中医药大学金传山教授鉴定,均符合2015 版《中国药典》标准;阿霉素(浙江海正药业股份有限公司,批号:130704);福辛普利(中美上海施贵宝制药有限公司,批号:1406053);BCA 试剂盒(碧云天生物科技有限公司,批号:P0012S)。
仪器:BX53 光学显微镜(日本Olympus 公司);RM2135 切片机(德国Leica 公司);YB-7B 石蜡包埋机(湖北孝感亚光);Impedi VET BIS1 型实验动物体组成测定分析仪(澳大利亚ImpediMed 公司);1500 型全波长酶标仪(美国Thermo scientific公司)。
1.3 药物制备
当归芍药散提取液按经典处方比例当归∶白芍∶川芎∶白术∶茯苓∶泽泻=3∶16∶8∶4∶4∶8,准确称量各药材饮片,混匀至1 000 mL 的圆底烧瓶中,加入10倍量的75%的乙醇浸泡药材,水浴加热回流1.5 h,滤出药液;再加入8倍量的75%乙醇,继续加热回流1.5 h,过滤并挤压药材滤渣,将2 次滤出的药液合并进行加热浓缩,浓缩至1.72 g/mL 生药浓度药液备用,临用时配制成生药浓度为0.43 g/mL 的药液。当归芍药散加味黄芪提取液按当归∶白芍∶川芎∶白术∶茯苓∶泽泻∶黄芪=3∶16∶8∶4∶4∶8∶16 制备,方法同当归芍药散提取液,浓缩成生药浓度为0.59 g/mL 的药液备用。黄芪提取液按当归芍药散加黄芪提取液中黄芪比例制备,浓缩成生药浓度为0.16 g/mL 的药液备用。准确称取福辛普利加入纯净水配置成0.9 g/L 福辛普利溶液备用。
1.4 造模、分组及给药
雄性SD 大鼠适应性饲养1 周,随机抽取10 只大鼠作为正常组,其余大鼠按体重6 mg/kg 一次性尾静脉注射阿霉素溶液,正常组大鼠注射等容积的生理盐水。于造模后第1 周、第2 周末放入代谢笼内,收集尿液检测蛋白水平。根据造模第2 周末大鼠尿蛋白情况将造模成功的大鼠分为模型组、福辛普利组、黄芪组、当归芍药散组、当归芍药散加味黄芪组,按100 g/mL 灌胃给药,正常组和模型组给予生理盐水,其余各组给予相应药物。每日1 次,连续给药4 周。
1.5 尿蛋白检测
于造模后第1 周、第2 周以及给药第4 周收集尿液,BCA 试剂盒检测尿蛋白。
1.6 动物体液检测
末次给药2 h 后,将大鼠乙醚麻醉,使之四肢垂直躯干,尾巴伸直,平趴在实验台上。将4 个贴电极处的体毛剃干净以便贴电极片或在这4 处插入针电极,按照电极布置图将导线与贴好的电极连结,测量电极两两间的距离,打开仪器,输入大鼠信息,检测大鼠总含水率(TBW)、细胞内液含水率(ECF)和细胞外液含水率(ICF)。
1.7 电解质检测
末次给药24 h 后,各组大鼠以10%水合氯醛麻醉,腹主动脉取血。血液静置30 min,3 500 r/min 离心10 min 取上清,分装备用。使用全自动生化分析仪分别对各组大鼠尿液和血清进行电解质浓度检测。
1.8 血液指标检测
按照试剂盒操作说明检测各组大鼠血清中尿素氮(BUN)、肌酐(Scr)、总胆固醇(TC)、甘油三酯(TG)、总蛋白(TP)、白蛋白(ALB)、免疫球蛋白M(IgM)、免疫球蛋白G(IgG)含量。
1.9 苏木精伊红(HE)染色检测肾组织病理学形态
采集肾组织,置于4%福尔马林中固定48 h,常规制备石蜡组织切片,经HE 染色观察肾组织病理学形态。
1.10 统计学处理
采用SPSS23.0 软件对实验结果进行统计分析,结果按照均数±标准差(±s)表示,组间比较采用ANOVA 进行分析,组内使用LSD 法进行比较,P<0.05 为差异具有统计学意义。
2 结果
2.1 尿蛋白检测
与正常组比较,大鼠建模后第2 周模型组尿蛋白显著升高,给药4 周后与模型组比较,给药组大鼠尿蛋白均显著降低,差异有统计学意义(P<0.01)。当归芍药散加味黄芪组大鼠尿蛋白较当归芍药散和黄芪组改善更明显。见表1。
表1 各组大鼠尿蛋白比较(n=8,g/L,±s)Tab 1 Comparison of urinary protein of rats in each group(n=8,g/L,±s)

表1 各组大鼠尿蛋白比较(n=8,g/L,±s)Tab 1 Comparison of urinary protein of rats in each group(n=8,g/L,±s)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01。
组别正常组模型组福辛普利组当归芍药散组黄芪组当归芍药散加味黄芪组组F给药4 周末11.53±3.21 53.60±10.57**29.30±3.41##31.38±4.18##34.43±7.68##29.90±4.79##37.196建模第2 周17.16±3.84 74.06±15.30**74.38±17.42 75.78±14.87 74.25±14.75 74.70±15.83 0.939
2.2 各组大鼠体液分布情况
与正常组比较,模型组大鼠体内TBW、ICF 显著降低,ECF 显著升高,差异有统计学意义(P<0.01);与模型组比较,各给药组大鼠体内TBW、ECF、ICF 有不同程度的改善;与当归芍药散组和黄芪组比较,当归芍药散加味黄芪组TBW 升高明显,差异有统计学意义(P<0.01)。见表2。
表2 给药4 周后大鼠体液分布情况(n=8,%,±s)Tab 2 Body fluid distribution of rats after 4 weeks of administration(n=8,%,±s)

表2 给药4 周后大鼠体液分布情况(n=8,%,±s)Tab 2 Body fluid distribution of rats after 4 weeks of administration(n=8,%,±s)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01。
组别正常组模型组福辛普利组当归芍药散组黄芪组当归芍药散加味黄芪组F ICF 58.64±0.79 45.80±4.13**56.09±1.42##52.72±1.04##50.51±2.2##55.28±1.35##36.556 TBW 51.57±4.59 43.41±4.14**49.52±3.66 46.45±4.12 46.36±2.82 51.15±3.65##5.46 ECF 41.36±0.79 54.20±4.13**43.91±1.42##47.28±1.04##49.49±2.2##44.72±1.35##36.556
2.3 血清、尿液Na+、K+、Cl-检测
与正常组比较,模型组大鼠的血清Na+、K+、Cl-浓度显著下降,而尿液中Na+、K+、Cl-浓度显著升高,差异均有统计学意义(P<0.01);与模型组比较,各给药组大鼠血清Na+、K+、Cl-浓度上升,尿液中Na+、K+、Cl-浓度下降;与当归芍药散组比较,当归芍药散加味黄芪组大鼠血清和尿液Na+改善更加明显,差异均有统计学意义(P<0.01);与黄芪组比较,当归芍药散加味黄芪组大鼠血清Na+、Cl-浓度明显升高,尿液K+浓度明显降低,差异均有统计学意义(P<0.01)。见表3。
表3 给药4 周后大鼠血清和尿液Na+、K+、Cl-结果(n=8,mmol/L,±s)Tab 3 Concentration of Na+,K+,Cl- in serum and urine of rats after 4 weeks of administration(n=8,mmol/L,±s)
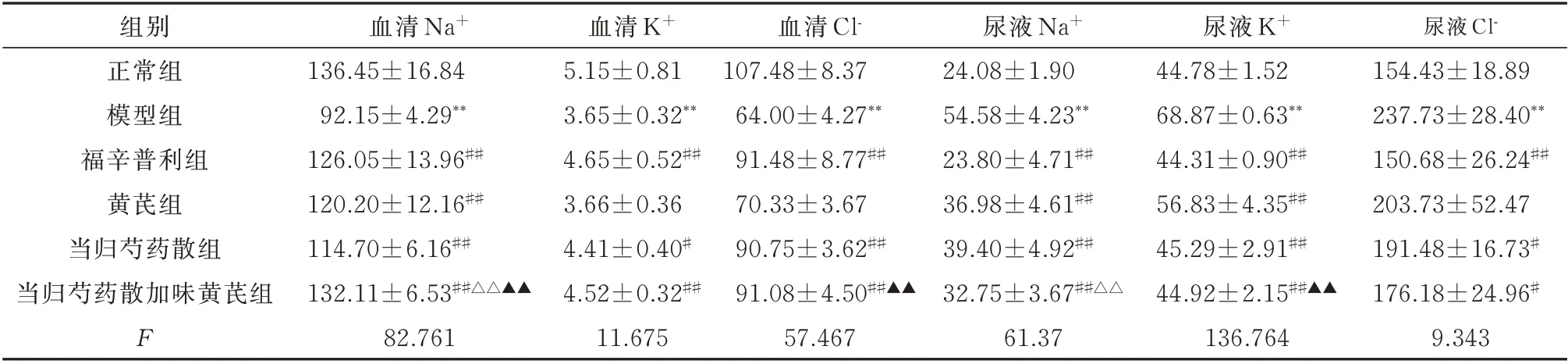
表3 给药4 周后大鼠血清和尿液Na+、K+、Cl-结果(n=8,mmol/L,±s)Tab 3 Concentration of Na+,K+,Cl- in serum and urine of rats after 4 weeks of administration(n=8,mmol/L,±s)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与当归芍药组组比较,△△P<0.01;与黄芪组比较,▲▲P<0.01。
组别正常组模型组福辛普利组黄芪组当归芍药散组当归芍药散加味黄芪组F血清Na+136.45±16.84 92.15±4.29**126.05±13.96##120.20±12.16##114.70±6.16##132.11±6.53##△△▲▲82.761血清K+5.15±0.81 3.65±0.32**4.65±0.52##3.66±0.36 4.41±0.40#4.52±0.32##11.675血清Cl-107.48±8.37 64.00±4.27**91.48±8.77##70.33±3.67 90.75±3.62##91.08±4.50##▲▲57.467尿液Na+24.08±1.90 54.58±4.23**23.80±4.71##36.98±4.61##39.40±4.92##32.75±3.67##△△61.37尿液K+44.78±1.52 68.87±0.63**44.31±0.90##56.83±4.35##45.29±2.91##44.92±2.15##▲▲136.764尿液Cl-154.43±18.89 237.73±28.40**150.68±26.24##203.73±52.47 191.48±16.73#176.18±24.96#9.343
2.4 血液生化指标检测
与正常组比较,模型组血清BUN、Scr、TC、TG含量显著升高,TP 和ALB 含量显著降低,差异均有统计学意义(P<0.01);与模型组比较,各给药组大鼠血清BUN、Scr、TC、TG 含量显著降低,TP、ALB浓度显著升高,差异均有统计学意义(P<0.01);与当归芍药散组和黄芪组比较,当归芍药散加味黄芪不同程度降低了大鼠BUN,Scr、TC、TG 含量,升高了TP、ALB 含量,且BUN 和TP 含量变化差异均有统计学意义(P<0.05)。见表4。
表4 给药4 周后大鼠血清BUN、Scr、TC、TG、TP、ALB 含量(n=8,mmol/L,±s)Tab 4 Serum concents of BUN,Scr,TC,TG,TP and ALB in rats after four weeks of administration(n=8,mmol/L,±s)
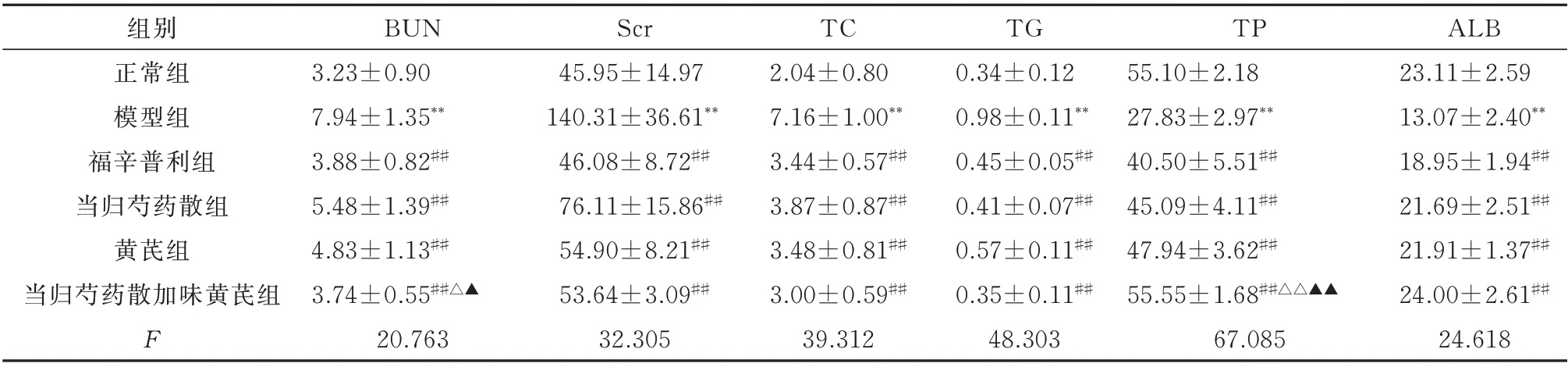
表4 给药4 周后大鼠血清BUN、Scr、TC、TG、TP、ALB 含量(n=8,mmol/L,±s)Tab 4 Serum concents of BUN,Scr,TC,TG,TP and ALB in rats after four weeks of administration(n=8,mmol/L,±s)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01;与当归芍药组组比较,△P<0.05,△△P<0.01;与黄芪组比较, ▲P<0.05,▲▲P<0.01。
ALB 23.11±2.59 13.07±2.40**18.95±1.94##21.69±2.51##21.91±1.37##24.00±2.61##24.618组别正常组模型组福辛普利组当归芍药散组黄芪组当归芍药散加味黄芪组F BUN 3.23±0.90 7.94±1.35**3.88±0.82##5.48±1.39##4.83±1.13##3.74±0.55##△▲20.763 Scr 45.95±14.97 140.31±36.61**46.08±8.72##76.11±15.86##54.90±8.21##53.64±3.09##32.305 TC 2.04±0.80 7.16±1.00**3.44±0.57##3.87±0.87##3.48±0.81##3.00±0.59##39.312 TG 0.34±0.12 0.98±0.11**0.45±0.05##0.41±0.07##0.57±0.11##0.35±0.11##48.303 TP 55.10±2.18 27.83±2.97**40.50±5.51##45.09±4.11##47.94±3.62##55.55±1.68##△△▲▲67.085
2.5 血清IgM、IgG 检测
与正常组比较,模型组大鼠血清IgM、IgG 含量显著降低,差异均有统计学意义(P<0.01);各给药组较模型组显著升高,差异均有统计学意义(P<0.01);与当归芍药散组和黄芪组比较,当归芍药散加味黄芪组大鼠血清IgM、IgG 含量明显上升,差异均有统计学意义(P<0.05,P<0.01)。见表5。
2.6 肾组织病理观察
HE 染色结果显示,空白组无明显病理改变。模型组大鼠肾组织中肾小球基底膜界限不清,有明显增生,球囊出现粘连;肾小管上皮细胞可见颗粒变性或萎缩,部分肾小管部分扩张,肾小管上皮细胞空泡变性,可见蛋白管型。与模型组相比,当归芍药散组肾小球基底膜增生有一定改善,蛋白管型减少。黄芪组肾小球基底膜增生有所改善,但仍有黏连。当归芍药组加味黄芪组基底膜增生情况明显改善,肾小管细胞胞体清晰,空泡变性和蛋白管型显著减少,较当归芍药散组和黄芪组肾小球、肾 小管病变程度减轻。见图1。
表5 给药4 周后大鼠血清IgM 和IgG 水平(n=8,ng/mL,±s)Tab 5 Serum concentration of IgM and IgG of rats after 4weeks of administration(n=8,ng/mL,±s)

表5 给药4 周后大鼠血清IgM 和IgG 水平(n=8,ng/mL,±s)Tab 5 Serum concentration of IgM and IgG of rats after 4weeks of administration(n=8,ng/mL,±s)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01;与当归芍药散组比较,△P<0.05;与黄芪组比较,▲▲P<0.01。
IgG组别IgM 8.08±0.67 2.09±0.57**6.24±0.82##4.72±0.55##4.07±0.55##5.53±0.51##△▲▲85.68正常组模型组福辛普利组当归芍药散组黄芪组当归芍药散加味黄芪组F 2 162.79±264.40 674.63±85.20**1 683.91±43.97##1 318.93±199.81##1 374.08±66.76##1 572.80±80.66##△▲▲88.68

图1 各组大鼠肾组织染色(HE,×200)Fig 1 E staining of renal tissues(HE,×200)
3 讨论
中医将NS 归为“水肿”范畴,由于患者肺失宣发、脾失转运、肾失开合,导致三焦气化不利,水精输布失调,从而诱发本病。正气虚,气血运行无力,凝滞不畅,久而成瘀,正如《读医随笔》所言,“气虚不足以推血,则血必有瘀”。血不利亦可为水,唐容川《血证论》云:“瘀血化水,亦发水肿”,湿和瘀内留,导致气机不行,水湿更难消解,周而复始,气、血、水三者关系失调,以致病程迁延难愈[4]。故中医在治疗NS 上多采用益气兼活血利水的治疗法则,兼顾气、血、水三个环节,阻断其恶性循环。当归芍药散全方由当归、芍药、川芎、白术、茯苓、泽泻组成。当归、芍药、川芎活血祛瘀,白术、茯苓、泽泻利水健脾。黄芪具有补气升提、固表、摄精和利尿的作用,《医学衷中参西录》谓:“为其补气之功最优,故推补药之长,而名之曰耆也”。当归芍药散加用黄芪,意在补益元气,气旺则血行,瘀祛络通,七药合用,活血而水利,驱邪不伤正,扶正不留邪,从而达到标本兼治的目的。
课题组前期研究表明当归芍药散可提高NS 大鼠一氧化氮合酶的表达,增加大鼠体内一氧化氮含量,减少尿蛋白含量,延缓NS 病理进程[5],纠正NS大鼠电解质紊乱[6]。细胞研究表明当归芍药散提取液对阿霉素诱导IMCD3 细胞损伤模型具有一定的保护作用,这与提高Na+、K+-ATP 酶活性,激活环磷酸腺苷-蛋白激酶A-环磷酸腺苷反应元件结合蛋白通路有关[7]。黄芪现代药理研究表明,其有效成分黄芪多糖和黄芪甲苷能够通过调节蛋白激酶C/丝裂原活化蛋白激酶通路的活性进而影响人足细胞裂孔膜上的特异性蛋白nephrin 及podocin 的表达,维持裂孔膜结构完整,保护足细胞,延缓肾病进程[8]。黄芪水提物干预多柔比星肾病大鼠的分子机制与凋亡相关基因和脂质代谢相关基因密切相关,且黄芪对肾脏具有明显抗炎、利尿作用,能够增加肾小球滤过功能,减少水的重吸收,缓解多种肾小球疾病水钠潴留,并能增强机体免疫功能[9]。
本实验在课题组既往研究基础上,通过尾静脉注射阿霉素建立NS 大鼠模型[10]。水肿是NS 最明显的临床症状,但NS 大鼠模型水肿较难判断,BIA法可在无损的情况下实现对大鼠水液代谢情况的测定,故采用BIA 法测定NS 大鼠水液代谢情况[11]。实验结果发现,与正常组比较,模型组大鼠TBW、ICF 显著降低,ECF 显著升高(P<0.01)。进一步对其进行电解质检测发现,模型组大鼠血清Na+、K+、Cl-浓度显著降低,尿液Na+、K+、Cl-浓度显著升高(P<0.01),提示NS 大鼠存在水液代谢紊乱。肾小球滤过屏障损坏,肾小球基底膜通透性的改变是影响NS 疾病进程的重要因素。肾小球滤过屏障损坏导致蛋白从尿液中大量丢失形成蛋白尿,且血浆蛋白和高密度脂蛋白的大量丢失会促进TG 及TC 在肝脏中的合成,最终导致脂质代谢紊乱形成高血脂[12]。肾小球滤过功能严重受损时,还会降低Scr和BUN 滤过,使其血液浓度增加[13]。本实验结果显示,与正常组相比,模型组大鼠尿蛋白和血清BUN、Scr、TC、TG 含量显著升高(P<0.01),血清TP、ALB 含量显著降低(P<0.01)。病理观察发现肾组织中肾小球基底膜界限不清,有明显增生,肾小管上皮细胞可见颗粒变性或萎缩,可见蛋白管型。这些结果均与阿霉素诱导的NS 模型相符,提示造模成功,可以进行后续的药物干预研究。本研究数据表明,与模型组相比,给药组大鼠体内TBW、ECF、ICF 和电解质有不同程度改善,尿蛋白、血清BUN、Scr、TC、TG 含量不同程度降低,血清TP、ALB 含量不同程度升高(P<0.01)。组间比较发现当归芍药散加味黄芪组较当归芍药散组血清Na+浓度明显上升,尿液Na+浓度明显降低(P<0.01);较黄芪组Na+、Cl-浓度明显上升,尿液K+浓度明显降低(P<0.01),与当归芍药散组和黄芪组相比,当归芍药散加味黄芪组大鼠BUN、Scr、TC、TG 含量降低和TP、ALB 含量升高更为明显,且BUN 含量明显降低,TP 含量明显升高(P<0.05)。病理结果也显示给药后系膜细胞核基质增生情况有改善,肾小管病变减轻。这提示当归芍药散、黄芪和当归芍药散加味黄芪均具有一定的肾功能保护作用,且当归芍药散加味黄芪治疗效果更优。
NS 的病理过程极为复杂,机体免疫功能异常是引起NS 发生的主要原因之一,NS 的并发症和复发与自体免疫密切相关,西医临床上治疗NS 多采用免疫抑制剂、糖皮质激素类药物[14,15]。机体体液免疫主要通过免疫B 细胞分泌相应的免疫球蛋白介导,IgM、IgG 的是血清免疫球蛋白的主要成分,反映了免疫应答的程度[16]。NS 患者体内由于各类细胞相互作用导致IgM 向IgG 转化减少,血清IgG 水平降低直接影响了机体抵御并发症、抗感染的能力。本研究发现,当归芍药散加味黄芪组、当归芍药散组和黄芪组可不同程度升高IgM 和IgG,与当归芍药散组和黄芪组相比,当归芍药散加味黄芪组的IgM 和IgG 水平明显升高(P<0.05,P<0.01),说明当归芍药散与黄芪配伍能显著改善NS 大鼠免疫功能。
综上所述,当归芍药散与黄芪配伍具有协同增效作用,可显著改善NS 大鼠水肿、蛋白尿、血脂及免疫功能,且改善效果优于单用当归芍药散和单用黄芪,但是其确切机制尚不清楚。因此,课题组后续将结合中医理论和现代研究手段,对其关键靶点进行基因及蛋白水平检测,系统深入地探讨当归芍药散加味黄芪治疗NS 的相关分子机制,为中医药治疗NS 提供理论依据。

