基于红色碳量子点的荧光法快速检测饮料中的胭脂红
岳晓月,周子君,李 妍,伍永梅,白艳红*
(1.郑州轻工业大学 食品与生物工程学院,河南 郑州 450011;2.河南省冷链食品质量与安全控制重点实验室, 河南 郑州 450011;3.河南省食品生产与安全协同创新中心,河南 郑州 450011)
颜色是食品中重要的感官特性之一,它直接影响消费者的选择和产品的商业价值。食品着色剂是食品添加剂的一种,在食品工业中广泛应用于改善食品色泽,主要作用包括:①补偿因空气、光、温度和储藏条件等因素导致的颜色损失;②提高食品原本的颜色;③为无固有颜色的食品提供颜色,使其更吸引消费者[1]。胭脂红作为人工合成的食品着色剂之一,广泛应用于果汁[2]、冰淇淋[3]、膨化食品中[4]。胭脂红是一种偶氮化合物,可在体内代谢生成致癌能力很强的α-氨基-1-萘酚等物质,在规定范围内使用是安全的,但若长期食用超过标准含量的胭脂红,会使人体正常代谢功能紊乱[5],严重威胁人体健康。因此,我国国家标准GB 2760-2014[6]明确规定果蔬汁(浆)类饮料、碳酸饮料、含乳饮料、风味饮料等中胭脂红的最大使用量为0.05 g/kg。因此,建立胭脂红的快速检测方法对保障食品安全具有重要意义。
目前,胭脂红的检测方法包括传统仪器确证法和快速检测法,其中仪器确证法主要有高效液相色谱法(HPLC)[7]、高效毛细管电泳法[8]等,但这些方法耗时长且需复杂的样品预处理[9]。近年来,快速检测方法因灵敏度高、选择性强、耗时短等优势在食品安全检测领域备受关注,主要有薄层层析法[10]、示波极谱法[11]、伏安法[12]、微柱法[13]、分光光度法[14]、荧光分析法[15]等。其中,荧光分析法因具有灵敏度高、操作简单以及可视化等优点引起了科研工作者的广泛关注。碳量子点作为一种新型荧光材料,具有易制备、低毒性、良好光学稳定性等优点,广泛应用于食品中添加剂[16]、抗生素[17]、重金属离子[18]、食源性疾病[19]等的检测。基于此,本文构建了一种基于红色碳量子点(RCDs)的新型荧光传感器,旨在为食品中胭脂红提供一种新型、高灵敏的快速检测方法。
1 实验部分
1.1 仪器与试剂
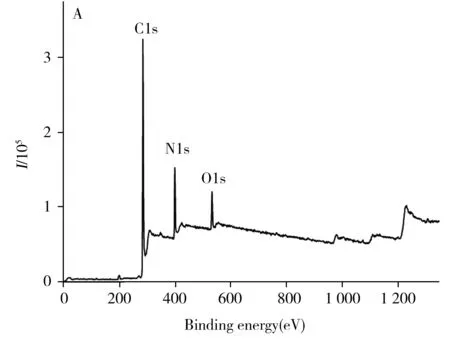
F-7000荧光分光光度计、JEM 2100透射电子显微镜(日本日立公司);Alpha-1860紫外分光光度计(上海谱元仪器有限公司);DHG-9146 A电热恒温鼓风干燥箱(上海精宏实验设备有限公司);Nicolet 5700傅里叶红外光谱仪(FTIR,德国Bruker公司);ESCALAB 250Xi X射线光电子能谱仪(美国Thermo Fischer公司);1290 Infinity Ⅱ高效液相色谱仪(美国安捷伦公司)。
胭脂红(分析纯)、对苯二胺(化学纯,国药集团化学试剂有限公司);乙酸乙酯(分析纯,上海阿拉丁生化科技股份有限公司);无水乙醇(分析纯,天津市富宇精细化工有限公司);果汁饮料:美汁源爽丽花语(红葡萄+玫瑰)(郑州市某超市)。
1.2 RCDs的制备
采用溶剂热法合成RCDs:准确称取0.3 g对苯二胺溶于30 mL无水乙醇中,搅拌均匀,倒入反应釜,以180 ℃水热反应24 h,冷却至室温,得到淡灰色悬浮液。将硅胶粉和乙酸乙酯(体积比为1∶3)混合,灌入硅胶柱中。待柱子压实后,将反应釜中淡灰色悬浮液缓慢滴入处理好的硅胶柱中。用乙酸乙酯进行洗脱,当流出的液体在紫外灯照射下发出红色荧光时开始收集。待流出的液体在紫外灯照射下无明显的红色荧光时,停止收集。将收集到的液体旋蒸后,用少量乙醇溶解,于36 ℃烘箱内干燥过夜,得RCDs粉末。
1.3 标准溶液配制
精确称取一定量“1.2”制备的RCDs粉末,用0.01 mol/L PBS缓冲液(pH 8.0)配成100 μg·mL-1的RCDs工作溶液。精确称取一定量胭脂红,加入PBS缓冲液(pH 8.0)配成0.5、1、2、4、6、8、10、15、20、25、30、40、50、60、80 μg·mL-1的系列胭脂红标准工作溶液。
1.4 样品前处理
精确移取10 mL果汁样品于20 mL容量瓶中,加入5%甲醇溶液稀释并定容至刻度,转移至离心管中,以10 000 r/min高速离心5 min,取上清液过0.22 μm微孔滤膜,用0.1 mol/L NaOH溶液调至pH 8.0,供荧光分光光度计和液相色谱测定。
1.5 实验方法
1.5.1 荧光测定条件在3.5 mL荧光比色皿中,加入1 mL RCDs溶液、2 mL经过前处理后的样品溶液,在室温下静置1 min。荧光激发和发射狭缝均为10 nm。先测定RCDs的荧光强度IF0,再测定加入胭脂红的RCDs的荧光强度IF。
1.5.2 高效液相色谱条件安捷伦C18色谱柱(4.6 mm×250 mm,5 μm);柱温35 ℃。紫外检测器检测波长254 nm。进样量10 μL。流动相:20 mmol/L 乙酸铵溶液(A)和甲醇(B),流速 1.0 mL/min,梯度洗脱程序:0~3.0 min,5%~35%B;3.0~7.0 min,35%~100%B;7.0~10 min,100%B;10~10.1 min,100%~5%B;10.1~21 min,5%B。
2 结果与讨论
2.1 RCDs表征


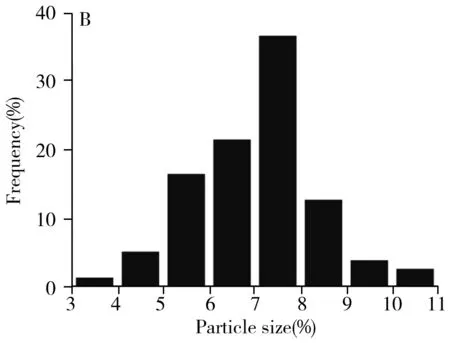
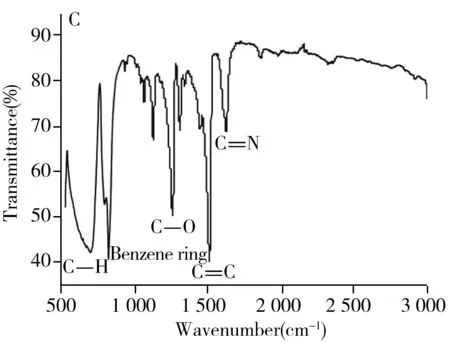
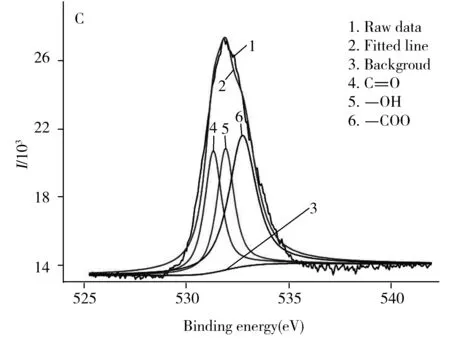
图1 RCDs的透射电镜图(A)、RCDs的粒径分析图(B)以及傅里叶红外光谱图(C)Fig.1 TEM images of RCDs(A),the corresponding particle size(B) and FT-IR spectra(C) of RCDs
2.2 荧光检测机理分析
目前,已报道的荧光猝灭机理主要包括荧光共振能量转移、内滤效应以及光电子转移效应(PET)。本研究通过测定及分析荧光寿命曲线、紫外-可见吸收光谱和荧光光谱,进一步阐明荧光猝灭机理。如图3A所示,RCDs的激发峰最高位于493 nm,而胭脂红在510 nm处有最高的紫外吸收峰,且与RCDs的激发光谱明显重叠,因此两者之间可产生内滤效应。如图3B所示,RCDs的荧光寿命为5.75 ns,加入胭脂红后,RCDs的荧光寿命为5.99 ns,可见加入胭脂红前后RCDs的荧光寿命基本一致,排除了荧光共振能量转移和光诱导电子转移等动态猝灭机理。表明胭脂红猝灭RCDs的原理为静态猝灭。
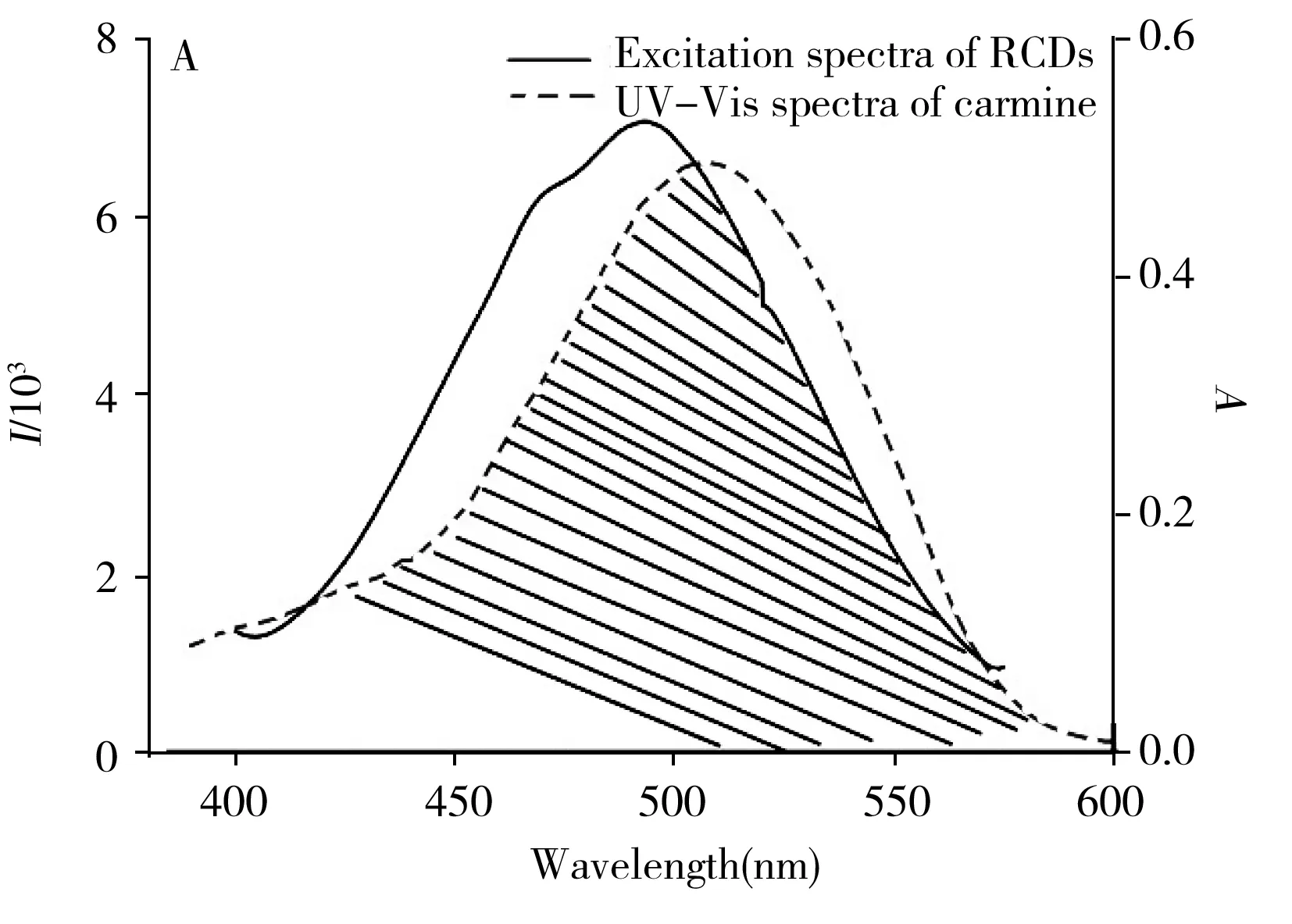
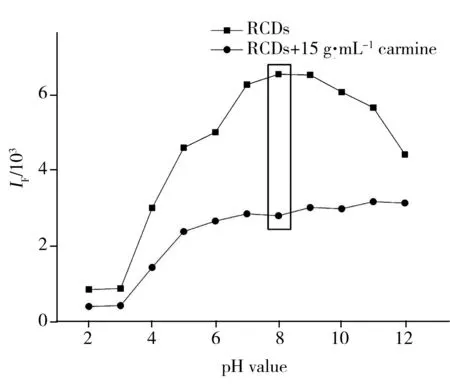
图4 pH值对RCDs荧光强度的影响Fig.4 Effect of pH value on the fluorescence response of CDs
2.3 实验条件的优化
考察了不同激发波长下RCDs的荧光强度变化图。结果显示,在473~523 nm激发波长照射下,RCDs的荧光强度随激发波长的增大呈先增大后减小的趋势,在493 nm时达到最大,且RCDs的荧光发射波长并未随激发波长的改变而改变,表明RCDs具有激发独立性[20-21]。因此,选择RCDs的最优激发波长为493 nm。同时,实验考察了PBS缓冲液的pH值(2.0~12.0)对胭脂红荧光检测的影响(图4)。结果显示,RCDs的荧光猝灭值(ΔIF=IF0-IF)随pH值的增大呈先增大后减小的趋势,且在pH 8.0时RCDs的荧光强度最大,因此,确定PBS缓冲溶液的最佳pH值为8.0。
2.4 标准曲线的绘制
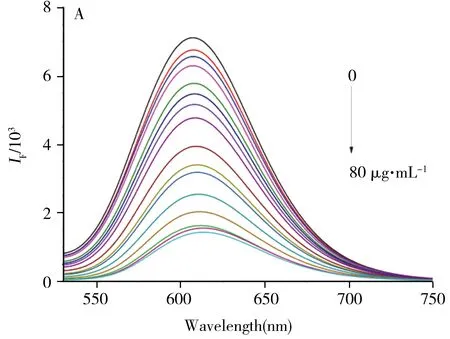
在优化条件下,测定RCDs样品的荧光强度,再向溶液中依次加入不同浓度胭脂红并测定其对应的荧光光谱(图5A)。结果显示,未加入胭脂红时,RCDs在605 nm处具有最大荧光峰,随着胭脂红的加入且浓度的增大,RCDs的荧光强度逐渐降低。在0.5~50 μg·mL-1范围内,胭脂红的质量浓度与RCDs荧光强度比值(IF0/IF)呈线性相关,其线性方程为IF0/IF=0.059c+0.979,相关系数(r2)为0.978,检出限为0.397 μg·mL-1。此外,RCDs溶液在365 nm紫外灯下的红色荧光强度随着胭脂红的浓度增大而降低,红色荧光逐渐变暗(图5C),故该探针亦可在365 nm紫外灯下可视化检测胭脂红。
2.5 抗干扰实验
实验通过在RCDs溶液中添加一些干扰物质,测定其荧光强度,考察方法对胭脂红检测的选择性(图5D)。结果显示,浓度均为20 μg·mL-1的草酸钠、甘氨酸、酒石酸钠、亚硝酸钠、硼酸、脯氨酸、葡萄糖、蔗糖、Zn2+、Fe3+、K+、Mg2+、Na+对RCDs检测胭脂红(20 μg·mL-1)的结果几乎无影响。表明RCDs具有很好的抗干扰能力。
2.6 实际样品的测定
在优化条件下,取1 mL RCDs溶液和2 mL处理后的果汁样品(美汁源爽丽花语(红葡萄+玫瑰))溶液放入3.5 mL比色皿中,采用本文建立的方法测得胭脂红含量为1.34 μg·mL-1(n=3),采用高相液相色谱法检测定值为1.33 μg·mL-1(n=3),由于前处理时稀释了2倍,因此胭脂红实际浓度为2.68 μg·mL-1,符合GB 2760-2014食品安全国家标准中食品添加剂的使用量(50 μg·mL-1)[6],方法满足检测需求。
取上述实际样品,向其中添加一定量胭脂红样品配成10、20、30 μg·mL-1的标准溶液,分别采用本文建立的荧光法和高效液相色谱法检测。结果显示,采用本方法测定值分别为10.65、21.68、30.01 μg·mL-1,回收率为93.1%~101%,相对标准偏差(RSD)0.97%~2.1%为;采用高相液相色谱法检测结果分别为11.57、21.96、18.32.38 μg·mL-1,回收率为98.2%~104%,相对标准偏差(RSD)为1.8%~3.0%;由此可见,本方法与液相色谱法测定结果一致,且具有良好的重现性和准确性,可用于饮料中的胭脂红的测定。
3 结 论
本研究以对苯二胺为碳源,通过溶剂热法制备了RCDs,再以RCDs为荧光探针,根据胭脂红和RCDs之间的内滤效应,设计了一种检测胭脂红含量的荧光检测法。在最优条件下,RCDs荧光强度变化的比值与胭脂红在0.5~50 μg·mL-1质量浓度范围内线性良好,相关系数为0.978,最低检出限为0.397 μg·mg-1,并成功用于实际果汁样品中胭脂红的检测。该方法成本低、操作简单且具有良好的特异性、灵敏度及准确性,为饮料中胭脂红的检测提供了一种新方法,并拓展了RCDs在食品分析领域中的应用。

