基于共振能量转移的生物传感器在食品安全检测中的应用研究进展
包昆鹭,许 琪,曹宏梅,刘 星,陈 奇*
(1.海南大学 食品科学与工程学院,海南 海口 570228;2.海南省食品营养与功能食品重点实验室, 海南 海口 570228)
共振能量转移(Resonance energy transfer,RET)是一种发生在供体-受体之间的非辐射能量转移过程,该过程的发生需要满足以下特定条件:第一,供体-受体间的距离必须足够小,研究表明,10 nm以内才能有效地发生能量转移,且距离是影响RET效率的最主要因素(效率和供体-受体间距离的六次方成反比);第二,供体的发射光谱和受体的吸收光谱必须有效重叠,其重叠程度对能量转移效率有较大影响;第三,供体-受体偶极间要有一定取向,其相对位置也会影响能量转移效率[1]。共振能量转移类型按发光方式可以分为以下3种:荧光共振能量转移(Fluorescence resonance energy transfer,FRET)、生物发光共振能量转移(Bioluminescence resonance energy transfer,BRET)和化学发光共振能量转移(Chemiluminescence resonance energy transfer,CRET)。上述3种类型的共振能量转移技术,近年来得到了广泛关注,并被应用于医学诊断[2]、生命科学研究[3]、环境监控[4]以及食品安全[5]等领域。
近年来,随着食品行业的逐步发展,食品安全问题备受关注。食品中常见的危害因子主要包括非法添加剂、激素、致病菌、农兽药残留、生物毒素、重金属及有毒化合物等。现有检测技术如色谱技术、光谱技术、免疫分析等已得到广泛应用。其中,基于仪器的色谱技术和光谱技术因准确度高通常作为确证方法,免疫分析等技术操作简单、成本低廉,通常作为筛查方法。为改善传统分析方法存在的灵敏度低和耗时久等不足,越来越多的新技术被引入食品安全分析领域。其中基于RET的新型生物传感分析技术,因具有灵敏度高、操作简便及速度快等优点而备受关注。本文依据能量供体的不同,对3种类型的RET在食品安全领域的研究进行综述,同时展望了其应用前景和发展趋势。
1 FRET在食品安全检测中的应用
FRET又称福斯特共振能量转移,由Förster在1948年提出,指受激发的供体与受体之间通过偶极-偶极相互作用以非辐射形式进行能量传递的过程[6]。FRET是一种均相光学检测技术,具有操作简便、灵敏度高、反应速度快等优点,近年来在生物毒素、非法添加剂、激素、致病菌、农兽药残留、生物毒素、重金属及有毒化合物等食品危害因子快速检测中得到了广泛应用。

图1 基于FRET检测鸡蛋中氟虫腈残留的工作原理图[7]Fig.1 The principle diagram of detecting fipronil residue in eggs based on FRET[7]
1.1 有机荧光染料在FRET中的应用
在早期FRET中,常使用有机荧光染料作为供体-受体对,有机荧光染料具有成本低、无毒性等优点,典型的有Cy系列菁染料如Cy3和Cy5,以及羧基荧光素(FAM)等。Kim等[7]利用FRET技术检测农药氟虫腈残留,其工作原理如图1所示。在氟虫腈适配子的3’端标记上FAM,并在与适配子互补的cDNA的5’端标记猝灭基团羧基四甲基罗丹明(TAMRA)。样品中无氟虫腈时,适配子与cDNA互补形成双链,使得FAM与TAMRA距离足够近,导致发生FRET,从而使FAM的荧光被TAMRA猝灭。而当样品中存在氟虫腈时,适配子识别并结合氟虫腈,双链DNA解离,TAMRA远离FAM,被猝灭的FAM荧光恢复,且荧光强度随氟虫腈浓度的增加而增强,从而可实现对氟虫腈的定量检测。该方法操作简单,无需洗涤,可在30 min内完成检测,对鸡蛋样品的线性范围为25~300 ng/mL,最低检测限为53.8 ng/mL。FAM是一种被广泛使用的荧光染料,其猝灭基团也有很多选择,如叔丁基对苯二酚1(BHQ1)[8]、金属-有机骨架材料(Metal-organic frameworks,MOFs)[9]等。
早期的FRET中供体及受体多使用有机荧光染料,然而,传统有机荧光染料存在光化学稳定性差、光漂白及光降解现象严重、荧光寿命短、吸收光谱窄且易发生光谱重叠等缺陷[10],因此正逐步被新型的荧光材料替代。
1.2 量子点在FRET中的应用
半导体量子点(Quantum dot,QD)是一种由Ⅱ~Ⅵ族或Ⅲ~Ⅴ族元素组成的纳米颗粒,与传统有机荧光染料相比,QD的激发光谱宽,可被紫外到远红外区的任意波长光激发,作为FRET供体时具有很大的可选择性,可避免受体被直接激发。而当QD作为FRET受体时,窄且对称的发射光谱可减少与供体发射光谱的重叠,避免相互间的干扰。此外,QD还具有发光强度高、荧光量子产率较高、不易光漂白等独特的光学特性[11],比传统荧光染料更适合用于构建FRET体系。
图2 用于检测BoNT的QD-FRET生物 传感器工作原理图[12]Fig.2 The principle diagram of QD-FRET biosensor for detecting BoNT[12]
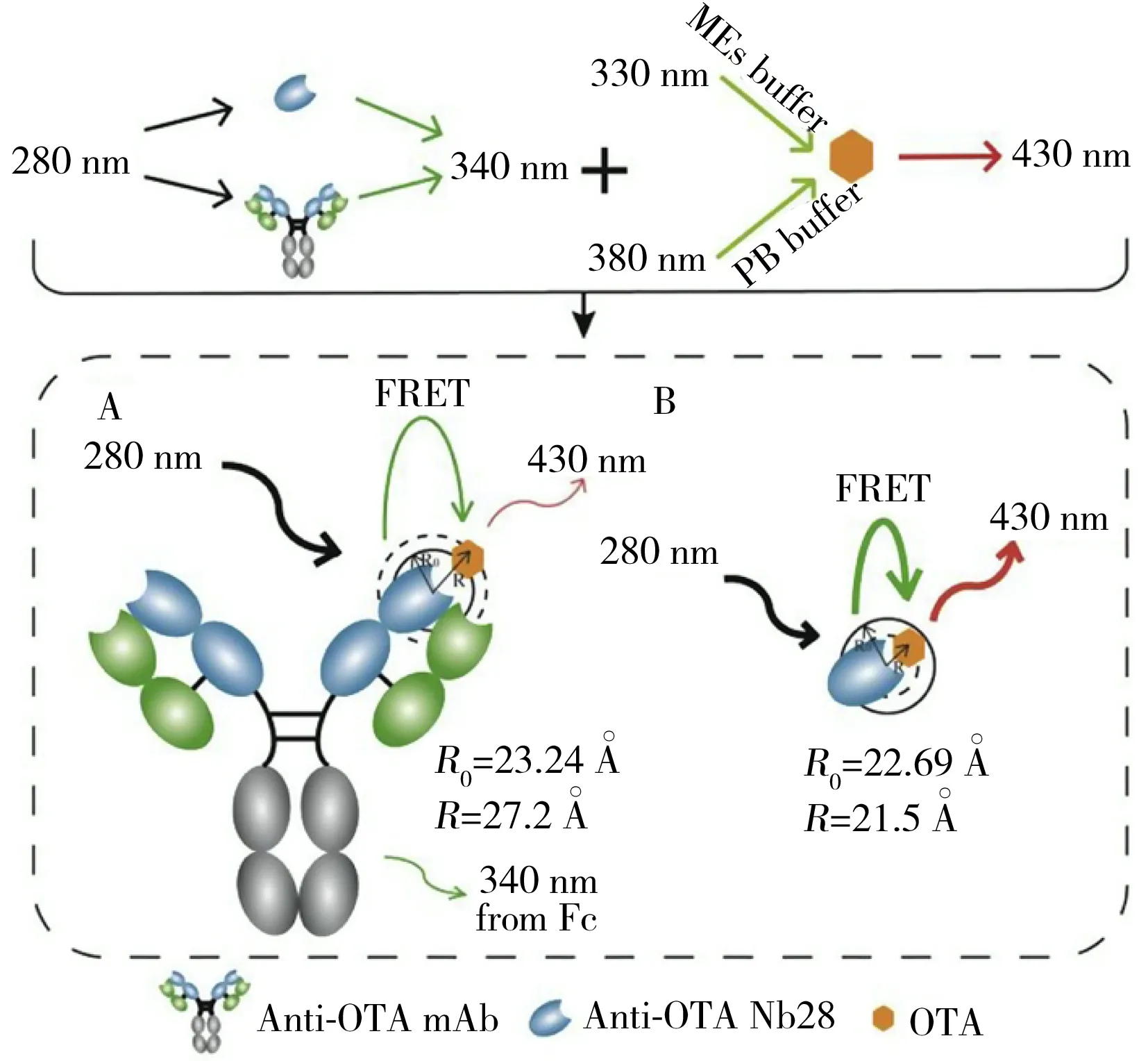
图3 用于检测OTA和OTB的基于纳米抗体的 QD-FRET免疫检测工作原理图[14]Fig.3 The diagram of nanobody-based QD-FRET immunoassay for detecting OTA and OTB[14]
Wang等[12]开发了一种基于QD的FRET生物传感器用于检测肉毒杆菌神经毒素(BoNT),其工作原理如图2所示。首先将含有酶切位点的多肽与荧光猝灭剂结合,并通过多聚组氨酸结合到QD表面实现FRET,QD发光减弱;BoNT存在时,多肽被毒素切割,猝灭剂与QD分离,FRET状态关闭,QD荧光增强。该生物传感器可在3 h内实现对两种不同类型BoNT(LcA和LcB)的检测,检测限分别为0.2 ng/mL及2 ng/mL。与Sapsford等[13]的研究相比,该研究通过使用荧光猝灭剂将灵敏度提高约两个数量级。
本实验室开发了基于纳米抗体同时检测赭曲霉毒素A(Ochratoxin A,OTA)和赭曲霉毒素B(Ochratoxin B,OTB)的FRET免疫分析方法[14],其工作原理如图3所示。该研究利用抗体中色氨酸残基有固有荧光这一特点,将其作为供体,并以与抗原偶联的量子点作为受体,在抗体识别抗原的过程中即可完成FRET。与完整抗体相比,纳米抗体尺寸较小[15],有助于缩短抗体中色氨酸残基与抗原之间的距离,提高FRET效率,该方法对OTA和OTB的检测限分别达0.06 ng/mL和0.12 ng/mL。
在FRET体系中,由于QD激发光谱宽,为避免对受体的直接激发,QD通常被用作供体,但同时利用两种QDs作为供体-受体对的研究报道并不多见。Xu等[16]利用两种不同尺寸的QDs成功构建FRET体系,并探讨了供体-受体偶联物标记比率对能量转移效率的影响,最终用于大米中黄曲霉毒素B1(AFB1)的免疫检测,其定量范围为0.06~5.0 ng/mL,最低检测限为0.04 ng/mL。检测结果与商业化试剂盒具有良好的相关性,显示出广阔的应用前景。
QDs优越的性能使其作为荧光标记物得到了快速发展,但依然存在一些需要解决的问题,如具有生物毒性、价格昂贵、与传统有机荧光染料一样需要高能量的外源激发光、组织穿透能力较低、易受生物组织自发荧光的干扰等。上述缺陷在一定程度上限制了基于QDs的FRET技术的应用范围。
1.3 贵金属纳米材料在FRET中的应用
随着纳米科学的不断发展,多种新型、性能更加优越的贵金属纳米材料被深入地运用到检测领域中。贵金属纳米颗粒的尺寸一般在100 nm以内,颗粒表面的等离子使金属表面产生电荷聚集,导致表面电荷密度增大,局域场增强,从而引发增强效应。同时,贵金属纳米颗粒还有特殊的光学性质如光致发光效应和表面等离子共振等,已成为当前的研究热点[17-18]。银纳米颗粒(AgNPs)具有强消光性,其摩尔消光系数大于1010cm-1·M-1,是纳米金颗粒(AuNPs)的100倍,同时还具有吸收光谱宽、稳定性和生物相容性好等优良性能,是一种理想的荧光猝灭剂,可在FRET体系中作为受体有效地猝灭被激发供体所发射的荧光[19]。Carneiro等[20]以碳量子点(CQDs)为供体,AgNPs为受体构建了用于检测食品中农药残留的FRET生物传感器,通过检测大米、胡萝卜、桔子和胡椒中不同的农药残留(丙二醇、对硫磷、乐果、毒死蜱和嘧咪卡卜)证实了该生物传感器的实用性。荧光金属纳米簇由几个到几百个原子组成,尺寸通常在2 nm之内,特性则介于单个原子与较大的纳米粒子之间[21-22]。Khan等[23]将适配体与银纳米簇结合作为能量供体,其荧光会被Mo2C受体猝灭,而在加入靶标竞争时荧光恢复。这种动态定量检测方法对T-2毒素的检测范围为0.005~500 ng/mL,检测限为0.93 pg/mL,在方法学评价中展现出良好的实用性。
1.4 上转换发光材料在FRET中的应用
除贵金属纳米材料外,上转换发光材料(UCNPs)也是当前研究的热点,其具有较低的声子能量和较高的化学稳定性,是目前公认的发光效率最高的纳米材料之一[24]。上转换发光是反-斯托克斯发光,材料受到低能量的光激发后,发射出高能量的光。Wu等[25]使用红色和绿色的UCNPs为供体,AuNPs为受体构建了一种新型的双FRET检测系统,实现了海产品等样品中Hg2+和Pb2+的同步检测。该生物传感器对Hg2+和Pb2+的检测范围分别为0.5~500 nmol/L和0.1~100 nmol/L,检测限分别为150 pmol/L和50 pmol/L。上转换发光材料因形貌可控、尺寸可调、粒径均一、有良好的化学稳定性和光稳定性而得到应用,但增大发光强度及转换效率仍将会是以后的研究重点。
2 BRET在食品安全检测中的应用
BRET是基于海洋生物体内发现的一种自然现象,即以荧光生物体内的荧光素酶作为供体,为实现供体-受体的能量非辐射转移过程而开发的一种新型RET技术[26]。与FRET相比,BRET能量供体为可催化底物发射荧光的荧光素酶,因此无需外界光源激发,可避免外源光激发所引起的诸多副作用,如受体被外源光直接激发产生“假阳性”信号以及复杂样品基质的背景荧光及散射光干扰导致信噪比降低和灵敏度下降等问题[27]。因此,在一些需要低背景和高灵敏度的研究中,BRET显示出巨大的优势,并日益受到研究者的关注。
目前BRET在分子成像[28]、医学标志物检测[29]等方面已有较广泛的应用,但在食品安全检测中的应用还较为少见。Yu等[30]以海肾荧光素酶(Renilla luciferase,Rluc)为供体,量子点为受体,建立的QD-BRET体系实现了牛奶样品中诺氟沙星(NOR)的定量检测,方法的IC50为1 ng/mL,线性范围为0.023~25.60 ng/mL,覆盖4个数量级,显示出优越的性能。
3 CRET在食品安全检测中的应用
CRET是化学发光反应产生的能量以非辐射的方式转移给受体,不需要外源激发光[31]。目前常见的有鲁米诺化学发光体系、吖啶酯化合物化学发光体系及二氧杂环丁烷类化学发光体系等,其中鲁米诺化学发光体系应用最为广泛。Jo等[32]利用鲁米诺发光体系构建了用于检测赭曲霉毒素A(OTA)的CRET生物传感器,检测范围为0.1~100 ng/mL,最低检测限为0.22 ng/mL,显示出良好的应用潜力。Ma等[33]建立了基于免疫竞争法的QDs-CRET生物传感器用于检测兽药磺胺二甲嘧啶(SMZ),检测限为9 pg/mL,灵敏度比酶联免疫吸附法(ELISA)和荧光偏振免疫分析法(FPIA)高出2~4个数量级,显示出优越的分析性能。
电化学发光(Electrochemiluminescence,ECL)具有高灵敏、反应体系可控等优点[34-35],电化学发光生物传感器则融合了ECL和生物传感器的优点,成为食品分析领域中强有力的分析手段[36-37]。Feng等[38]设计了一种基于双齿轮转换、电化学发光共振能量转移(Electrochemiluminescence resonance energy transfer,ERET)和表面等离子体共振(Surface plasmon resonance,SPR)的多重选择性测定卡那霉素和新霉素的双齿轮电化学发光法。通过双齿轮上供体-受体间的ERET过程,改变ECL强度,达到卡那霉素和新霉素检测的目的。该传感器对于卡那霉素(10-10~10-6mol/L)和新霉素(10-9~10-5mol/L)的检测范围较宽,检测限分别达1.7×10-11mol/L和3.5×10-10mol/L。
随着纳米材料研究的进步,一些新型的纳米材料也被用于构建CRET体系。Sun等[39]构建了基于MOFs的CRET生物传感器用于饮用水中氟离子的检测,检测范围为0.5~80.0 μmol/L,最低检测限为0.05 μmol/L。虽然目前CRET在食品安全检测中的应用并不多见,但其灵敏多样的检测体系正在吸引大批学者的目光。
近年来RET在食品危害因子快速检测中的相关应用见表1。

表1 3种RET在食品安全检测中的应用Table 1 The application of three kinds of RETs in food safety detection
4 结论及展望
基于RET的生物传感器作为一种均相光学检测技术,具有操作简便、灵敏度高、快速等优点,其中FRET更是得到了广泛应用。为了减少FRET外源激发光带来的干扰,也有学者合成了具有双光子激发特性的荧光探针,并以其为能量供体构建双光子激发-FRET[55]。与FRET相比,BRET及CRET无需外界光源激发,可避免外源光激发所引起的诸多副作用,极大地减少背景干扰以及“假阳性”问题,在检测领域显示出巨大的优势,并日益受到研究者的关注。此外一些新型生物识别元件,包括核酸适配体及纳米抗体等,由于具有尺寸小,能显著提高RET能量转移效率的特点,在构建RET体系时显示出巨大的优势。均相检测方法具有快速、操作简便且易于自动化等优点,已经成为检测分析领域研究的热点,其中基于RET的生物传感器更是备受关注。但将其用于现场快检时,检测仪器的小型化、集成化及多功能化以及检测结果的可视化、分析简化也将是今后工作的研究重点。

