基于单克隆抗体的滴滴涕、硫丹和水胺硫磷酶联免疫检测方法研究
丁 园,秦 爽,刘伟美,王鸣华,华修德
(南京农业大学 植物保护学院,江苏 南京 210095)
滴滴涕(Dichlorodiphenyltrichloroethane,DDT)和硫丹均为有机氯类杀虫剂,由于具有较高的杀虫活性,同时化学性质稳定、生产成本低廉,曾在第二次世界大战后被广泛、大量的使用。DDT具有持久性有机污染物的 4 个属性(持久性、生物富集性、跳跃性和毒性),对野生动物,尤其是鸟类和鱼类危害极大[1]。虽然已被限制使用40多年,但DDT在地球上仍无处不在[2-4],依然可以通过食物链在人体中富集[5-6]。《中国食品安全国家标准》规定DDT在不同食品中的再残留限量范围为0.02~2 mg· kg-1[7]。硫丹由于其剧毒性、生物蓄积性和内分泌干扰素作用,在2011年被列入《斯德哥尔摩公约》持久性有机污染物清单,目前已被50多个国家禁用,但与DDT一样,在全球各地均能检测到硫丹残留[8-9],对人类健康具有不容忽视的潜在威胁。目前,硫丹在不同食品中的最大残留限量(Maximum residue limit,MRL)范围为0.01~10 mg· kg-1[7]。水胺硫磷是高毒性有机磷类农药,目前中国已禁止其在蔬菜和水果上的施用,但在棉花和水稻中仍被广泛使用[10],其在不同食品中的MRL值在0.01~0.05 mg· kg-1之间[7]。因此,检测残留在环境和农产品中的DDT、硫丹和水胺硫磷对保障生态环境和农产品质量安全具有重要意义。
目前,仪器法是DDT、硫丹和水胺硫磷残留检测的常用方法,如气相色谱法(Gas chromatography,GC)[11-12]、气相色谱-串联质谱法[13-17]、高效液相色谱法(High performance liquid chromatography,HPLC)[18]、高效液相色谱-串联质谱法[19]等。此外,基于特异性抗体的免疫分析方法已成功用于农药残留的快速检测[20-22]。相比于仪器检测,免疫分析具有快速、简便、成本低及可实现现场检测等特点,十分符合我国国情。其中,间接竞争酶联免疫吸附分析(Indirect competitive enzyme-linked immunosorbent assay,ic-ELISA)是最常用的免疫分析方法,其基本策略是将竞争抗原固定在微孔板中,加入抗原特异性抗体和待测样品,使竞争抗原与分析物共同竞争抗体的结合位点,洗去多余试剂后,加入酶标二抗测定与竞争抗原结合的抗体,从而计算出待测样品中分析物的浓度。
抗体是免疫分析的核心试剂,其质量决定免疫分析方法的特性。单克隆抗体具有均一性好、特异性强、可大量制备等优点,是农药等污染物免疫分析最常用的抗体。根据文献报道,已有研究研制出DDT、硫丹和水胺硫磷的单克隆抗体,并建立了ic-ELISA方法。在抗DDT抗体制备及其ic-ELISA建立方面:Abad等[23]设计并合成了5种DDT的半抗原,制备出抗DDT的单克隆抗体,建立的ic-ELISA的灵敏度(半数抑制浓度:50% inhibitory concentration,IC50)最高可达到0.74 ng·mL-1;Hong等[24]制备出抗DDT的多克隆抗体,ic-ELISA的检出限(Low of detection,LOD)为3.4 ng·mL-1;杨星星等[25]制备出了抗DDT的单克隆抗体,ic-ELISA的IC50为61.1 ng·mL-1。在抗硫丹抗体制备及其ic-ELISA建立方面:Wang等[26]制备出了抗硫丹的多克隆抗体,ic-ELISA的IC50为5.3 ng·mL-1;Manclús等[27]设计并合成了4种硫丹半抗原,制备出抗硫丹的单克隆抗体,ic-ELISA的IC50为2.85 ng·mL-1。在抗水胺硫磷抗体制备及其ic-ELISA建立方面:Wang等[28]制备了广谱的抗有机磷农药的单克隆抗体,ic-ELISA检测水胺硫磷的IC50为58.85 ng·mL-1;秦娜[29]建立了O-(2-异丙氧基羰基苯基)硫代磷酰胺类农药多残留检测方法,ic-ELISA检测水胺硫磷的IC50为23.39 ng·mL-1。由于DDT、硫丹和水胺硫磷在一些农产品中的MRL值较低,我国自主研制的相关农药单克隆抗体的质量还有待进一步提高,避免在实际应用中对样品进行浓缩处理。
本研究分别制备了抗DDT、硫丹和水胺硫磷的单克隆抗体,并使用商业化的辣根过氧化物酶(Horse radish peroxidase,HRP)标记的羊抗鼠抗体作为检测二抗,分别建立了上述3种农药的ic-ELISA检测方法,并对其灵敏度、特异性和准确性进行了评价。
1 实验部分
1.1 实验材料
DDT标准品(94.6%)购自广州佳途科技有限公司,硫丹(96.0%)和水胺硫磷(99.7%)标准品购自德国Dr.Ehrensorfer公司,其他用于交叉反应实验的农药均由江苏省农药研究所提供。用于细胞融合与培养的相关试剂均购自美国Invitrogen公司。HRP标记的羊抗鼠抗体购自美国Boster公司。牛血清蛋白(Bovine serum albumin,BSA)和卵清蛋白(Ovalbumin,OVA)购自北京索莱宝科技有限公司。二甲基甲酰胺(Dimethyl formamide,DMF)、四甲基联苯胺(Tetramethyl benzidine,TMB)、二环己基碳二亚胺(Dicyclohexylcarbodiimide,DCC)、N-羟基琥珀酰亚胺(N-Hydroxysuccinimide,NHS)、弗氏不完全佐剂(Freund's incomplete adjuvant,FIA)和弗氏完全佐剂(Freund's complete adjuvant,FCA)均购自美国Sigma公司。用于抗体纯化的Protein A柱购自美国GE Healthcare公司。透明酶标板购自美国Corning公司。BALB/c小鼠购自扬州大学,本研究中使用的动物及动物实验均经江苏省科学技术厅批准,许可证号为SYXK(SU) 2017-0007。
1.2 单克隆抗体制备
按照已报道的合成方案,分别制备DDT[23]、硫丹[27]和水胺硫磷[29]的半抗原,其结构式如图1所示。采用活泼酯法[30]将半抗原分别与BSA和OVA偶联制备免疫抗原和包被抗原。
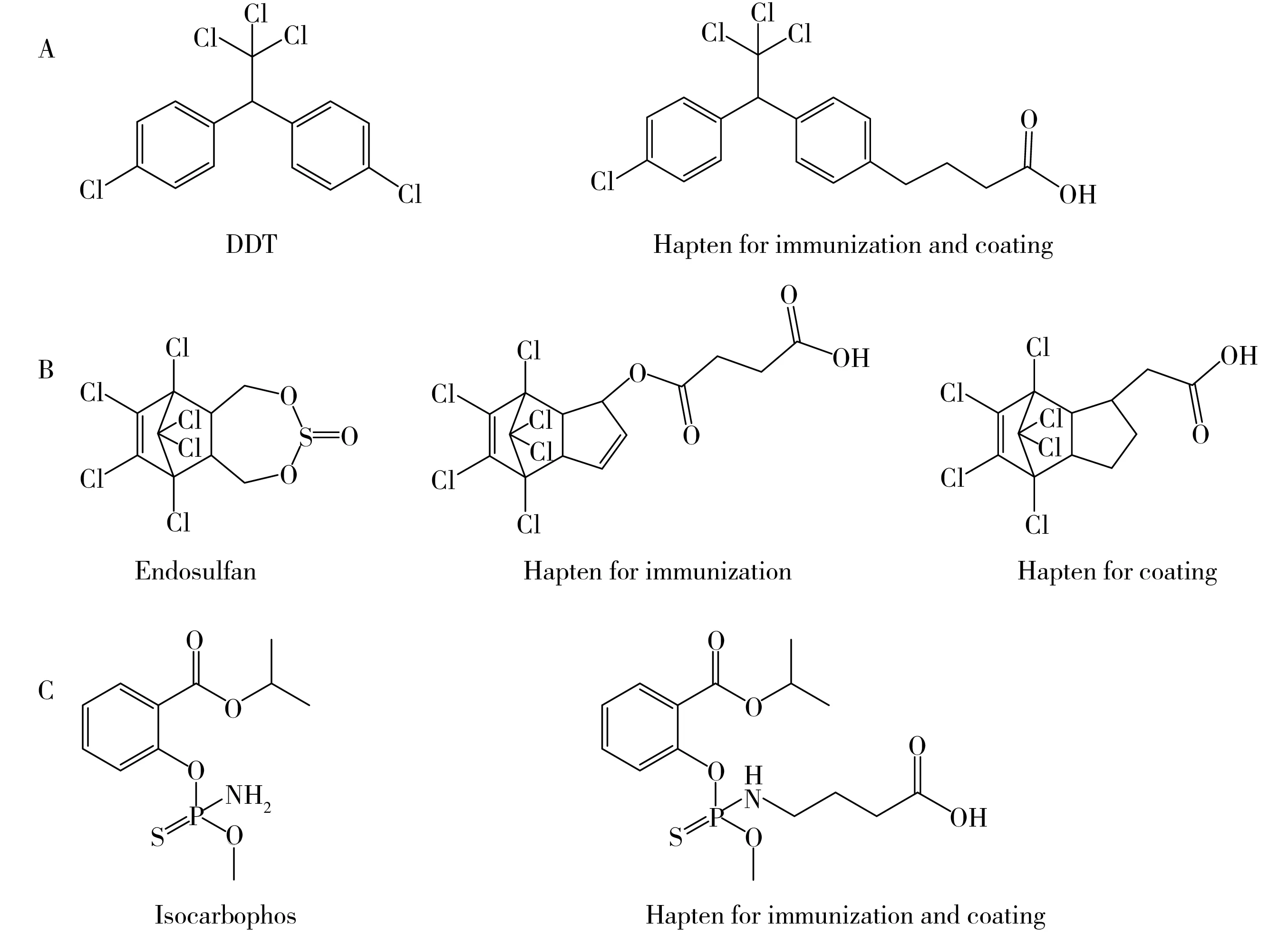
图1 农药及其半抗原结构图Fig.1 The structure of pesticides and its haptens A.DDT;B.endosulfan;C.isocarbophos
小鼠免疫:选择6周龄的BALB/c小鼠,将100 μL 1 mg·mL-1免疫抗原(每只小鼠)与等体积的FCA混合乳化后对小鼠进行首次免疫。3周后,使用相同剂量的免疫抗原与等体积的FIA混合乳化后免疫小鼠,随后每隔两周对小鼠进行一次免疫。第3次免疫后,每隔一周采集小鼠尾血,并使用ELISA进行评价。选择血清效价和灵敏度最佳的小鼠进行细胞融合实验。在细胞融合前3 d,用100 μL 1 mg·mL-1免疫抗原对小鼠进行冲刺免疫。
细胞融合:采用电融合法进行小鼠脾淋巴细胞与骨髓瘤细胞SP2/0的融合实验,电融合条件为:用终质量浓度为0.25 mg·mL-1的Pronase酶处理脾淋巴细胞和SP2/0,交流电压为45 V,直流电压为3 kV。融合后第14 d取融合细胞上清液进行ic-ELISA检测,筛选出存在特异性抗体的细胞培养孔,并使用有限稀释法进行亚克隆,获得稳定分泌特异性抗体的单克隆细胞株,将其扩大培养后保存于液氮中。将保存于液氮中的细胞株复苏并扩大培养,注射入已接种石蜡油的6周龄BALB/c小鼠腹腔中,待小鼠腹腔变大后收集腹水,并使用Protein A柱纯化单克隆抗体。
1.3 ic-ELISA程序
用碳酸盐缓冲液(Carbonate buffer solution,CBS)将包被抗原稀释至最优浓度,以100 μL/孔加入酶标板中,4 ℃过夜包被;将包被后的酶标板用含0.05%吐温的磷酸盐缓冲液(Phosphate buffer solution containing 0.05% Tween,PBST)洗涤5次后,每孔加入300 μL 含有3%脱脂奶粉的磷酸盐缓冲溶液(PBS),37 ℃封闭2 h;用PBST洗去残留的封闭液后,每孔加入50 μL系列稀释的分析物标准溶液或样品溶液,随后再加入50 μL 最优浓度的抗体溶液,37 ℃孵育1 h;反应结束后,用PBST洗涤酶标板10次,加入100 μL/孔HRP标记的羊抗鼠抗体(1∶20 000稀释),37 ℃孵育1 h;PBST洗涤10次后,每孔加入100 μL TMB显色液,37 ℃显色15 min;每孔加入50 μL终止液(2 mol·L-1H2SO4)结束反应,使用Spectra-Max M5酶标仪读取每孔在450 nm处的吸光值(OD450 nm)。
1.4 ic-ELISA反应条件优化
包被抗原与抗体用量优化:使用ELISA棋盘滴定法优化包被抗原和抗体的浓度,选择OD450 nm值(Amax)在1~2之间对应的包被抗原和抗体浓度。
Na+浓度优化:用Na+浓度为0.07、0.14、0.4、0.8、1.6 mol·L-1的PBS配制分析物的标准溶液和抗体溶液,建立不同Na+浓度下ic-ELISA的标准曲线;pH值优化:用pH值为6.0、6.5、7.0、7.4、8.0和9.0的PBS配制分析物的标准溶液及抗体溶液,建立不同pH值下ic-ELISA的标准曲线;甲醇浓度优化:用甲醇含量为5%、10%、20%和40%的PBS配制分析物的标准溶液(反应体系中甲醇的最终含量分别为2.5%、5%、10%和20%),建立不同甲醇含量下ic-ELISA的标准曲线。
1.5 特异性
配制系列浓度的分析物结构类似物的标准溶液,使用ic-ELISA进行分析,建立不同类似物的ic-ELISA标准曲线,计算IC50值后,按照下述公式计算交叉反应率(Cross-reactivity,CR):
CR%=[ IC50(分析物)/ IC50(结构类似化合物) ]×100
1.6 加标回收
稻田水和土壤样品采自南京当地农场,苹果和香蕉样品购自南京当地超市,所有样品使用GC或HPLC法均未检出DDT、硫丹和水胺硫磷,作为空白样品。稻田水样品过滤后添加分析物的甲醇溶液至终浓度为10、20、40 ng·mL-1;固体样品彻底均质化后,添加分析物的甲醇溶液至终浓度为150、300、600 ng·g-1。稻田水的加标样品在适当稀释后,直接使用ic-ELISA进行检测;对于固体样品,准确称取10 g加标样品于50 mL离心管中,加入20 mL 含30%甲醇的PBS提取分析物,充分涡旋5 min后超声15 min,继续涡旋5 min,4 000 r/min离心5 min后收集提取液,并用最优缓冲液定容至25 mL,将定容液适当稀释后使用ic-ELISA进行检测。
1.7 色谱仪器检测
稻田水样品均采自南京当地农场,分别向稻田水样品中随机添加未知浓度的DDT、硫丹和水胺硫磷,采用色谱仪和ic-ELISA同时检测。ic-ELISA的提取及检测程序如“1.6”所示;色谱检测的前处理及仪器条件如下:
DDT提取与GC分析:取稻田水样50 mL于分液漏斗中,加入30 mL石油醚剧烈振荡3 min,静置分层,收集上层有机相,再加入20 mL石油醚重复萃取。将两次萃取的有机相合并,过无水硫酸钠后旋转蒸发浓缩至近干,再使用氮吹仪吹干。用 2.0 mL 正己烷溶解提取物,过 0.2 μm 滤膜,利用GC(Aglient 7890N)检测DDT含量。色谱检测条件如下:色谱柱:DB-1701P,30.0 m×0.32 mm×0.25 μm毛细管柱;进样口温度:280 ℃;进样方式:分流进样;分流比 10∶1;进样体积:1 μL;载气(N2):3.0 mL·min-1;尾吹气(N2):60 mL·min-1;柱温:190 ℃保持 2 min,以 8 ℃· min-1升温至 270 ℃,保持 10 min;检测器及温度:电子捕获检测器(ECD),300 ℃。
硫丹提取与GC分析:稻田水样中的硫丹使用乙酸乙酯提取,提取程序与DDT相同。利用GC(Aglient 7890N)检测硫丹含量,色谱检测条件如下:色谱柱:HP-5,30.0 m×0.25 mm×0.25 μm 毛细管柱;进样口温度:280 ℃;进样方式:分流进样;分流比 5∶1;进样体积:1 μL;载气(N2):1.0 mL·min-1;尾吹气(N2):40 mL·min-1;柱温:160 ℃保持 1 min,以 15 ℃·min-1升温至 250 ℃,保持 4 min,以20 ℃· min-1升温至 280 ℃,保持3 min;检测器及温度:ECD,300 ℃。
水胺硫磷提取与HPLC分析:稻田水样中的水胺硫磷使用乙腈提取,以2.0 mL甲醇-水(60∶40,体积比)溶解提取物,其它提取程序与DDT相同。利用HPLC(Aglient 1260)检测水胺硫磷含量,色谱检测条件如下:色谱柱:Eclipse plus-C18,250 mm×4.6 mm×5 μm;流动相:甲醇∶水=60∶40(体积比);流速:1 mL·min-1,柱温 30 ℃,进样体积 20 μL,检测波长 225 nm。
2 结果与讨论
2.1 单克隆抗体特性
对融合细胞进行亚克隆后,共获得30株稳定分泌抗体的单克隆细胞株,并使用ic-ELISA验证每个细胞株所分泌抗体的灵敏度(表1)。DDT有16株,其中克隆5F9灵敏度最高(IC50=15.9 ng·mL-1),抗体亚型为IgG3型;硫丹有9株,其中克隆9F9灵敏度最高(IC50=12.3 ng·mL-1),抗体亚型为IgG3型;水胺硫磷有5株,其中克隆7C10B8灵敏度最高(IC50=15.6 ng·mL-1),抗体亚型为IgG2b型。

表1 DDT、硫丹和水胺硫磷的单克隆抗体细胞株灵敏度Table 1 Sensitivities of monoclonal antibodies cell lines to DDT,endosulfan and isocarbophos
2.2 ic-ELISA的最优条件
选择灵敏度最好的抗体建立DDT、硫丹和水胺硫磷的ic-ELISA测定方法。在竞争免疫分析中,包被抗原和抗体的用量是影响灵敏度的关键因素,通过棋盘滴定法确定DDT包被抗原和单克隆抗体(5F9)的最优工作浓度分别为0.06 μg·mL-1和2.5 μg·mL-1,硫丹包被抗原和单克隆抗体(9F9)的最优工作浓度分别为1 μg·mL-1和10 μg·mL-1,水胺硫磷包被抗原和单克隆抗体(7C10B8)的最优工作浓度分别为1.25 μg·mL-1和2.5 μg·mL-1。
在包被抗原和抗体的最优工作浓度下,继续优化缓冲液的Na+浓度和pH值。根据ic-ELISA阳性值(Amax)与灵敏度(IC50)的比值(Amax/IC50)选择最佳参数。如表2和表3所示,DDT、硫丹和水胺硫磷的最优Na+浓度和pH值均分别为0.14 mol·L-1和6.5、0.4 mol·L-1和7.4、0.8 mol·L-1和6.5。

表2 ic-ELISA的Na+浓度优化Table 2 The optimization of the concentrations of Na+ for ic-ELISA

表3 ic-ELISA的pH值优化Table 3 The optimization of pH value for ic-ELISA
在免疫分析中,通常需要有机溶剂提取和溶解分析物,但高浓度的有机溶剂会严重影响抗原和抗体的反应。其中,甲醇作为一种良好的有机溶剂,对免疫反应的影响相对较小,故选择甲醇用于分析物的溶解和提取。根据ic-ELISA阳性值(Amax)与灵敏度(IC50)的比值(Amax/IC50)选择最佳参数。如表4所示,DDT、硫丹和水胺硫磷ic-ELISA的最佳甲醇终含量分别为2.5%、10%和5%。
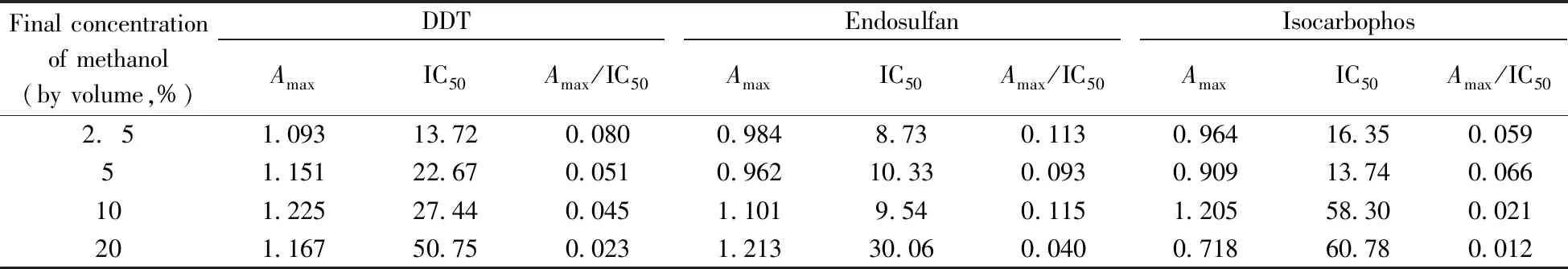
表4 甲醇含量对ic-ELISA的影响Table 4 Effect of methanol content on ic-ELISA
2.3 ic-ELISA的灵敏度
在最优条件下,以分析物质量浓度为横坐标、OD450 nm为纵坐标,使用Origin 8.0按照Logistic方程拟合出ic-ELISA的标准曲线(图2)。根据公式:ODX=抑制率×ODmax(ODmax:不加分析物时的OD450 nm减去空白对照孔的OD450 nm,ODX:抑制率为X时的OD450 nm),计算抑制率在10%、50%和90%时的OD450 nm值,并代入拟合出的Logistic方程,分别计算抑制率在10%(LOD,IC10)、50%(IC50)和90%(IC90)时的分析物浓度。其中DDT的IC50、线性范围(IC10~IC90)和LOD分别为10.72 ng·mL-1、1.85~102.6 ng·mL-1和1.85 ng·mL-1。Abad等[23]建立的ic-ELISA检测DDT的IC50为0.74 ng·mL-1,是本研究的14倍。本研究使用的半抗原与该文献相同,造成灵敏度差异的可能原因是:杂交瘤细胞株筛选的偶然性造成本研究未获得分泌高质量抗体的杂交瘤细胞株。但基于单克隆抗体5F9的ic-ELISA的灵敏度(LOD或IC50)均高于其他已报道的DDT抗体[24-25]。硫丹的IC50、IC10~IC90和LOD分别为9.69 ng·mL-1、2.19~39.92 ng·mL-1和2.19 ng·mL-1,灵敏度略低于Manclús等[27]建立的硫丹ic-ELISA(IC50=2.85 ng·mL-1)。水胺硫磷的IC50、IC10~IC90和LOD分别为13.26 ng·mL-1、3.04~73.01 ng·mL-1和3.04 ng·mL-1,高于Wang等[28]和秦娜[29]建立的ic-ELISA的灵敏度。
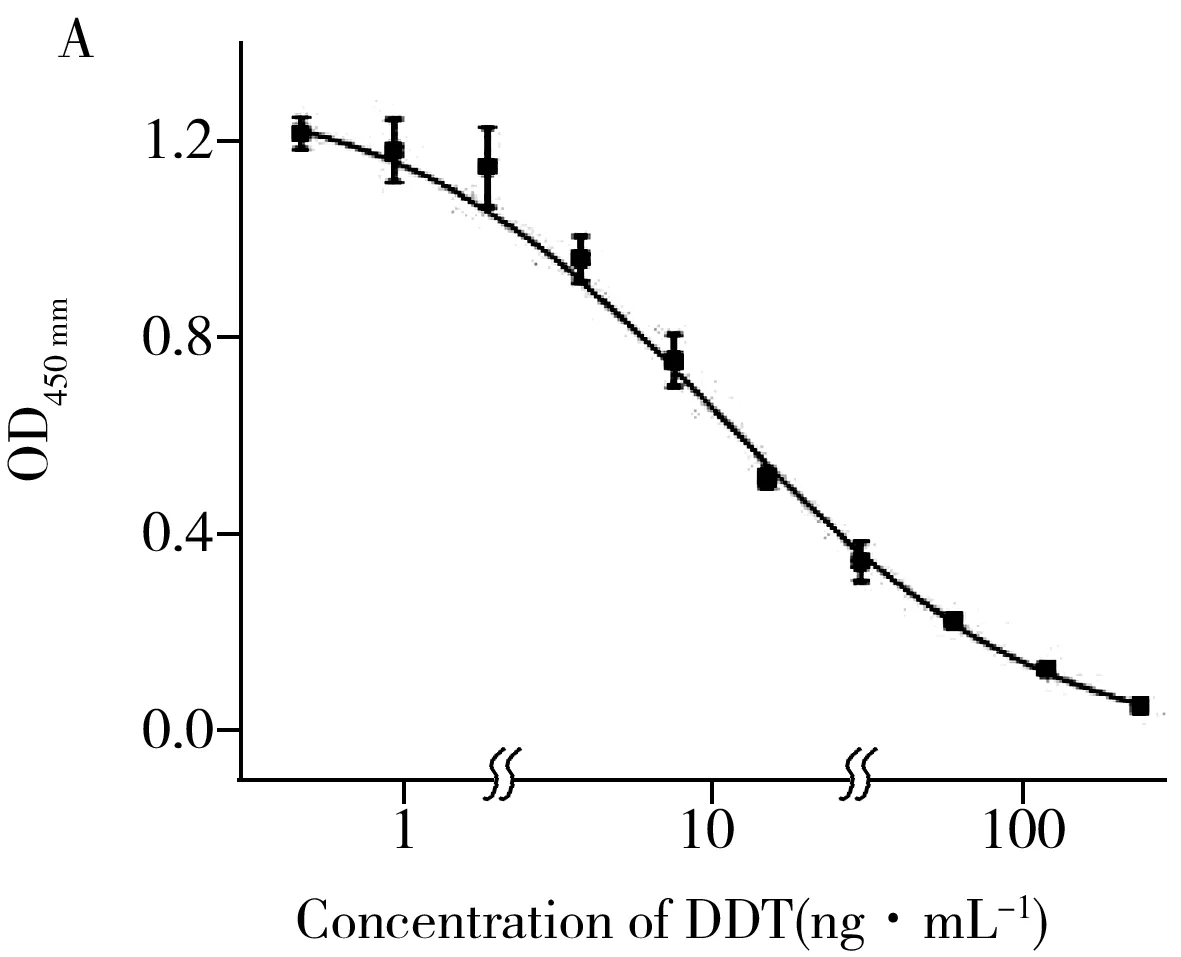
2.4 ic-ELISA的特异性
利用与结构类似化合物的CR来评价ic-ELISA的特异性(表5)。由于o,p'-DDT(CR=33.4%)、p,p'-DDE(CR=17.7%)和o,p'-DDE(CR=9.0%)与p,p'-DDT 的结构相似,故DDT的 ic-ELISA对这些结构类似化合物均表现出较大的交叉反应(9.0%~33.4%),但对其他类似物均无明显交叉反应(CR≤2.4%)。硫丹的ic-ELISA对艾氏剂、氯丹、狄氏剂、β-硫丹和α-硫丹均存在明显的交叉反应(CR≥17.4%),对其他结构类似化合物均无交叉反应(CR≤1.0%)。水胺硫磷ic-ELISA的特异性较好,对水胺硫磷的6种结构类似化合物均无交叉反应(CR<0.1%)。
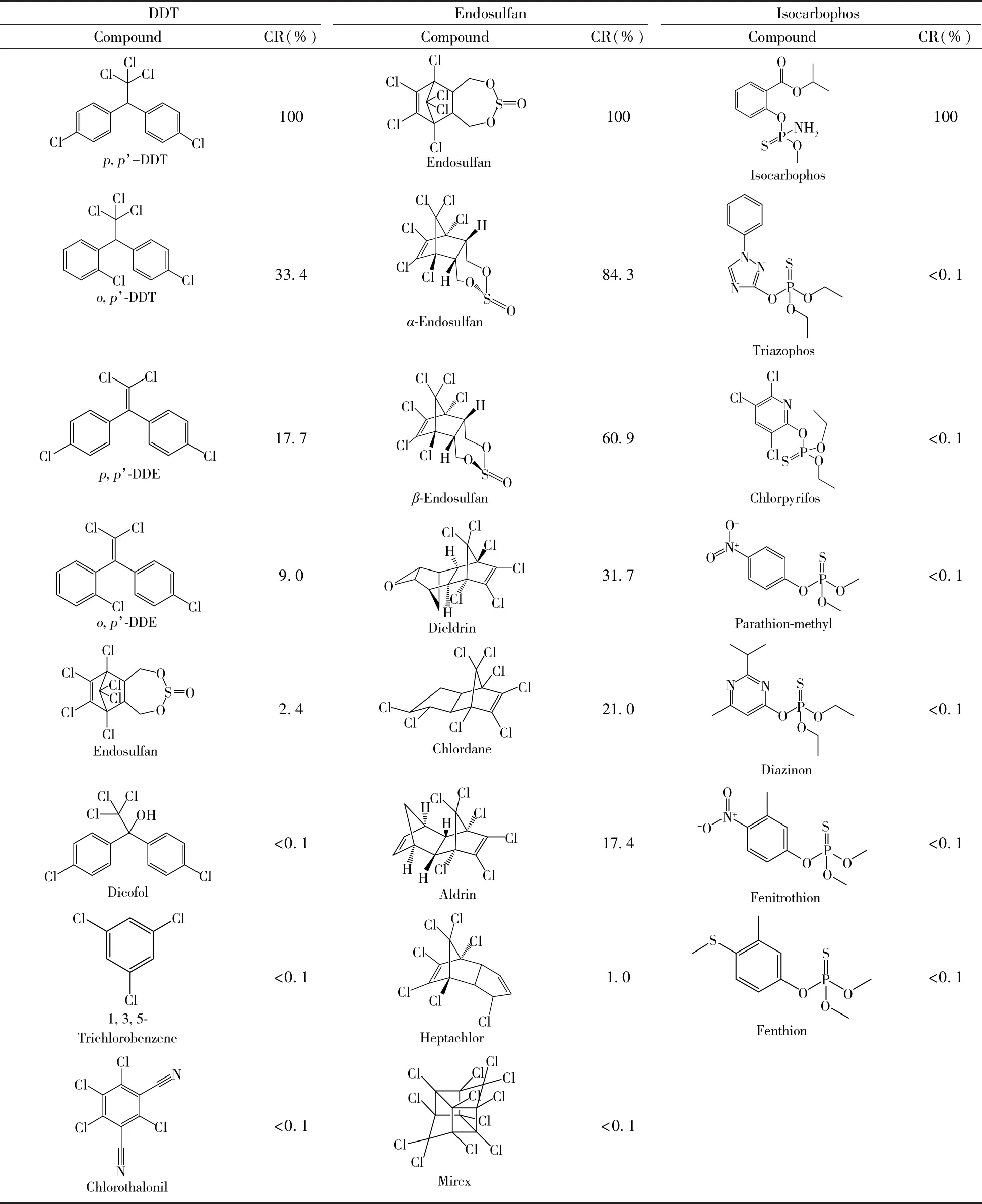
表5 ic-ELISA对分析物结构类似化合物的交叉反应Table 5 Cross-reactivity of a set of analogues structurally related to analyte by ic-ELISA
(续表5)

DDTEndosulfanIsocarbophosCompoundCR(%)CompoundCR(%)CompoundCR(%)<0.1<0.1
2.5 加标回收率
样品基质对抗原-抗体的免疫反应存在干扰,影响免疫分析方法的准确性。因此,在检测前需对样品提取液进行净化。由于免疫反应特异性强,基质干扰可通过稀释样品提取液的方法去除,该方法简便、快速,但会降低免疫分析的灵敏度。将空白样品的提取液进行倍比稀释,配制基质标准曲线,选择与缓冲液标准曲线基本重合的最低稀释倍数为样品检测的稀释倍数。DDT进行 ic-ELISA检测时对稻田水样品的最终稀释倍数为2倍、苹果样品的最终稀释倍数为30倍、土壤和香蕉样品的稀释倍数为60倍。硫丹则需对稻田水样品稀释4倍、苹果和土壤样品稀释30倍、香蕉样品稀释60倍。水胺硫磷需将稻田水样品稀释2倍,其他样品均需稀释30倍。
在相应稀释倍数下,DDT、硫丹和水胺硫磷进行ic-ELISA检测的平均回收率及相对标准偏差(RSD)分别为71.4%~93.3%和3.8%~9.6%、74.0%~97.4%和3.0%~11%及70.8%~97.0%和4.2%~12%(表6),表明ic-ELISA对加标样品检测的准确性高[31]。样品加标浓度根据ic-ELISA的灵敏度和样品基质稀释倍数设置,3种农药在稻田水中的加标水平为10、20、40 ng·mL-1,在土壤、苹果和香蕉中的加标水平为150、300、600 ng·g-1。根据中国食品安全国家标准[7],DDT在不同食品中的再残留限量范围为0.02~2 mg·kg-1,硫丹和水胺硫磷在不同食品中的MRLs分别为0.01~10 mg·kg-1和0.01~0.05 mg·kg-1。因此,采用本研究建立的ic-ELISA进行实际测定时需对水胺硫磷样品及部分DDT和硫丹样品进行净化和浓缩,其灵敏度才能达到检测需求。

表6 ic-ELISA对加标样品的平均回收率Table 6 Average recoveries of spiked samples by the ic-ELISA
2.6 与仪器检测的一致性
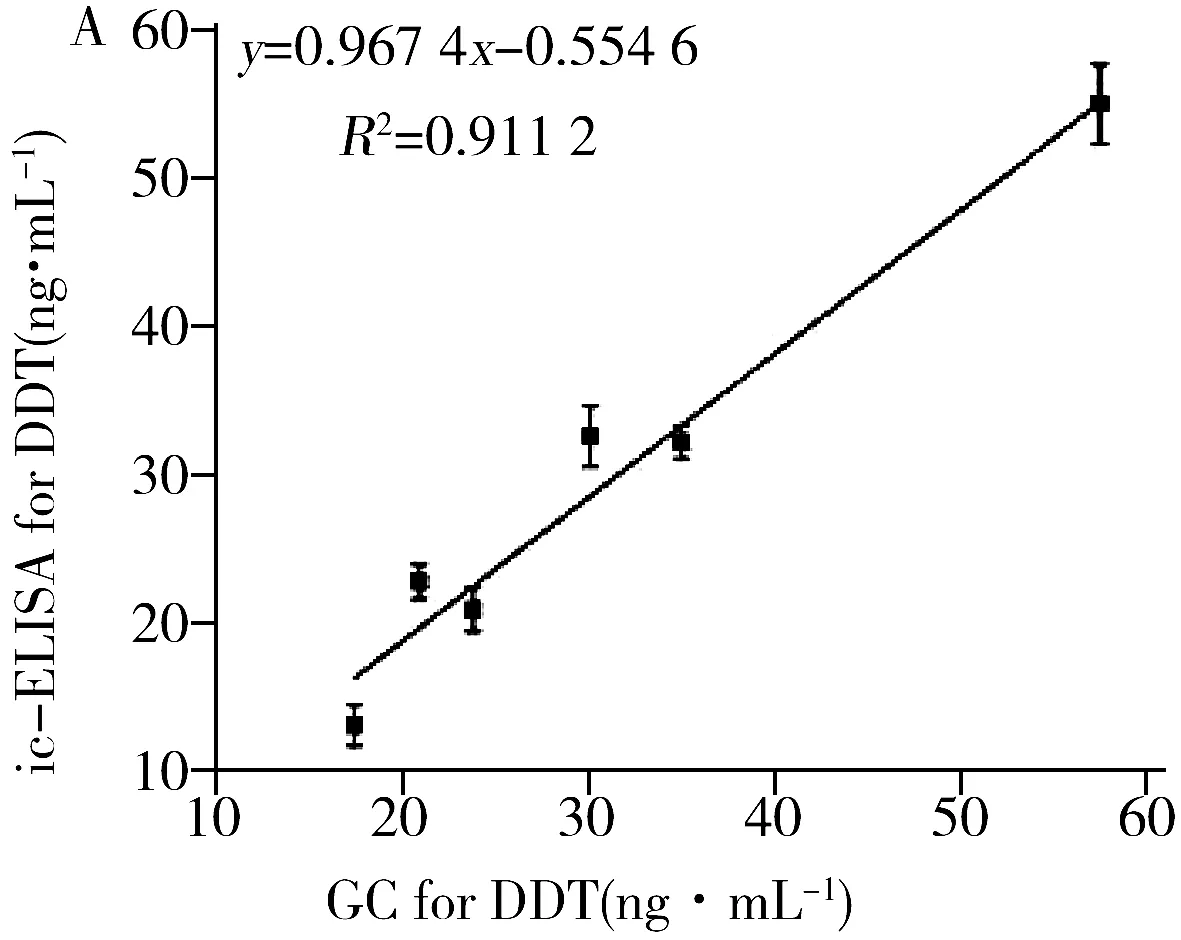
ic-ELISA和GC对稻田水样品中DDT的检测结果分别为13.1~55.0 ng·mL-1和17.4~57.5 ng·mL-1,两组检测结果的P=0.147 2(>0.05);ic-ELISA和GC对稻田水样品中硫丹的检测结果分别为14.3~55.1 ng ·mL-1和20.7~62.0 ng·mL-1,两组检测结果的P=0.129 6(>0.05);ic-ELISA和HPLC对稻田水样品中水胺硫磷的检测结果分别为16.4~75.2 ng·mL-1和15.7~83.1 ng·mL-1,两组检测结果的P=0.271 1(>0.05)。上述结果表明ic-ELISA的检测结果与色谱仪器法无显著性差异。此外,ic-ELISA和色谱仪器法对DDT、硫丹和水胺硫磷检测结果之间线性回归方程的斜率和R2值均接近 1(图3),表明ic-ELISA与色谱仪器法的检测结果具有良好的一致性。
3 结 论
本研究分别制备了DDT单克隆抗体细胞株16株、硫丹9株、水胺硫磷5株,选择灵敏度较高的单克隆抗体(5F9、9F9和7C10B8)分别建立了DDT、硫丹和水胺硫磷的ic-ELISA测定方法。系统优化后,ic-ELISA对DDT、硫丹和水胺硫磷的IC50和LOD分别为10.72 ng·mL-1和1.85 ng·mL-1、9.69 ng·mL-1和2.19 ng·mL-1、13.26 ng·mL-1和3.04 ng·mL-1。本研究建立的ic-ELISA的灵敏度均优于国内科研机构已报道的数据,但DDT和水胺硫磷的灵敏度较国外报道的低。在特异性方面,DDT、硫丹与结构类似物具有明显的交叉反应(9.0%≤CRDDT%≤33.4%、17.4%≤CR硫丹%≤84.3%),水胺硫磷无明显交叉反应(CR<0.1%)。ic-ELISA对不同基质中农药的平均加标回收率和RSDs分别为70.8%~97.4%和3.0%~12%,且对盲样的检测结果与色谱仪器一致,表明ic-ELISA的准确性高。然而,ic-ELSIA在实际应用中需对水胺硫磷样品及部分DDT和硫丹样品进行净化和浓缩,灵敏度才能达到检测要求。
总之,本研究制备的单克隆抗体的质量和建立的ic-ELISA的灵敏度较我国自主知识产权的抗体和ic-ELISA有所提高,但是仍需质量更好的抗体或灵敏度更高的检测方法,才能配合稀释法(前处理)实现对实际样品的检测。

