免疫检查点抑制剂在脑胶质瘤中的研究进展及治疗策略
林凯龙 陈刘生 张荣生 王冠梁(中国人民解放军陆军第75集团军医院,大理671000)
胶质瘤是中枢神经系统最常见的原发性肿瘤。世界卫生组织将其按病理学归为4级,其中第4级又称为胶质母细胞瘤(glioblastoma,GBM),具有极强的侵袭和血管生成能力,即使应用传统肿瘤切除手术及标准放化疗治疗,其5年生存率和中位生存期仅分别为9.8%和14个月左右[1-2]。近年来,抗血管内皮生长因子(vascular endothelial growth factor,VEGF)制剂贝伐单抗(Bevacizumab)和低密度交变电场被用于复发GBM患者的临床研究,但其在延长生存期上仍未获得实质性进展,因此急需新的临床治疗方式改善胶质瘤患者的治疗现状和预后[3-4]。肿瘤免疫治疗已经发展了100多年,是一项十分成熟的肿瘤治疗技术,旨在通过提高机体内肿瘤特异性免疫反应抑制肿瘤的发生发展。其中针对免疫检查点(immune checkpoints,IC)的治疗越来越受到专家的重视,多个针对IC的靶向药物已经获得药物监管机构的通过并在部分类型(黑素瘤、非小细胞肺癌、肾癌、膀胱癌等)的肿瘤患者中取得了可观的疗效[5-8]。然而,基于中枢神经系统独有的解剖结构和免疫环境,针对胶质瘤患者的IC靶向治疗仍处于起步阶段,但是仍表现出了可观的治疗潜力。本文就胶质瘤细胞的免疫逃逸机制、IC抑制剂在胶质瘤中的研究进展及下一步的治疗策略等进行综述,旨在为其临床治疗提供有价值的借鉴。
1 胶质瘤的免疫学特点
1.1 解剖及免疫学基础 传统观点认为中枢神经系统具有免疫豁免性,即中枢神经系统存在血脑屏障并且缺乏抗原提呈细胞(antigen presenting cells,APCs)——树突状细胞、巨噬细胞、T淋巴细胞、淋巴管、淋巴结及其他重要的免疫器官,导致许多生物活性分子及免疫细胞难以进入其中,从而缺乏正常的免疫功能[9]。但随着研究的进展,该观点被逐渐打破:①在荷瘤条件下,随着肿瘤的进展和炎症环境的转变,组成血脑屏障的微血管对生物大分子和免疫细胞的通透性增加[10];②有研究者发现,硬脑膜窦内存在具有完整功能的淋巴管[11];③中枢神经系统本身存在的小胶质细胞、星形胶质细胞也能充当APCs,产生肿瘤免疫反应[12]。以上3点原因共同支持中枢神经系统的肿瘤抗原能够经脑脊液-血管周围间隙-硬脑膜窦淋巴管-颈深淋巴结-外周淋巴组织通路进行抗原提呈,之后活化的肿瘤特异性淋巴细胞再经脉络丛进入脑脊液,被局部抗原提呈细胞进一步刺激活化,最后通过不完整的血脑屏障进入脑实质发挥肿瘤杀伤效应[11,13-14]。近期,研究人员发明的天然纳米分子和抗肿瘤靶向药物形成的免疫偶联物,其可增强药物对血脑屏障的通透性,从而提高对颅内肿瘤的治疗效果[15]。综上所述,中枢神经系统虽然存在特殊的解剖及免疫学机制,但其仍具有一定的与全身免疫系统相互作用、发挥免疫应答的能力,为胶质瘤的免疫治疗奠定基础。
1.2 免疫逃逸机制 胶质瘤的肿瘤微环境是具有免疫抑制性的,多种因素参与了肿瘤细胞的免疫逃逸,共同构成了一个复杂的免疫调控机制。
1.2.1 内源性因素 免疫逃逸的内源性因素可简单概括为募集到肿瘤组织的各种炎症细胞及生物活性分子经过环境的适当“改造”,转变为助力肿瘤细胞逃避机体免疫系统攻击的“帮凶”。具体机制包括:①肿瘤细胞及其他抗原提呈细胞组织相容性复合物Ⅰ类(MHCⅠ)分子的表达下调,使自身免疫细胞无法识别;②可溶性免疫抑制性生物活性分子如TGF-β、IL-10、前列腺素E2、VEGF等过量募集,在局部形成免疫抑制的细胞因子网络;③免疫抑制性炎症细胞如调节性T淋巴细胞(regulatory T-cells,Tregs)、M2型肿瘤相关性巨噬细胞(tumor-associated macrophages,TAMs)、骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSCs)等大量浸润,进一步参与免疫抑制网络的调控;④细胞间膜蛋白的相互作用导致免疫抑制性信号通路的激活,这里包括经典的细胞凋亡相关的Fas/FasL通路及本文重点考察的IC通路(CTLA-4/CD80/86、PD-1/PDL1、TIM-3/Galectin等)[16]。值得一提的是,以上各因素并不是独立发挥作用,而是相互影响协同作用。例如,Tregs能通过分泌TGF-β抑制树突状细胞的成熟和效应T细胞的产生,同时又通过高表达的CTLA-4与效应T细胞表面的CD80/86结合,进一步抑制后者的功能[17-18]。
1.2.2 外源性因素 由于胶质瘤患者大部分长期接受细胞毒性化疗药及其他影响机体免疫功能的药物,如糖皮质激素的治疗,特别在年龄较大的患者人群中会因此存在外源性的获得性免疫反应缺失,即全身免疫系统处于被动抑制状态[19]。但近期也有研究发现,在小鼠模型中,中枢神经系统的特殊环境可减轻局部肿瘤免疫治疗效果受外源性糖皮质激素的负向影响,该结论有待于人体试验的进一步验证[20]。
因此,根据胶质瘤上述免疫学特点,可以针对性地设计靶点进行干预。即尽可能地逆转有利于肿瘤发生发展的免疫抑制状态,激发及维持有利于杀伤肿瘤的免疫反应,这也是肿瘤免疫治疗的基本出发点,且有望成为治疗胶质瘤的新方法。
2 主要IC抑制剂及其研究进展
人体免疫系统始终处于动态平衡状态,当病原体入侵时,免疫细胞会被APCs提呈的抗原信号及共刺激信号激活,但同时也会逐渐上调表达一系列共抑制受体,使其在适当时间点传导共抑制信号,终止免疫反应,防止过度免疫反应损伤自身正常组织,而这一系列主要以膜表达为主的共抑制受体及其下游信号通路即为IC[21]。肿瘤细胞正是利用这一机制,通过持续过度放大IC信号,打破正常的平衡状态,使之成为肿瘤免疫逃逸的重要手段之一,同时也为IC抑制剂治疗提供有利靶点。由此可见,IC抑制剂并非直接针对肿瘤细胞,而是通过调节肿瘤微环境中免疫细胞的功能达到抗肿瘤的目的,其也日益成为肿瘤免疫治疗的主要手段之一。
2.1 CTLA-4 细胞毒性T淋巴细胞相关抗原-4(cytotoxic T-lymphocyte antigen 4,CTLA-4)是第一个被发现的共抑制分子,主要表达在活化的T细胞和Tregs上。在肿瘤环境中,其通过与配体CD80/86结合,一方面直接传导共抑制信号阻碍效应T细胞进一步活化,另一方面又能增强Tregs的免疫抑制功能[22]。基础研究表明,在小鼠胶质瘤模型中,CTLA-4抑制剂能增强CD4+T细胞的增殖能力,同时下调Tregs和CD4+T细胞比值,而在GBM患者中,CD4+和CD8+T细胞上CTLA-4的表达量与患者的预后呈负相关,下调CTLA-4表达预示着更好的预后[23-24]。进入临床试验的CTLA-4抑制剂包括Ipilimumab和Tremelimumab,其中Ipilimumab是第一个获得美国药监局通过的IC抑制剂,用于治疗黑素瘤[5]。目前关于CTLA-4抑制剂的临床试验已注册的有16项,但都尚未完成,已经发布初期结果的临床研究只有1项(NCT02017717),是一项针对GBM患者的Ⅲ期临床试验,其中有一项涵盖20位患者的子试验考察了Ipilimumab和另一种IC抑制剂Nivolumab联合治疗对比贝伐单抗治疗。发布的结果显示,在联合治疗组,3位患者获得部分有效,8位患者疾病12周以上未再进展,但由于后续治疗失败,该试验被暂时中止[25-26]。由此可见,CTLA-4抑制剂治疗对部分T胶质瘤患者可能获益,但还需要更多临床试验数据支持。
2.2 PD-1/PD-L1 程序性细胞死亡蛋白1(programmed cell death protein 1,PD-1)主要表达于效应T细胞,与CTLA-4类似传导共抑制信号阻止T细胞过度活化。但在肿瘤环境中,PD-1也是衰竭T细胞的标志分子,该种T细胞表现为表型变化和功能丧失,是肿瘤实现免疫逃逸的重要环节[27]。基础研究发现:一方面,PD-1在胶质瘤病人的外周血和肿瘤浸润T细胞上的表达较正常对照显著上调,且直接与肿瘤浸润CD4+T细胞分泌抗肿瘤细胞因子IFN-γ的缺失相关[28-29];另一方面,Tregs在胶质瘤也高表达PD-1,发挥促进自身成熟和免疫抑制功能维持的作用[30]。除PD-1以外,其配体PD-L1在胶质瘤的发生发展中也扮演重要角色。PD-L1主要表达于APCs和肿瘤细胞。值得注意的是,PD-1/PD-L1的作用是双向的,肿瘤细胞上的PD-L1同样会传导信号影响肿瘤细胞的生物学特性,如GATO-CAÑAS等[31]发现,PD-L1的胞内信号有助于肿瘤细胞抵御IFN的细胞毒性作用,加速肿瘤进展。在胶质瘤中,PD-L1的表达直接与肿瘤分级呈正相关,且与预后标志物异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)的突变状态相关,IDH野生型肿瘤PD-L1的表达较IDH突变型显著升高[32-33]。
目前针对PD-1的抑制剂主要有Nivolumab、Pembrolizumab及Pidilizumab等,其中Nivolumab和Pembrolizumab已被美国药监局通过用于治疗黑素瘤、非小细胞肺癌、肾癌等多种肿瘤[6-7,34]。在胶质瘤的临床试验中,目前已注册的有61项,已经完成的有3项(表1)。其中只有1项(NCT02337491)已在临床试验网站公布结果,但尚未发表论文,该试验是涵盖80位患者的Ⅱ期临床试验,考察Pembrolizumab和Bevacizumab联合治疗GBM对比Pembrolizumab单独治疗的效果和毒副作用。最新公布的结果显示,联合治疗组和单药组的mPFS和ORR分别为4.1(95%CI:2.8~5.5)vs 1.4(95%CI:1.4~2.7)以及20%(95%CI:0.11~0.32)vs 0%(95%CI:0.0~0.095),总毒副反应发生率分别为44.00%和33.33%,提示Pembrolizumab联合Bevacizumab对GBM可能有更好的治疗效果,但毒副作用也随之升高。值得注意的是,另一项试验(NCT02550249)提出了针对IC抑制剂的新辅助治疗(neoadjuvant)方式,即在肿瘤切除手术前应用Nivolumab,术后再继续行Nivolumab常规辅助治疗。该试验在新发布的论文中提及,虽然该联合疗法对提高患者mPFS[4.1(95%CI:2.8~5.5)]和mOS[7.3(95%CI:5.4~7.9)]程度相较既往治疗不明显,但其能够显著增强肿瘤局部的免疫应答[35]。然而,同期发布的另一项小型临床试验(未注册)发现,针对Pembrolizumab的新辅助疗法结合术后常规辅助治疗相较单纯术后辅助治疗能显著提高胶质瘤患者的OS,增强抗肿瘤免疫反应,且有利于减少术前肿瘤负荷以及建立稳定的免疫记忆,增加彻底清除肿瘤细胞的可能性[36]。二者预后结果的差异可能由临床样本的局限性和异质性引起,该疗法对提高IC抑制剂抗肿瘤免疫反应疗效是值得肯定的。针对PD-L1的抑制剂主要包括Avelumab、Durvalumab和Atezolizumab,其注册的临床试验共有15项,已完成的有1项(表1),但尚未公布结果。
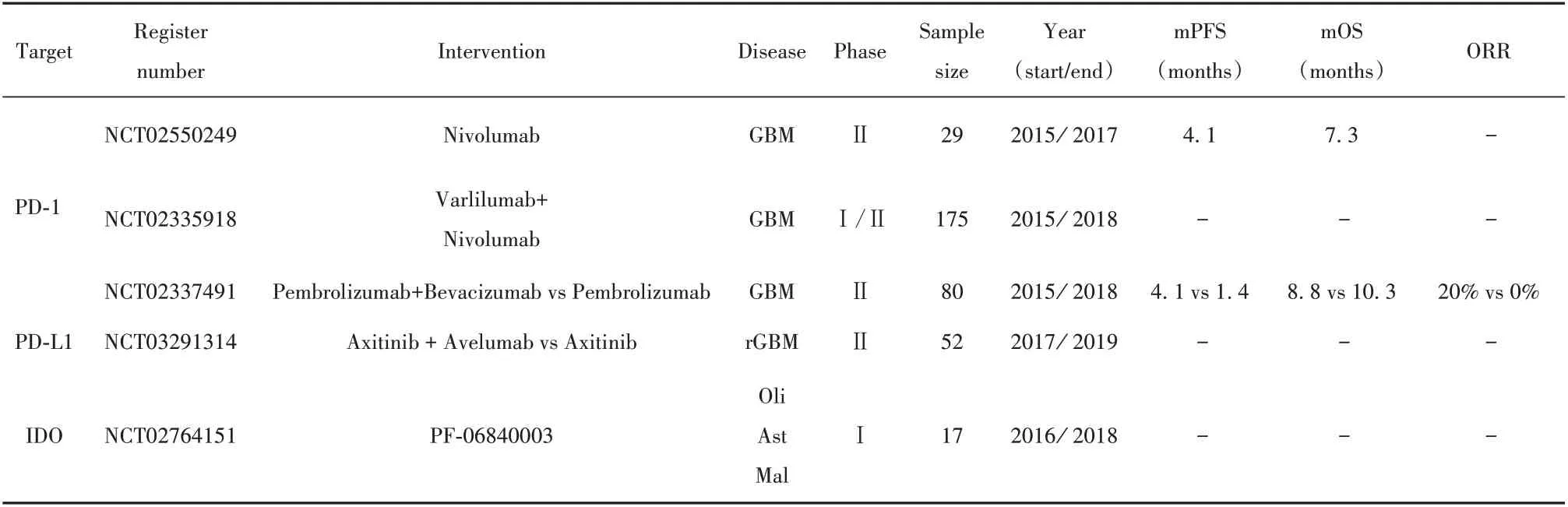
表1 已完成的免疫检查点抑制剂在胶质瘤中的临床试验Tab.1 Completed clinical trials evaluating immune checkpoint inhibitors in gliomas
2.3 其他IC分子 其他IC相关分子包括吲哚胺双加氧酶(indoleamine 2,3-dioxygenase,IDO)、T细胞免疫球蛋白黏蛋白3(T cell immunoglobulin mucin-3,TIM-3)、淋巴细胞活化基因3(lymphocyte activation gene 3,LAG-3)等,同样参与胶质瘤的免疫逃逸。IDO是一种色氨酸代谢酶,负责色氨酸降解,后者是T细胞功能维持的重要营养物质,而IDO本身又能促进Tregs的浸润[37-38]。因此在胶质瘤中,IDO通过抑制效应T细胞功能和募集Tregs促进肿瘤发生发展,且其表达高低与肿瘤恶性程度、患者不良预后均呈正相关[38-39]。TIM-3、LAG-3和PD-1类似,也是衰竭T细胞的重要的分子标志[27]。基础研究发现,肿瘤浸润的T细胞常常共表达PD-1、TIM-3和LAG-3,并且共同抑制T细胞功能[40-41],而在GBM患者中,TIM-3的高度表达和更高的肿瘤分级以及IDH未突变状态均相关[42]。目前IDO的抑制剂Indoximod和PF-06840003已进入临床试验,共3项,其中1项已完成(表1),但未公布结果。针对TIM-3和LAG-3研制的抑制剂分别为MBG453和BMS-986016,目前分别有1项和2项进入临床试验但尚未完成。
3 未来研究方向及治疗策略
肿瘤细胞能调动自身和环境的多种机制促进自身的增殖和转移。如前文所述,肿瘤免疫逃逸是一个涉及多因素的复杂庞大的调控网络,各因素协同发挥作用。因此,针对单独靶点治疗很可能达不到预想的疗效,例如KURZ等[43]发现在复发性高分级胶质瘤患者中,单独应用PD-1抑制剂Nivolumab或Pembrolizumab治疗并不能显著延长患者的无进展生存期。因此,应用多靶点联合治疗是一个亟待探讨的方式,这也有望被将来的肿瘤免疫治疗普遍采纳。
3.1 不同IC抑制剂的联合治疗 虽然IC分子都具有调节免疫的功能,但其介导的信号通路不尽相同,且往往相互影响、协同作用[44]。如前文提及的PD-1、TIM-3、LAG-3等,被发现在结肠癌、乳腺癌、黑素瘤等多种肿瘤中都存在共表达,且较单独分子的表达对肿瘤浸润T细胞增殖和炎症细胞因子分泌功能抑制更明显,即T细胞表现为一种更严重的衰竭状态,且在小鼠模型中联合应用不同IC分子的阻断抗体较单独治疗对T细胞功能的恢复更加明显[40-41,45-46]。此外,PD-1和IDO通过诱导Tregs的FoxP3表达调控其CTLA-4表达,而CTLA-4又能和CD80/86结合上调IDO表达[47-49]。在胶质瘤的临床试验中也有相当一部分采用多种IC阻断剂联合治疗,旨在从更大程度上逆转T细胞的衰竭或失能状态,但其疗效有待更多结果公布。
3.2 IC抑制剂和传统治疗结合 肿瘤的传统治疗包括手术切除、化学药物治疗及放射治疗等。往往肿瘤患者接受传统治疗后仍出现肿瘤复发和转移是因为其不能够彻底清除机体所有的肿瘤细胞,相关机制包括肿瘤细胞产生对放化疗的耐受能力及其大量向周围基质或血管浸润等。因此,如何清除这些残留的肿瘤细胞对患者预后至关重要。既往研究表明,PD-1抑制剂联合放射治疗有助于患者预后的进一步改善,例如在脑干胶质瘤患者身上联合应用Nivolumab和重复照射相较单独放疗能在一定程度上延长患者总生存期,研究人员认为这可能与放疗使肿瘤细胞释放大量抗原刺激机体更多免疫细胞浸润有关[50-51]。此外,在小鼠胶质瘤模型上联合应用化疗药替莫唑胺和PD-1或IDO抑制剂相较二者单独治疗能更显著延长小鼠生存期,抑制肿瘤生长[52-53]。目前传统治疗仍是所有胶质瘤患者的一线治疗手段,而IC抑制剂的加入有望起到协同治疗作用,但其是否会同时增加前者的毒副反应及二者治疗时间点的选择还需要进一步研究。
3.3 IC抑制剂和抗血管生成治疗结合 血管正常化理论在抗肿瘤治疗中扮演重要的角色,肿瘤中异常的血管生成能够通过制造乏氧环境、分泌大量促血管生成因子,如VEGF等引起一系列级联反应,一方面抑制抗肿瘤淋巴细胞功能,另一方面增加促肿瘤炎症细胞富集,这也成为影响IC抑制剂疗效的主要原因之一[54]。在基础研究中发现VEGF阻断抗体能够选择性下调多种IC分子表达,一些新型的抗血管生成药物,如重组人血管内皮抑制素也不断被研发并在联合PD-1抗体治疗肿瘤中取得较好的疗效[55-57]。近年来,考察IC抑制剂和抗血管生成药物如Bevacizumab、Apatinib、Axitinib、Endostar等在多种肿瘤(肾癌、乳腺癌、非小细胞肺癌、肝癌等)中联合治疗的临床试验也明显增多,且取得了一定进展,其在胶质瘤患者中的疗效还有待继续探讨。
3.4 针对IC的其他治疗方式 随着研究的日益进展,针对IC的治疗也不断涌现出新的治疗方法,且不再局限于单纯的阻断抗体,而这些方法可能弥补阻断抗体治疗剂量大、时间长和随之带来的毒副作用发生率增高的不足。微小RNA(microRNA,miRNA)是一类在转录后水平广泛调控基因表达的非编码RNA分子。研究发现miR-138、miR-34a等在胶质瘤模型中对IC分子的表达调控起重要作用,其中miR-138能抑制T细胞CTLA-4、PD-1的表达,应用miR-138在动物实验中能有效抑制肿瘤生长,而miR-34a则是PD-L1的负向调控因子[58-59]。此外,第10号染色体上缺失的磷酸酶-张力蛋白同系物(phosphatase and tensin homolog deleted on chromosome ten,PTEN)和细胞周期蛋白依赖激酶5(cyclindependent kinase 5,Cdk5)都是已证实的PD-L1表达的调控蛋白,前者通过阻断PI3K-Akt通路抑制PDL1蛋白的翻译进程,后者在IFN-γ诱导的PD-L1表达上调过程中发挥重要促进作用,而在胶质瘤中,相当一部分PTEN都处于突变或表达缺失状态[60-61]。因此,针对上述上游分子靶点设计治疗药物有希望作为一种更广义的IC抑制剂,通过直接干预相应IC的表达来抑制其介导的促肿瘤效应。
当然,目前探讨的包含IC抑制剂的联合治疗方式远不只以上几种,越来越多的治疗如肿瘤疫苗、病毒疫苗、细胞因子靶向治疗等被研究人员尝试和IC抑制剂进行联合应用以期达到更好的抗肿瘤疗效[62-65]。
4 结语
中枢神经系统虽然具有独特的免疫环境,但仍能产生有效的抗肿瘤免疫应答,因此免疫治疗在胶质瘤的治疗中具有巨大潜力。针对IC的靶向治疗目前已成为进展迅速且疗效可观的肿瘤免疫治疗方法,并且CTLA-4、PD-1的多种阻断药物已经被药监机构通过作为非小细胞肺癌、黑素瘤等疾病的临床用药,但IC抑制剂在胶质瘤治疗的应用仍处于前期临床试验阶段。此外,针对不同类型分期胶质瘤患者对IC抑制剂治疗的生物学标志的选择以及IC抑制剂联合其他肿瘤治疗手段的方式时机的确定还需更近一步的基础和临床研究加以验证和探讨。因此,显著实现IC抑制剂对更多胶质瘤患者疗效的提高及预后的改善还任重道远。