4种临床抗结核药物对A549细胞TLRs信号通路和炎症因子表达的影响①
王 娟 程 龙 李文静 胡育龙 曾 瑾 李 敏 高蔚丰 李 勇
(宁夏大学西部生物资源保护与利用教育部重点实验室,银川750021)
结核病(tuberculosis,TB)是一种慢性、消耗性人兽共患传染病,由结核分枝杆菌(mycobacterium tuberculosis,MTB)单一传染性病原体感染引起[1]。目前TB已成为全球十大死因之一,死亡率高于包括HIV在内的单一传染病[2]。我国每年TB新发病例约为90万,是全球第三大TB高负担国家[3]。根据疾病预防控制局发布数据显示,2018年我国现有肺结核患者82.33万例,死亡病例3 149例,报告发病率和报告死亡率均位居乙类传染病第二。对于细菌感染性TB临床常采用抗生素治疗,但常伴有MTB耐药问题[4]。目前临床治疗肺结核主要采用抗生素组合疗法,但多种抗生素长期使用导致机体免疫相关细胞相互作用,进而影响机体抗结核免疫反应[5]。
MTB是典型的胞内寄生菌,肺泡巨噬细胞作为免疫调节细胞和效应细胞,在感染过程中通过吞噬、抗原提呈和分泌多种细胞因子等功能调控机体免疫应答和炎症反应[6]。由于感染巨噬细胞的能力对细菌在宿主体内的传播和扩散至关重要,既往抗结核免疫机理研究中,结核菌与肺泡巨噬细胞的相互作用一直是研究重点和热点[7]。但近年研究发现,肺泡Ⅱ型上皮细胞(alveolar epithelial typeⅡcells,AECⅡ)与巨噬细胞类似,也是MTB感染的主要靶细胞,是由呼吸道吸入TB病原菌最先感染的细胞[8]。AECⅡ细胞不仅可通过Toll样受体家族(TLRs)、表面活性蛋白(SPs)和Dectin-1等调控宿主先天免疫反应,抵御外源病原菌,并可产生炎症因子、趋化因子和细胞因子等激活获得性免疫反应,募集和活化吞噬细胞至感染部位清除病原菌,是阻止结核菌入侵宿主的第一道细胞防线,在抗MTB感染免疫调节中的作用备受关注[9-10]。
目前临床常用抗结核药物主要有一线抗结核药物、二线抗结核药物、新型抗结核药物及固定剂量复方制剂[11]。一线抗结核药物主要包括异烟肼(isoniazid,INH)、利福平(rifampin,RFP)等,抗菌活性强、副作用少[12];二线类药物包括喹诺酮类、大环内酯类、氨基糖苷类、对氨基水杨酸(para-aminosalicylic acid,PAS)类等,用于治疗一线类药物不耐受及耐药性TB患者[11]。近年体内和体外试验证实,部分抗结核药物不仅具有杀菌作用,还具有免疫调节作用,如大环内酯类药物通过促进中性粒细胞活化和提高免疫细胞功能增强机体防御能力[13];INH可增强小鼠腹腔巨噬细胞酸性磷酸酶活性及吞噬能力[14];RFP在体外可强烈抑制由有丝分裂原和特异性抗原诱导的致敏和非致敏小鼠脾淋巴细胞转化,且与浓度及时间呈正相关[15]。但抗结核药物应用过程中会出现过敏反应、血液系统毒性等不良反应,是否会对机体免疫相关细胞的免疫功能,尤其是抗结核先天免疫调控功能产生影响有待进一步研究[16]。因此,本研究采用不同浓度的一线抗结核药RFP、INH和二线抗结核药硫酸阿米卡星(amikacin sulfate,AMK)、PAS处理AECⅡA549细胞,分析不同抗结核药物对A549细胞中TLRs信号通路信号分子和炎症因子表达的影响,探讨抗结核药物对AECⅡ抗结核先天免疫功能的影响,为临床TB治疗提供理论参考。
1 材料与方法
1.1 材料 人肺腺癌细胞株A549由宁夏大学西部特色生物资源保护与利用重点实验室保存提供;RFP注射液购自沈阳双鼎制药有限公司;INH注射液购自天津金耀药业有限公司;AMK注射液购自苏州第壹制药有限公司;PAS粉针剂购自贵州光正制药有限责任公司;TRIzol试剂购自美国Invitrogen公司;DMEM高糖培养基、FBS购自美国Gibco公司;反转录和qRT-PCR试剂盒均购自北京全式金生物技术有限公司;全蛋白提取试剂盒、BCA蛋白定量试剂盒和SDS-PAGE凝胶配制试剂盒购自南京凯基生物;一抗TLR2(CST#12276)、NF-κB p50(CST#135 86)和MyD88(CST#4283)购自Cell signal technology公司;一抗β-actin(TA-09)和二抗羊抗兔IgG-HRP(ZB-2301)购自北京中杉金桥;Plus-ECL化学发光试剂盒购自美国PerkinElmer;人IL-8和IL-12 p70购自美国R&D公司。
1.2 方法
1.2.1 A549细胞培养 A549细胞接种于含10%FBS和青链霉素双抗的DMEM高糖培养液中,37℃、5%CO2恒温培养,细胞密度达到70%~80%时,0.25%胰蛋白酶-EDTA消化,收集培养细胞。
1.2.2 给药方式及分组 A549细胞以4×105个/孔接种于6孔板,培养箱中培养过夜至细胞密度达到60%时,更换新鲜培养液继续培养24 h。参考各抗生素说明中的血药代谢浓度分组:Control组(只加等量溶剂)、不同浓度RFP组(1.00、5.00、10.54μg/ml),不同浓度INH组(1.00、5.00、10.00μg/ml),不同浓度AMK组(2.00、16.00、33.38μg/ml),不同浓度PAS组(10.00、100.00、213.00μg/ml)。
1.2.3 细胞总RNA提取和cDNA合成 胰蛋白酶消化处理24 h的各组细胞,PBS洗涤3次,加入TRIzol,按照TRIzol试剂说明书提取细胞总RNA,超微量分光光度计测定RNA浓度及纯度,琼脂糖凝胶电泳检测RNA完整性。将提取的总RNA反转录为cDNA,反应体系20μl:总RNA 5μg,Oligo(dT)181.0μl,2×TSReaction Mix 10μl,TransScript RT/RI Enzyme Mix 1.0μl,gDNA Remover 1.0μl,添 加RNase-free Water至20μl,42℃15min,85℃5s终止反应。
1.2.4 qRT-PCR 检测根据人TLR2、TLR4、NFκB、MyD88、IL-6、IL-8、IL-12A基因序列,通过Primer Premier 5.0软件设计引物,以β-actin为内参并设计引物,引物由上海基康生物技术有限公司合成,序列见表1。qRT-PCR反应体系20μl:cDNA 1.0μl,上下游引物(10μmol/L)1.0μl,2×Tip Green qPCRSuperMix 10μl,H2O 7μl。Quant Studio 5荧光定量PCR仪上进行qRT-PCR反应,反应条件:94℃预变性30 s,94℃变性5 s,60.8℃退火15 s,72℃延伸10 s,40个循环,2-ΔΔCt法分析数据。
1.2.5 Western blot 按照全蛋白提取试剂盒说明书提取总蛋白,BCA蛋白定量试剂盒测定蛋白浓度,根据不同蛋白相对分子质量大小配制不同浓度SDS-PAGE凝胶,取相同量蛋白样品进行电泳(恒压80 V),转膜(湿转,恒流300 mA);5%脱脂奶粉室温封闭1~2 h,加入一抗4℃孵育过夜,次日洗膜,加入二抗孵育,洗膜,化学发光试剂发光并采用化学发光检测仪成像。
1.2.6 IL-8及IL-12 ELISA检测 收集各组培养细胞上清,按照ELISA试剂盒说明书进行操作。
1.3 统计学处理 采用SPSS19.0软件进行统计学分析,所有实验重复3次,数据以±s表示,数据比较采用t检验,Graph Pad Prism7.0软件绘图。
2 结果
2.1 A549细胞培养与总RNA提取 A549细胞为贴壁生长的上皮细胞,为多角形,形态随密度变化略有差异。本实验选取对数生长期生长状态良好的细胞进行后续实验(图1)。提取各实验组处理24 h后的A549细胞总RNA,1%琼脂糖凝胶电泳检测结果见图2,各组28 S rRNA、18 S rRNA和5 S rRNA条带完整,且RNA纯度(A260/A280)为1.9~2.1,符合后续实验要求。

表1 qRT-PCR引物序列Tab.1 Primer sequences for qRT-PCR
2.2 抗结核药物对A549细胞TLRs信号通路相关分子mRNA表达的影响 RFP各浓度组TLR2和TLR4受体mRNA表达显著高于对照组(P<0.05或P<0.01),且均随浓度增加而升高。各组下游接头分子MyD88表达显著降低,转录因子NF-κBmRNA表达仅在RFP浓度为10.54μg/ml时显著降低(P<0.05),其余浓度RFP对NF-κB表达影响无统计学意义(图3A),提示RFP虽诱导较高水平的TLR2、TLR4表达,但MyD88、NF-κB表达并未被激活,反而受到抑制,总体表现为对TLRs信号通路的抑制作用。INH各剂量组TLR2、TLR4表达与对照组差异显著(P<0.01),TLR2表达与浓度呈负相关;MyD88、NF-κB表达变化与TLR2类似,与浓度呈负相关,其中INH浓度为10.00μg/ml时,MyD88表达明显降低,NF-κB表达在INH浓度为1.00μg/ml时显著升高(P<0.05,图3B),提示INH可抑制A549细胞TLR2信号通路。AMK各组A549细胞TLR2、TLR4表达显著升高(P<0.05),2.00μg/ml升高最为显著,且NF-κBmRNA表达仅在AMK浓度为2.00μg/ml时显著提高(P<0.05),但AMK处理对MyD88表达无显著影响(图3C),表明随浓度增加,AMK对TLR2、TLR4信号通路的活化作用逐渐减弱。PAS可显著提高TLR2、TLR4表达,且呈一定的浓度依赖性;MyD88和NF-κB表达仅在PAS浓度为100.00μg/ml时显著降低(P<0.05,图3D)。
图1 A549细胞生长状态(×100)Fig.1 Growth status of A549 cells(×100)
图2 提取的A549细胞总RNA琼脂糖凝胶电泳分析Fig.2 Gel electrophoresis of total RNA extracted from A549 cell
2.3 抗结核药物对A549细胞TLRs信号通路相关分子蛋白表达的影响 TLR2、MyD88和NF-κB p50蛋白表达在RFP浓度为1.00μg/ml、5.00μg/ml时均有一定增加,其中5.00μg/ml RFP组TLR2表达显著升高(P<0.05);当RFP浓度达到10.54μg/ml时,3种蛋白表达水平基本与对照组相同,NF-κBp50表达有所下调,说明高浓度RFP处理对A549细胞中TLR2信号通路有抑制作用(图4)。INH对A549细胞中TLR2和MyD88表达的影响具有一致性,但对NF-κB p50表达的影响却与前两者正好相反(图4B),表明INH可能通过其他途径实现对NF-κBp50的活化。2.00μg/ml AMK处理显著降低TLR2、MyD88表达(P<0.05),但随着AMK浓度增加,两种蛋白表达均有所提高;各浓度组NF-κB p50表达与对照组相比都有一定上调(图4C),提示AMK可激活A549细胞中TLR2信号通路。TLR2、MyD88表达在PAS各浓度组均高于对照组,NF-κB p50表达随PAS浓度增加而升高,说明PAS可活化A549细胞中TLR2信号通路(图4D)。

图3 抗结核药物对A549细胞TLRs信号通路相关分子mRNA表达的影响Fig.3 Effect of anti-tuberculosis drugs on mRNA expression of signal molecules in TLRs signaling pathway in A549 cells
2.4 抗结核药物对A549细胞IL-8、IL-12amRNA表达的影响 随RFP处理浓度增加,IL-8表达变化无统计学意义,IL-12amRNA表达显著降低(P<0.05),3个浓度组差异无统计学意义(图5A)。INH各浓度组IL-8、IL-12a表达显著高于对照组(P<0.05或P<0.01),5.00μg/ml时变化最为显著(图5B)。AMK处理对IL-8表达无显著影响,但各实验组IL-8表达与浓度呈负相关,仅2.00μg/ml AMK处理对IL-12amRNA表达有显著上调作用(P<0.05),其余2组IL-12a表达变化无统计学意义。AMK各浓度组IL-12a表达同样与浓度呈负相关(图5C),仅100.00μg/ml PAS组A549细胞IL-8、IL-12amRNA表达显著上调(P<0.05,图5D),表明4种抗结核药物作用于A549细胞后,仅RFP对炎症因子IL-12a表达有抑制作用,其余各抗结核药物对炎症因子IL-8和IL-12amRNA表达影响无统计学意义。
2.5 ELISA法测定IL-8、IL-12含量 随RFP浓度增加,IL-8含量下降;与对照组相比,1.00μg/ml RFP组IL-12含量显著升高(P<0.05),而5.00μg/ml RFP组IL-12含量却显著降低(P<0.05),10.54μg/ml RFP组IL-12含量变化无统计学意义(图6A),表明RFP在一定程度上抑制A549细胞中IL-8、IL-12产生。INH可不同程度提高IL-8及IL-12含量,5.00μg/ml时作用最强(P<0.05,图6B)。AMK处理A549细胞,IL-8含量在2.00μg/ml、16.00μg/ml时显著增加(P<0.01),33.38μg/ml AMK组IL-8含量与对照组差异无统计学意义;当AMK浓度为2.00μg/ml时,IL-12含量变化无统计学意义,AMK浓度为16.00μg/ml、33.38μg/ml时,IL-12含量显著降低(P<0.01,图6C),提示AMK对A549细胞炎症因子分泌的抑制作用具有剂量依赖性。与对照组相比,PAS各浓度组A549细胞IL-8、IL-12含量明显上升(P<0.01),IL-12含量与剂量呈负相关(图6D)。
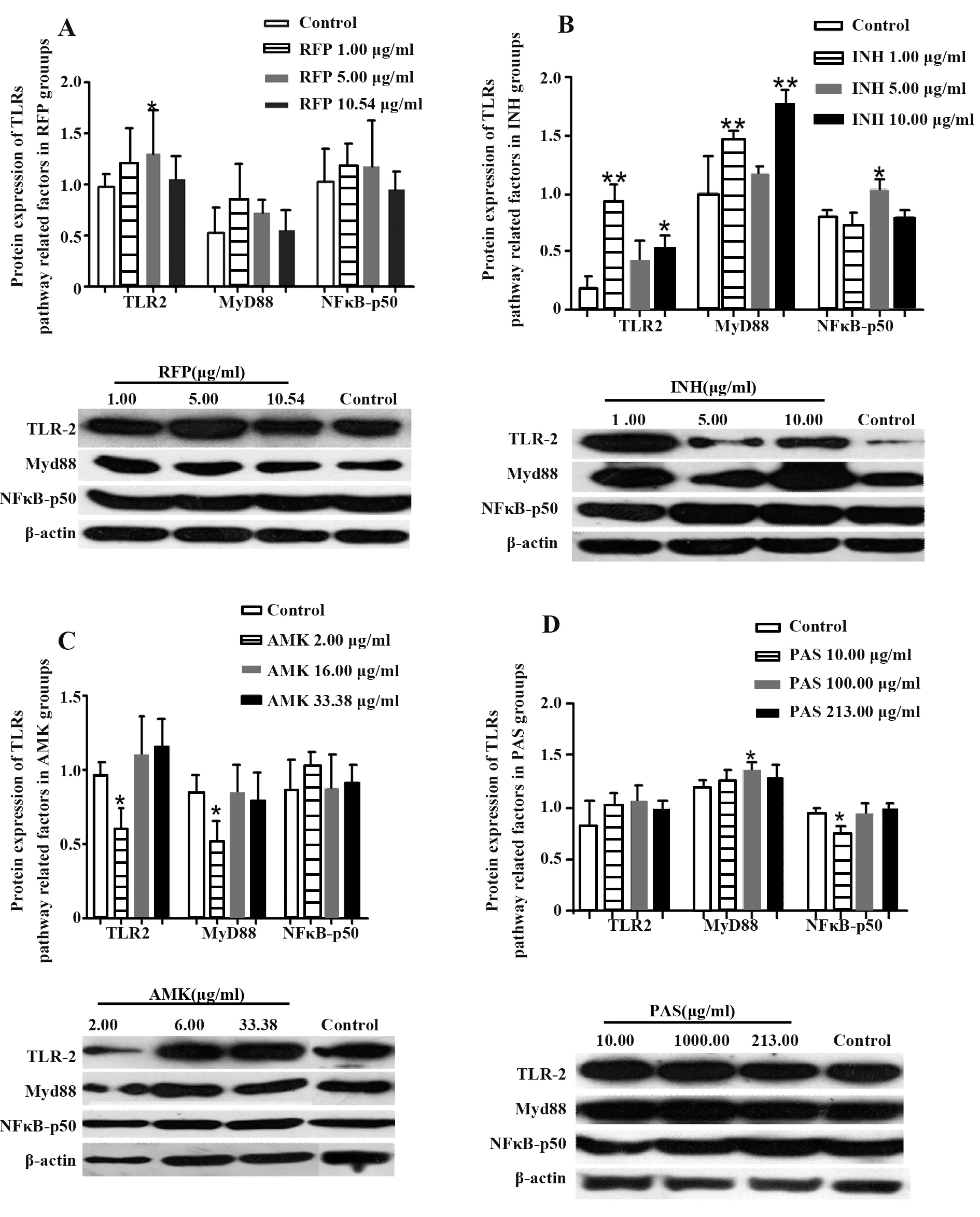
图4 抗结核药物对A549细胞中TLRs信号通路相关分子蛋白表达的影响Fig.4 Effect of anti-tuberculosis drugs on protein expressions of signal molecules in TLRs signaling pathway in A549 cells
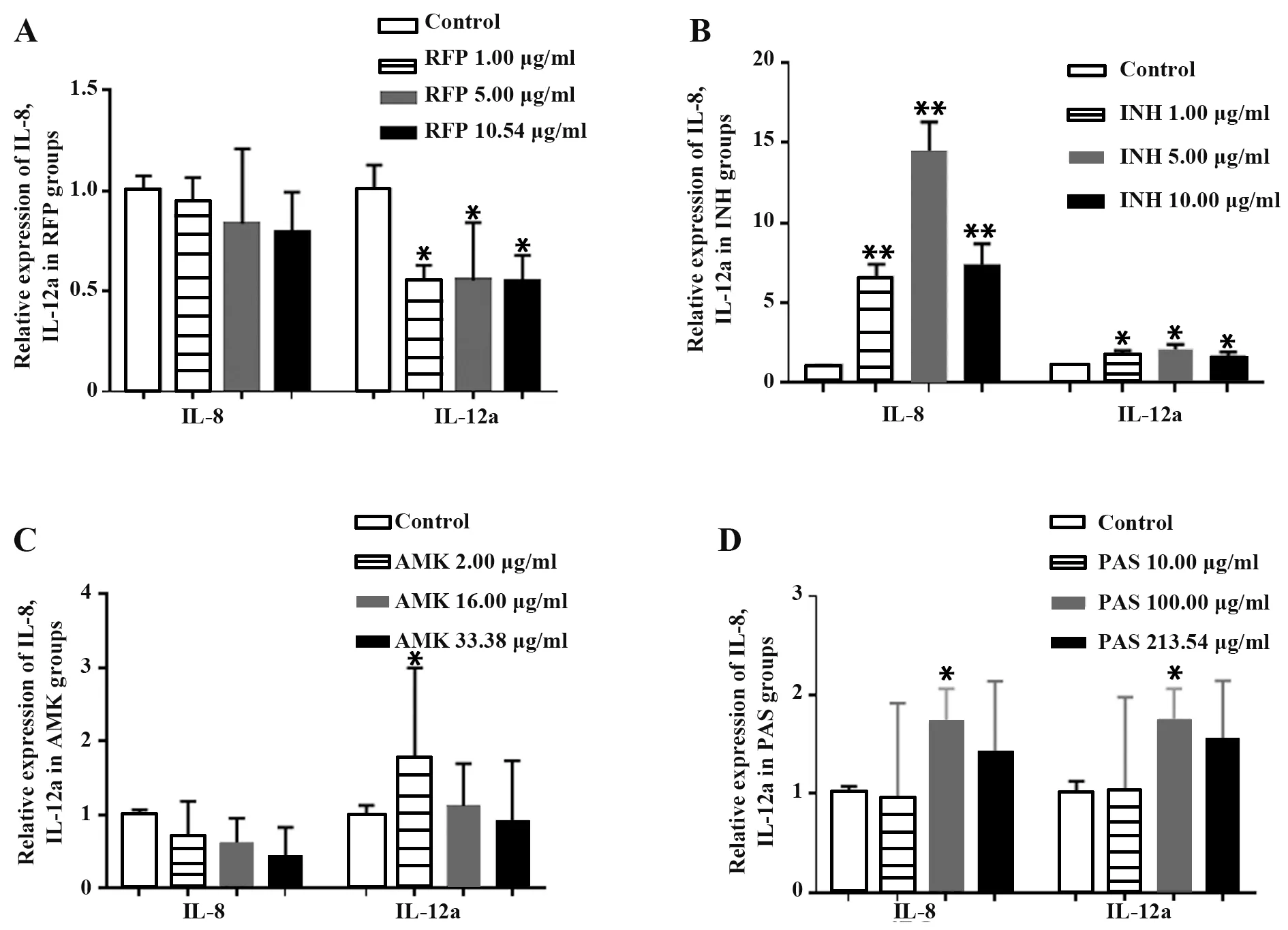
图5 抗结核药物对A549细胞IL-8、IL-12a mRNA表达的影响Fig.5 Effect of anti-tuberculosis drugs on expressions of IL-8 and IL-12a mRNA of A549 cells
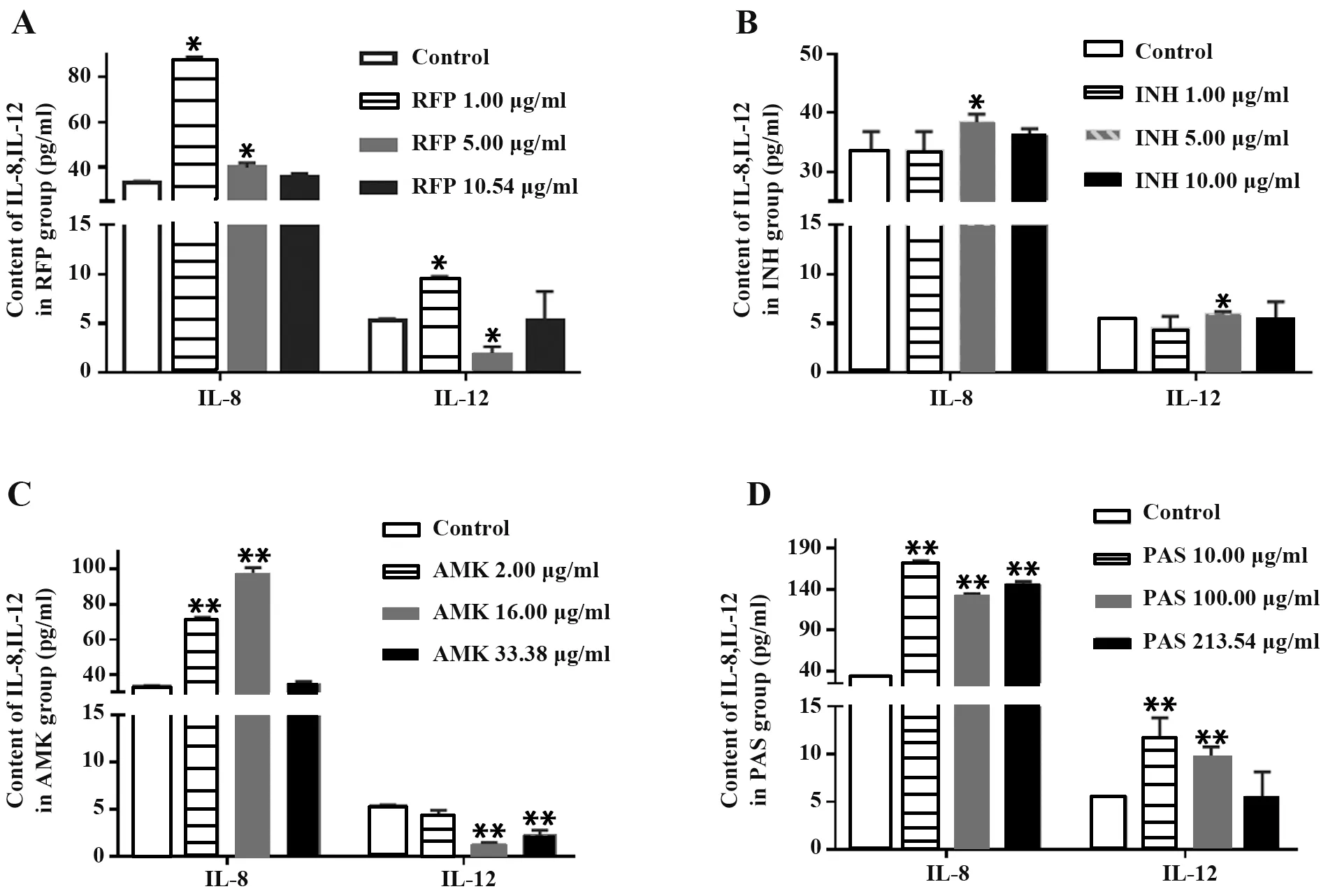
图6 抗结核药物对A549细胞IL-8、IL-12分泌的影响Fig.6 Effect of anti-tuberculosis drugs on IL-8 and IL-12 production in A549 cells
3 讨论
近年耐药尤其是耐多药TB流行呈逐年上升趋势,而结核药物研发相对较慢,导致TB治疗形势日趋严峻。随着研究深入,除对现有抗结核药物的抗菌机制有了更全面透彻地认识外,还发现部分抗结核药物具有免疫调节作用。抗结核药物的免疫调节作用呈双向性,部分药物可改善宿主免疫功能,协同抗菌作用,但部分药物却表现出免疫抑制效应[17]。因此,深入了解抗结核药物的免疫调节作用,与抗菌活性相结合,将为TB临床治疗提供理论参考。课题组研究了具有代表性的一线抗结核药物RFP、INH及二线抗结核药物AMK、PAS对A549细胞TLRs通路相关信号分子和炎症细胞因子表达的影响,其中,RFP是利福霉素衍生物,是最有效的抗结核抗生素之一[15];INH抗菌活性较强,可有效杀灭细胞内外MTB,是目前TB治疗的首选药物[12];AMK常与INH、RFP等联用,是肺结核治疗的二线注射首选药物[18];PAS是继链霉素之后发现的第二种TB治疗药物。
TLRs是由先天免疫系统细胞表达的一种跨膜蛋白,与机体免疫和炎症反应密切相关,是连接天然免疫和获得性免疫的桥梁,在机体抵抗病原微生物免疫反应中扮演重要角色[19-21]。机体感染MTB后会激活TLRs信号通路,TLR2、TLR4和TLR9是机体抗MTB的主要炎症受体[21]。活化的TLRs可促进炎症因子、趋化因子、黏附分子及其受体等多种靶基因转录与表达,引发炎症反应[22]。既往研究表明,AECⅡ通过TLR2/TLR4二聚体识别MTB[23]。本试验qRT-PCR结果也显示TLR2和TLR4的mRNA表达变化趋势基本一致。本研究采用RFP处理AECⅡ,当浓度达为10.54μg/ml时,可抑制A549细胞TLRs受体信号通路活化。INH干预虽对A549细胞TLR2和MyD88表达的影响一致,但对NF-κB表达的影响与前两者相反,即TLR2和MyD88表达降低的同时NF-κB表达升高,表明INH抑制TLR2信号通路的同时,可经TLR4通过MyD88非依赖性通路活化NF-κB。MyD88非依赖通路可调控树突状细胞成熟及免疫调节因子(如MHC、CD4+等)表达调节获得性免疫反应[21]。因此,INH可能具有增强机体免疫功能的作用,与既往研究结论一致。INH可通过提高大鼠外周血CD3+T细胞、CD4+T细胞比例及CD4+/CD8+比值有效增强免疫功能[24]。毛泽善等[14]发现INH可增强小鼠非特异性免疫功能。两种二线抗结核药物AMK、PAS均可上调TLR2、TLR4、MyD88和NF-κB表达,表明AMK、PAS可激活A549细胞TLR2、TLR4信号通路。
炎症细胞因子表达水平可反映局部炎症损伤程度。适量细胞因子分泌有利于机体清除病原体,但过度分泌可能导致炎症失控及加重局部组织损伤[25]。IL-8是趋化性细胞因子,其主要功能是趋化中性粒细胞、T淋巴细胞等多种免疫细胞至感染部位吞噬、杀伤病原菌,并进一步导致细胞脱颗粒,引发呼吸爆发等;此外,炎症反应早期始发因子通过激活其他炎症细胞因子引起炎症反应[26]。IL-8参与慢性支气管炎、胃溃疡、胰腺炎等炎症性疾病发生、发展和预后过程中,在感染控制及病理损伤形成中起重要作用。IL-12作为一种多功能细胞因子,被认为是调节免疫反应最重要的细胞因子之一,在机体抗MTB感染过程中,可诱导Th0向Th1分化,并维持Th1效应功能,刺激NK细胞、巨噬细胞和中性粒细胞增殖并提高其靶细胞杀伤活性,此外还是IFN-γ分泌的强诱导剂,是天然免疫和获得免疫的调节因子[27-33]。从炎症细胞因子mRNA表达和分泌情况来看,随RFP浓度增加,IL-8、IL-12表达、分泌均有一定程度的降低,对IL-12的影响最为显著。表明RFP可通过抑制TLRs信号通路降低炎症因子表达,具有免疫抑制功能,与RFP可有效降低复治涂阳肺结核患者机体TNF-α、CRP、IL-6、IL-10等炎症因子水平、促进机体免疫功能恢复的研究结论一致[34]。因此,RFP在减轻局部炎症反应强度、减轻组织损伤方面起重要作用。INH可不同程度提高IL-8及IL-12表达与分泌,5.00μg/ml时效果最强,说明INH具有免疫激活作用。感染引起的机体炎症反应是一把“双刃剑”,适当调节可协助机体杀灭MTB,调节不当则会导致机体组织损伤[33]。因此,采用INH治疗TB时,为减轻炎症反应,可与具有抑制炎症因子表达作用的抗结核药物联用,也从免疫调节作用的角度,解释了为何INH与RFP联用是目前公认的最佳治疗方法。随AMK浓度增加,IL-8、IL-12 mRNA表达及分泌先升高后降低,说明AMK在激活TLRs信号通路促进IL-8、IL-12产生的同时,还通过其他途径调控炎症因子表达,从而抑制炎症反应,即AMK存在免疫激活和免疫抑制两方面作用。AMK为第三代氨基糖苷类抗生素,关于氨基糖苷类抗生素免疫调节作用的报道存在免疫激活和免疫抑制两方面,如庆大霉素既可抑制CD3+、CD56+、CD8+等免疫细胞数量,起免疫抑制作用,又可通过抑制中性粒细胞的凋亡提高机体免疫功能[35-36]。蔡少华等[37]研究证实AMK具有免疫抑制作用,但AMK通过何种信号转导通路抑制炎症因子合成有待进一步研究。PAS可促进IL-8和IL-12表达与分泌,具有免疫激活功能,但随浓度增加,免疫激活作用减弱,IL-12含量降低,提示PAS的免疫调节作用可能具有多重性。PAS为磺胺类抗菌药物及其增效剂,磺胺类药物属于抑制免疫功能的抗菌药物,但多呈现出对中性粒细胞吞噬作用的抑制作用,如在炎症性肠病研究中发现PAS对黏膜IL-1β合成与释放无影响[38]。本研究中PAS呈现免疫激活作用。目前对PAS的研究较少,其对机体免疫功能的影响及机制有待进一步研究。
综上所述,4种抗结核药物对AECⅡA549细胞的免疫功能具有一定影响。RFP通过抑制TLRs信号通路降低炎症因子表达,减轻炎症反应;INH可通过激活MyD88非依赖性通路促进炎症反应及增强免疫功能;AMK在激活TLRs通路的同时,又通过其他通路抑制炎症因子表达,呈现出免疫调节功能的多重性;PAS可激活TLRs信号通路促进IL-8、IL-12表达,促进A549细胞免疫应答,为TB临床治疗提供了理论参考。