外周血淋巴细胞染色体G显带制备方案优化研究*
谢晓贞,陈 颖,杜 涛,张嘉宁,吕杰忠,吴夏龙,彭玉婷,李慧妍,林丽婷
中山大学孙逸仙纪念医院产前诊断中心,广东广州 510120
自MOORHEAD等[1]在1960年建立人外周血淋巴细胞培养技术后,外周血染色体检测已成为细胞遗传学研究的重要基础,染色体G显带长度和带型丰富程度成为诊断染色体结构异常的关键。常规染色体培养技术存在过程操作繁琐、技术要求高、耗时费力、显带不理想、分辨率不高等问题[2],鉴于此,本研究在以往学者的基础上,将已经比较稳定、成熟的一管法、同步法、一管法+同步法联合使用,以期弥补常规方法的不足,以期获得更理想的结果。
1 资料与方法
1.1一般资料 随机选取2018年12月至2020年6月在本院就诊的100例(包含成人与婴幼儿)患者作为研究对象,采集静脉血检测。每份标本同时采用常规法、一管法、常规法+同步法、一管法+同步法4种方法进行比较。
1.2仪器与试剂 Chromosome Dispersion System染色体分散仪、Leica Cytovision GSL station自动扫描显微镜和图像分析系统、二氧化碳培养箱、淋巴细胞培养瓶、RPMI1640培养管、细胞预处理试剂盒、秋水仙碱20 μg/mL、胰酶。
1.3细胞接种+培养 分别将0.5 mL肝素钠抗凝血无菌接种于编号1(常规法)、编号2(一管法)、编号3(常规瓶法+同步法)、编号4(一管法+同步法)的培养瓶/管中,每组接种1支,摇匀后放入37 ℃培养箱。
1.4分组
1.4.1常规法 常规培养72 h,加入20 μg/mL秋水仙碱25 μL,作用2.5 h取出,将血液标本转移到编号1的离心管中并离心。
1.4.2一管法 常规培养72 h,加入20 μg/mL秋水仙碱25 μL,作用2.5 h取出后直接离心,不需要开瓶盖和转移血液标本。
1.4.3常规法+同步法 培养48 h后,无菌条件下加入细胞预处理试剂盒中CS-A试剂100 μL并摇匀,静置培养17 h后,在无菌条件下加入CS-B试剂并摇匀,静置5 h后加入秋水仙碱作用2.5 h取出,将血液标本转移到编号3的离心管中并离心。
1.4.4一管法+同步法 培养48 h后,无菌条件下加入细胞预处理试剂盒中CS-A试剂100 μL并摇匀,静置培养17 h后,在无菌条件下加入CS-B试剂并摇匀,静置5 h后加入秋水仙碱作用2.5 h,取出后直接离心,不需要开瓶盖和转移血液标本。
1.5细胞收获与制片 经常规低渗、预固定、固定、制片、吉姆萨染色,全自动染色体扫描仪选取、拍摄核型,按《人类细胞遗传学国际命名体制ISCN(2016)》分析和诊断染色体核型。每组每份常规制作2张玻片。
1.6观察指标
1.6.1有丝分裂指数 每份标本计数200个细胞(含M期细胞),分别计数分裂期和非分裂期细胞,计算细胞分裂指数。细胞分裂指数=分裂期细胞数/全部细胞数×100%。
1.6.2G显带≥320带可供分析中期分裂相 工作站扫片后统计,每张玻片观察100个分裂相,计数≥320带染色体中期分裂相数目,以及不同显带细胞数所占比例。质量评价条带的选取:参照《人类细胞遗传学国际命名体制ISCN2016》Fig.5所示的染色体核型示意图选取12条质评条带,质评条带可见最低分辨率以400和550条带水平为主[3]。对同一标本的核型分析及质量评价均由固定的2名专业技术人员完成。
1.6.3收获细胞数 以可制片数量评价。
1.6.4培养成功率 存在20个可供计数染色体核型,5个以上可供分析核型。
1.7统计学处理 采用SPSS17.0统计软件进行数据分析处理。计数资料以例数或百分率表示,采用χ2检验进行比较。以P<0.05为差异有统计学意义。
2 结 果
2.14种检测方法有丝分裂指数、收获细胞数、培养成功率比较 一管法、常规法+同步法、一管法+同步法有丝分裂指数、收获细胞数、培养成功率与常规法比较,差异均无统计学意义(P>0.05),见表1。
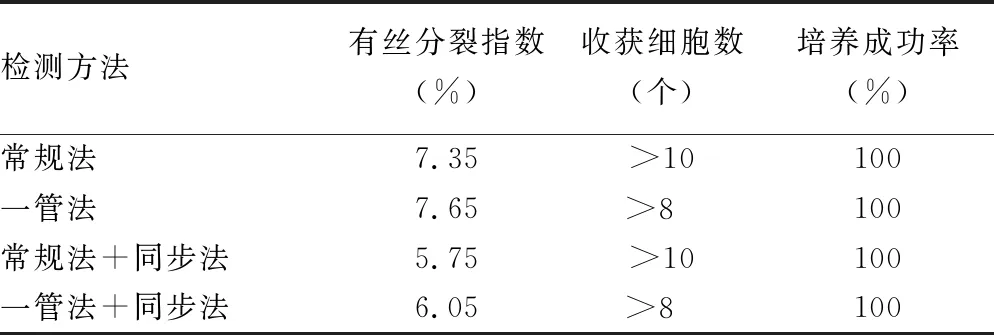
表1 4种检测方法细胞有丝分裂指数、可制片数量和成功率比较
2.2中期分裂相比较 一管法与常规法显带细胞数量和质量比较,差异均无统计学意义(P>0.05);常规法+同步法G显带≥320带的染色体中期分裂相数目均数较常规法明显增加,>400~550带核型占比达到51.1%,并且发现23.9%的>550带的高分辨率核型,与常规法以上项目比较,差异也均有统计学意义(P<0.05);一管法+同步法与常规法以上项目比较,差异均有统计学意义(P<0.05)。见图1、表2。

注:组1为常规法G显带核型图;组2为一管法G显带核型图;组3为常规法+同步法G显带核型图; 组4为一管法+同步法G显带核型图。图1 示例6染色体核型

表2 4种检测方法获得G显带≥320带染色体分析
3 讨 论
3.1人外周血淋巴细胞培养+染色体核型分析是细胞遗传学研究的重要手段 染色体核型分析结果的准确性取决于染色体的质量、显带及染色体的长度。染色体越长,带纹越丰富,分辨率越高。因此,本研究对目前外周血染色体G显带制备方法进行优化,以期获得质量更高的制备外周血染色体的方法。
3.2传统淋巴细胞培养 传统淋巴细胞培养是在有铝盖的玻璃瓶中进行,收获时需用工具撬开铝盖,方能将标本转移到做好标记的离心管中。在此过程中,撬开瓶盖的过程费时、费力,且容易造成工作人员损伤,转移过程还有可能导致标本混淆,造成医疗差错。因此,选用一管法代替常规法,省去开盖的步骤,不需要转移培养液,杜绝了这些步骤潜在的风险,可简化过程,提高效率[4-5]。同时,本研究对一管法与常规法在有丝分裂指数、G显带≥320带染色体中期分裂相数目、收获细胞数、培养成功率等进行比较,差异均无统计学意义(P>0.05),说明一管法能够获得稳定、理想的染色体结果。
3.3外周血染色体常规制备法 G显带标准为320~400条带,但常常会造成一些异常结构的误诊和漏诊[6]。
高分辨率染色体正中期显示400条带,早中期显示400~550条带,前中期显示550~800条带,晚前期显示850~1 250条带。虽然带纹越多越有利于进行遗传学分析,但带纹越长操作越繁琐,染色体交叉越多,也难以辨识。按照国际标准分析,500~550条带的染色体核型已能满足常规临床应用。
要尽可能多地获得显带条数多、交叉较少的染色体,需要有较多分裂相及大量处于细胞分裂早中期的细胞,这在普通培养条件下难以实现。已经有兄弟单位摸索出同步化方法处理后,使大量细胞处于分裂早期,就可以根据实验需要获得不同显带标准的染色体,使大多数分裂相均为500条带左右,但又不至于过长[7]。目前这一方法愈发成熟,并且已商品化。
本研究使用的是已商品化的细胞预处理试剂盒,分为CS-A和CS-B两种试剂,CS-A主要包含胸腺嘧啶核苷,其可逆地抑制DNA合成,将大多数细胞同步于S、G1/S期的边界。CS-B主要包含脱氧胞苷,加入CS-B后,CS-A阻滞释放,细胞同步进行有丝分裂,在适当的时候加入秋水仙碱,可获得早中期分裂相。
常规染色体制备,仅通过秋水仙碱处理,无法获得足够的G显带达到500条带的染色体核型。用同步化方法制备染色体,不仅获得了足够的500条带甚至550条带以上的G显带染色体,而且制备出的染色体条带清晰,外形完整。
本研究发现,一管法、同步法均已经相当稳定、成熟,因此,如果在染色体制备中采用一管法和同步法联合使用,既不互相干扰,又可获得二者的优势,可以在临床实践中推广使用。