非黄斑裂孔性视网膜脱离术后黄斑区血流及结构的改变分析曾思雨
杜磊 邢怡桥
视网膜脱离是指色素上皮层与神经上皮层的分离,发病率约为1/10000,由于视网膜脱离严重威胁视力,因此需要及时进行手术治疗,玻璃体切除术(pars plana vitrectomy, PPV)是目前主流的手术方式,术后视网膜复位成功率约为90%,但在解剖层面成功修复后患者的长期视力结果是不同的,尤其是累及黄斑的患者,视力预后往往不理想[1,2]。本研究主要探讨非黄斑裂孔性视网膜脱离患者行玻璃体切除术后黄斑区血流及结构与视力的改变,报道如下。
资料与方法
一、一般资料
收集2019年1月至2020年1月于本院确诊视网膜脱离患者36例(36只眼)纳入研究(PPV组),患者的对侧眼作为对照组。纳入标准:(1)初次发病,经眼部B型超声、眼底照相、相干光层析成像术(optical coherence tomography,OCT)检查确诊非黄斑裂孔性视网膜脱离;(2)双眼等效球镜度数介于-3~+3 D;(3)双眼眼轴在21~27 mm内。排除标准:(1)合并其他眼科疾病,如玻璃体积血、糖尿病视网膜病变、青光眼、白内障、葡萄膜炎等;(2)既往眼部外伤史及眼科手术史;(3)合并严重的全身性疾病。患者的对侧眼作为对照组。本研究遵循赫尔辛基宣言,通过了本院伦理委员会批准,所有入选者均签署了知情同意书。
二、手术方法
常规球后麻醉。23 g巩膜穿刺刀在距角膜缘后3.5 mm作鼻上、颞上、颞下方位巩膜穿刺口, 分别置入光纤、灌注头及玻切头。切除玻璃体,注入重水,展平视网膜。裂孔处视情况行视网膜激光光凝、冷冻。气液交换后均注入硅油。术毕,妥布霉素地塞米松眼膏加压包敷术眼。手术均由同一有经验医师完成,过程顺利。嘱患者术后俯卧位1个月,保持裂孔位置处于最高位。术后3个月取出硅油。
三、观察指标
PPV组术前及术后1周、1个月、3个月、6个月及对照组均接受全面的眼科检查:(1)电脑自动验光后由有经验的验光师行主觉验光,测量最佳矫正视力(best corrected visual acuity,BCVA)并将所获得的标准对数视力转换成log MAR视力进行统计学分析;(2)裂隙灯检查眼前节;(3)散瞳眼底检查;(4)检查眼压;(5)相干光层析血管成像术(optical coherence tomography angiography,OCTA)检查:同一熟练操作者使用Angio Vue(Optovue,Fremont,美国)仪器,选择Angio Retina QuickVue 3 mm×3 mm模式,系统自动通过运动矫正原理矫正眼球扫视和细小固视丢失引起的运动伪迹,最终可自动生成视网膜黄斑中心凹结构图及血流成像图,观察视网膜椭圆体带的完整性,内置软件自动测量出视网膜全层厚度(full thickness,FT)即内界膜到色素上皮层的厚度。使用ImageJ软件分析血流成像图,计算指定区域内血管面积所占比例,即血流密度,浅层视网膜血流密度(superficial vessel density,SVD)为内界膜下方3 μm至内丛状层下方15 μm,深层视网膜血流密度(deep vessel density,DVD)为内丛状层下方>15 μm至外丛状层下方70 μm。
四、统计学分析方法
采用SPSS 25.0统计学软件分析处理数据。计数资料表示为数字或者百分比,采用卡方检验进行比较;计量资料以均值±标准差表示,术后BCVA比较采用重复测量方差分析,各时间点的组间差异比较采用独立样本t检验。P<0.05为差异具有统计学意义。
结 果
一、患者基本资料
本研究最终纳入研究者36例(36只眼)。其中男性19例(52.78%),女性17例(47.22%);年龄(43.08±11.76)岁;视网膜脱离时间(13.89±13.04)天。PPV组和对照组眼压分别为(14.98±1.97)mmHg(1 mmHg=0.133 kPa)、(15.07±2.00)mmHg,差异无统计学意义(t=0.178,P=0.859)。PPV组和对照组眼轴长度分别为(23.18±1.05)mm、(23.27±1.01)mm,差异无统计学意义(t=0.339,P=0.736)。
二、BCVA与椭圆体带的完整性
随着随访时间延长,PPV组患者术后BCVA逐渐改善,术后6个月与术后1周相比,BCVA差异有统计学意义(P<0.05)。见表1。

表1 PPV组BCVA及椭圆体断裂改变
术后各个时期,椭圆体带断裂者和椭圆体带完整者的BCVA见表4,椭圆体带断裂者与椭圆体带完整者相比,术后1周(t=4.653,P<0.05)、术后1个月(t=6.185,P<0.05)、术后3个月(t=7.973,P<0.05)及术后6个月(t=11.280,P<0.05)BCVA差异均具有统计学意义。见表2。
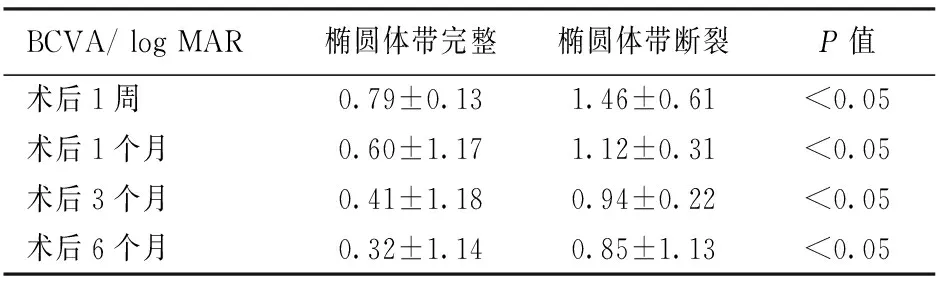
表2 椭圆体带完整者与断裂者的BCVA比较
三、视网膜厚度
与对照组相比,PPV组患者术后1周时FT显著增加(t=5.920,P<0.05),术后1个月时FT显著降低(t=6.083,P<0.05),术后1个月到术后6个月,FT逐渐增加,术后3个月时FT仍显著低于对照组(t=3.309,P<0.05),术后6个月时FT与对照组相比差异无统计学意义(t=0.768,P=0.445)。见表3。
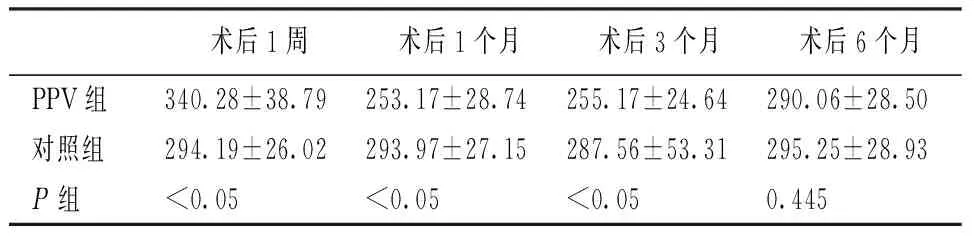
表3 PPV组与对照组FT比较(μm)
四、视网膜血流密度
与对照组相比,PPV组患者术后1周时SVD(t=8.678,P<0.05)、DVD(t=11.386,P<0.05)显著降低,随着随访时间延长,SVD、DVD逐渐增加,术后6个月时,SVD(t=2.016,P<0.05)、DVD(t=2.042,P<0.05)与对照组相比差异有统计学意义。见表4,5。

表4 PPV组与对照组SVD比较(%)

表5 PPV组与对照组DVD比较(%)
讨 论
视网膜脱离手术成功后视力恢复不佳的原因有很多,大量研究发现,视网膜脱离导致的黄斑囊性水肿和脱离的持续时间对预后有一定影响,术前视力、黄斑区是否存在裂孔以及术后出现的黄斑前膜、视网膜下液等也是重要影响因素,然而,相当数量的患者尽管没有上述影响因素,术后视力仍然很差[3,4]。
OCTA以快递、非侵入性的方式采集视网膜不同层次血流灌注的高分辨率图像,同时使黄斑中心凹微结构可视化,特别是在椭圆体带的水平上[4,5],便于我们分析视网膜脱离患者手术前后黄斑区血流及结构的变化情况。椭圆体带是光感受器所在的重要区域,位于光感受器的内/外节段(inner sensory layer/outer sensory layer, IS/OS)连接处,椭圆体带的完整性与视觉结果高度相关,是最适合评估光感受器损伤的结构[1]。许多研究已经证实视网膜脱离后OS与色素上皮层的机械性分离导致OS受损,立即发生OS的退化和长度缩短,随后不久就会导致光感受器细胞凋亡,在长时间的视网膜脱离状态下,光感受器的萎缩是不可逆的,但在较短时间内,光感受器萎缩可以停止或逆转[5]。本研究结果显示,即使患者术前均无黄斑裂孔,术后1周时,18只眼(50%)存在椭圆体带断裂;术后12个月时,椭圆体带断裂者降低至13只眼(36.1%)。光感受器功能随着时间逐渐修复,断裂的椭圆体带可以恢复完整,但是仍有部分患者椭圆体带断裂,考虑到可能与视网膜脱离时间过久有关。
本研究发现:PPV组患者术后BCVA随着时间延长逐渐改善,在术后的各个时期,椭圆体带断裂者BCVA均较椭圆体完整者差,说明椭圆体带的完整性与术后视觉结果的恢复显著相关,这与Tsilimbaris等[3]的研究发现一致,椭圆体带断裂与术后视力预后不佳有很强的相关性,而椭圆体带断裂与手术次数、视网膜切开术、术后发生其他黄斑部病变高度相关。Wakabayashi等[5]使用OCT评估了视网膜脱离患者黄斑区的微观结构变化,在完成视网膜解剖学复位的38只眼中,有23只眼出现了椭圆体带断裂,椭圆体带的完整性是术后视力的重要预测因素。而Delolme等[6]的研究发现视网膜脱离术后53.3%的患者发生椭圆体带断裂,但是与BCVA无明显相关性,而是与黄斑敏感度降低、OS变薄有关。
视网膜微循环系统包括视网膜毛细血管网和脉络膜毛细血管网,浅层视网膜血管丛和深层视网膜血管丛主要分布在神经节细胞层和内核层,它们为视网膜内层提供营养,并带走新陈代谢产物;视网膜外层无血管区则由脉络膜毛细血管提供营养和氧气[7]。在视网膜附着状态下,光感受器代谢所需要的氧大部分来自于脉络膜提供;然而当视网膜脱离时,由于脉络膜氧分压显著降低,光感受器更多地依赖于深层视网膜血液循环供氧[8]。同时因为视网膜脱离时视网膜张力的丧失,深层视网膜血流速度下降进而血供不足,导致神经节细胞缺血缺氧发生变性凋亡,导致视网膜功能永久性的损害[9]。本研究中, PPV组患者术后1周时均发生不同程度的黄斑水肿,FT显著增加,而SVD、DVD显著降低;术后1个月到术后6个月,FT、SVD及DVD随时间延长逐渐增加,术后6个月时FT恢复正常,SVD、DVD仍低于对照组。这与以往研究结果一致,视网膜脱离患者即使手术成功复位后,黄斑血流灌注也会显著减少,术后随时间延长血流密度逐渐增加,但完全恢复需要6个月甚至更长的时间[10]。其可能机制包括:视网膜机械性分离造成的缺血缺氧、手术复位过程、术后眼压波动、眼内填充硅油对视网膜产生机械压迫及毒性作用等,以上因素均会一定程度上影响视网膜结构和功能[11]。
本研究的不足之处在于纳入研究的患者数量不够多、随访时间较短,尚需进一步的大范围、大样本研究。因为本研究是使用ImageJ软件手动计算视网膜血流密度,可能会导致所得数据存在一定误差。
综上所述,本研究结果表明,非黄斑裂孔性视网膜脱离的患者即使手术成功修复,术后也有可能发生椭圆体带断裂、视网膜血流灌注减少,而椭圆体带的完整性与视力预后均存在显著的相关性,观察术后黄斑区血流及结构的动态改变,可为将来实施改善视功能的干预治疗提供临床参考。

