miR-299-5p在前列腺癌中的表达及对细胞生物行为学的影响
李正平 翟高杰(青海省第四人民医院泌尿外科,西宁810000)
前列腺癌是中老年男性常见的恶性肿瘤,全球 范围内前列腺癌在中老年男性恶性肿瘤中发病率位居第二位,死亡率高居第五位。前列腺癌早期症状不明显,患者多不知情,一经发现,多数已产生骨转移[1-3]。miRNA在细胞恶性转化过程中发挥重要作用,是潜在的肿瘤标志物[4]。miR-299-5p在非小细胞肺癌等多种恶性肿瘤中低表达,发挥抑癌基因作用,但其在前列腺癌中表达研究较少[5-7]。因此本研究通过探讨miR-299-5p在前列腺癌中的表达情况并分析其对前列腺癌细胞生物学行为的影响,以期为前列腺癌靶向治疗提供新的依据。
1 材料与方法
1.1 材料
1.1.1 组织标本与细胞 收集2016年8月至2018年10月期间本院泌尿外科手术后存档的前列腺癌组织及对应的癌旁组织标本各42例,年龄48~75岁,平均年龄(64.5±5.8)岁。所有患者资料完整,且经过病理证实,所选样本立体后即刻放入液氮罐中保存,样本采集均经患者及直系家属同意。其中预后良好51例,为治疗后临床症状缓解、病灶无进展的患者,预后不良25例,为治疗后临床症状为缓解或病灶有进展患者。人前列腺癌PC-3细胞(CL-0185)购自武汉普诺赛生命科技有限公司。本研究经医学伦理委员会批准。
1.1.2 主要试剂与仪器 10%胎牛血清、RP⁃MI1640培养基、胰酶购自美国Gibco公司;TRIzol抽提试剂、RNA提取试剂盒、逆转录试剂盒、BCA试剂盒购自BioRad公司;Lipofectamine 2000转染试剂(11668019)购自美国Invitrogen公司;miR-299-5p mimics、miR-299-5p NC购自南京锐真生物技术有限公司;CCK-8试剂盒(GK10001)购自美国GLPBIO公司;Annexin V-FITC/PI细胞凋亡检测试剂盒(40302ES20)购自上海翊圣生物科技有限公司;Transwell相关试剂购自美国BD公司;鼠抗人一抗Ki67(14-5698-82)、Bax(MA5-13994)、Bcl-2(13-8800)、N-cadherin(33-3900)、E-cadherin(33-4000)、GAPDH(TAB1001)、辣根过氧化物酶标记的山羊抗鼠(31430)购自美国Invitrogen公司。
1.2 方法
1.2.1 qRT-PCR检测前列腺癌组织及癌旁组织中miR-299-5p表达 样本从液氮罐中取出,解冻后按照RNA提取试剂盒的操作说明术提取前列腺组织及其癌旁组织中总RNA,通过逆转录试剂盒将1µg RNA样本反转录为cDNA,qRT-PCR仪检测miR-299-5p表达水平。引物序列见表1。PCR反应条件为:95℃预热5 min,95℃30 s,55℃30 s,72℃20 s,循环40次,以U6为内参基因,通过2-ΔΔCt法计算miR-299-5p相对表达量。
1.2.2 PC-3细胞培养 从液氮罐中取出人前列腺癌PC-3细胞,在37℃水浴中快速溶解,溶解后在37℃、5%CO2饱和湿度培养箱中用含10%胎牛血清的RPMI1640培养液中培养,传代3次后,收集对数期细胞用于实验。
1.2.3 细胞转染 选取1.2.2中对数生长期的PC-3细胞,按照2×105个/孔密度接种于24孔培养板中,按照Lipofectamine 2000转染试剂盒说明书进行转染,分别加入miR-299-5p NC(miR-299-5p NC组)和miR-299-5p mimics(miR-299-5p mimics组)与4µl Lipofectamin 2000试剂混合,静置后加入培养孔,未经处理的PC-3细胞为空白组。转染后48 h收集细胞,提取总RNA及总蛋白供后续使用。
1.2.4 CCK-8法检测PC-3细胞增殖 收集1.2.2中各组细胞,分别培养24 h、48 h、72 h,每组设6个复孔,加入10µl CCK-8溶液,培养4 h后用酶联免疫检测仪测定各孔吸光值,以只加培养基孔的OD值为空白对照调零,计算细胞增殖抑制率。细胞增殖抑制率=[1-(处理组OD值/未处理组OD值)]×100%。
1.2.5 流式细胞法检测PC-3细胞凋亡 收集1.2.2中转染细胞,经预冷的磷酸盐缓冲液(PBS)洗涤细胞,调整细胞密度为1×106个/ml,通过Annexin V-FITC/PI凋亡试剂盒检测细胞凋亡情况,计算细胞凋亡率。
1.2.6 Transwell法检测PC-3细胞侵袭迁移能力侵袭试验:收集1.2.2中各组细胞,于上层小室平铺100µl 1µg的Matrigel胶,37℃孵育4 h,计数,重悬。上室加入细胞悬液100µl,下室缓慢加入600µl含10%胎牛血清的RPMI1640完全培养基,防止加入过程中产生大气泡。37℃培养24 h。取出小室,用棉签擦除上层小室内的细胞和Matrigel胶,1%多聚甲醛混合固定后用0.1%结晶紫染色,用倒置显微镜随机选取5个视野并拍照,进行统计分析。实验重复3次,取平均值。迁移试验除不加入Matrigel胶外,其余步骤与侵袭试验完全相同。

表1 qRT-PCR引物Tab.1 qRT-PCR primers
1.2.7 Western blot检测PC-3细胞增殖、凋亡、侵袭相关蛋白表达 收集1.2.2中各组细胞,提取总蛋白,BCA蛋白试剂盒检测细胞中总蛋白含量,10%SDS-PAGE分离蛋白,转移蛋白至PVDF膜,5%脱脂牛奶室温封闭2 h。封闭完成后加入适宜浓度Ki67、Bax、Bcl-2、N-cadherin、E-cadherin鼠源一抗,4℃封闭过夜,24 h后吸取一抗,清洗PVDF膜,加入相应二抗(辣根过氧化物酶标记的山羊抗鼠)37℃封闭1 h,滴加ECL显色液,用凝胶成像系统获取蛋白条带图片,用Tanon 600图像分析系统拍照对蛋白质表达量进行定量分析,以GAPDH为内参。
1.3 统计学方法 采用统计学软件SPSS17.0进行数据分析,计量资料均以±s表示,多组间比较行方差分析,两组间比较采用LSD-t检验;计数资料用n表示,采用χ2检验;P<0.05表示差异有统计学意义。
2 结果
2.1 miR-299-5p在前列腺癌及癌旁组织中表达情况 与癌旁组相比,前列腺癌组组织miR-299-5p相对表达量显著降低(P<0.05)。见表2。
2.2 miR-299-5p水平与前列腺癌临床病理特征的关系 根据前列腺癌患者miR-299-5p表达水平的中位值0.46分为高表达组共25例,低表达组共51例。结果显示miR-299-5p与患者年龄、术前PSA水平无关(P>0.05),与患者淋巴结转移、临床分期、骨转移相关、预后情况,有统计学意义(P<0.05)。见表3。
2.3 转染后各组PC-3细胞miR-299-5p表达 与空白组相比,阴性对照组PC-3细胞miR-299-5p相对表达量差异无统计学意义(P>0.05),miR-299-5p mim⁃ics组PC-3细胞miR-299-5p相对表达量显著升高(P<0.05);与阴性对照组相比,miR-299-5p mimics组PC-3细胞miR-299-5p相对表达量显著升高(P<0.05)。见表4。
2.4 miR-299-5p对PC-3细胞增殖的影响 CCK-8实验显示,与空白组相比,阴性对照组各时间点增殖抑制率差异无统计学意义(P>0.05),miR-299-5p mimics组转染后48 h、72 h增殖抑制率显著升高(P<0.05);与阴性对照组相比,miR-299-5p mimics组转染后48 h、72 h后增殖抑制率显著升高(P<0.05)。见表5。
表2 两组组织间miR-299-5p表达情况对比(±s,n=76)Tab.2 Comparison of miR-299-5p expression in two group(±s,n=76)

表2 两组组织间miR-299-5p表达情况对比(±s,n=76)Tab.2 Comparison of miR-299-5p expression in two group(±s,n=76)
Groups Paracancerous Prostate cancer t P miR-299-5p/U6 1.24±0.21 0.46±0.05 43.615 0.000
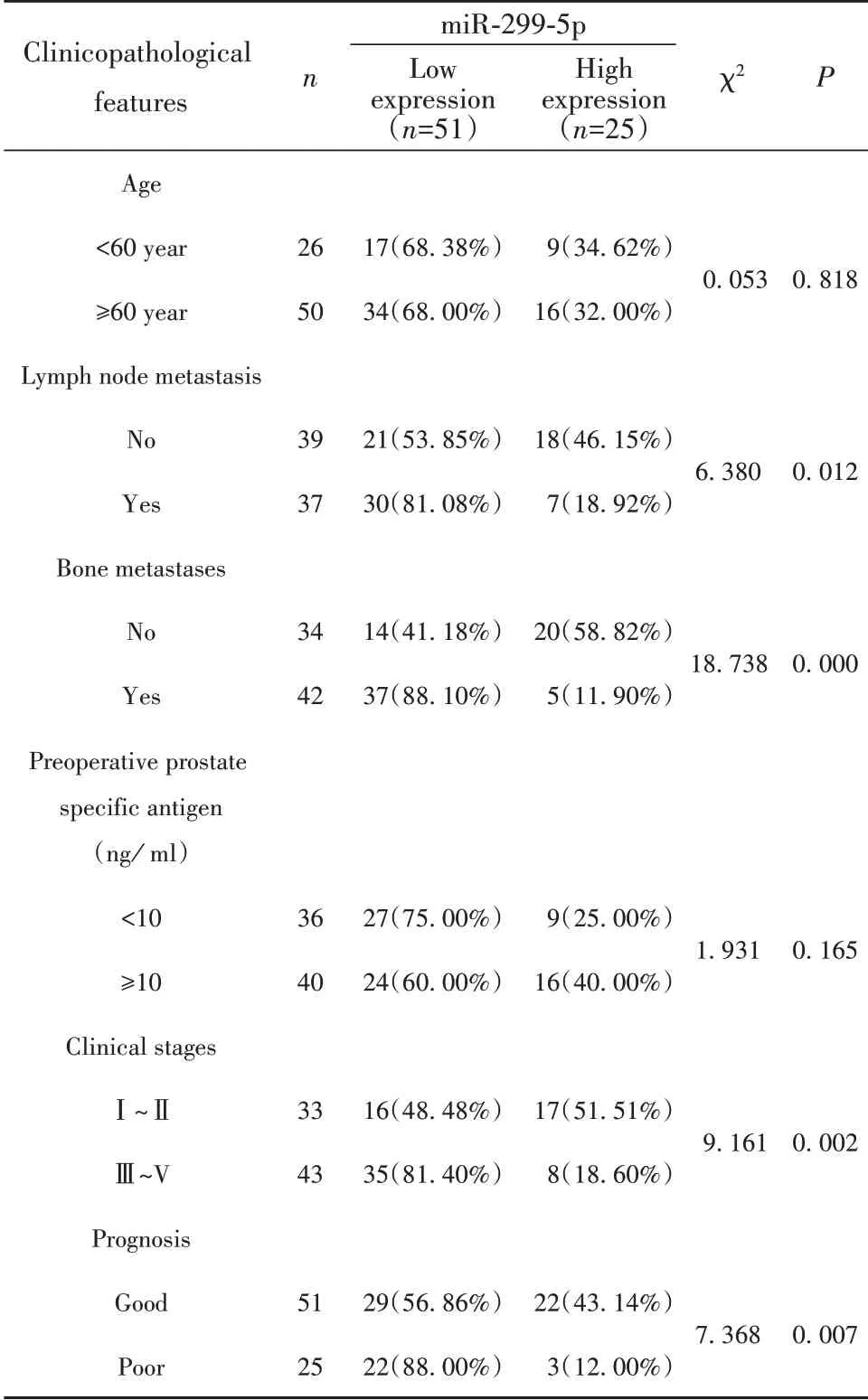
表3 miR-299-5p水平与前列腺癌临床病理特征的关系Tab.3 Relationship between miR-299-5p level and clinico⁃pathological features of prostate cancer
表4 各组PC-3细胞miR-299-5p表达情况(±s,n=6)Tab.4 Expression of miR-299-5p in PC-3 cells of each group(±s,n=6)

表4 各组PC-3细胞miR-299-5p表达情况(±s,n=6)Tab.4 Expression of miR-299-5p in PC-3 cells of each group(±s,n=6)
Note:1)P<0.05 vs Blank group;2)P<0.05 vs Negativecontrol group.
Groups Blank Negative control miR-299-5p mimics F P miR-299-5p/U6 1.03±0.17 1.05±0.16 2.58±0.401)2)66.347 0.000
2.5 miR-299-5p对PC-3细胞凋亡的影响 与空白组相比,阴性对照组细胞凋亡率差异无统计学意义(P>0.05),miR-299-5p mimics组细胞凋亡率显著升高(P<0.05);与阴性对照组相比,miR-299-5p mimics组细胞凋亡率显著升高(P<0.05)。见图1、表6。
2.6 miR-299-5p对PC-3细胞侵袭迁移的影响 Tran⁃swell试验显示(图2,表7),与空白组相比,阴性对照组PC-3细胞侵袭、迁移细胞数差异无统计学意义(P>0.05),miR-299-5p mimics组PC-3细胞侵袭迁移细胞数显著下降(P<0.05);与阴性对照组相比,miR-299-5p mimics组PC-3细胞侵袭、迁移细胞数显著降低(P<0.05)。
2.7 miR-299-5p对增殖、凋亡、侵袭迁移相关蛋白表达影响 与空白组相比,阴性对照组Ki67、Bax、Bcl-2、N-cadherin、E-cadherin蛋白表达差异无统计学意义(P>0.05),miR-299-5p mimics组Ki67、Bcl-2、N-cadherin蛋白表达显著下降(P<0.05),Bax、E-cad⁃herin蛋白表达显著升高(P<0.05);与阴性对照组相比,miR-299-5p mimics组Ki67、Bcl-2、N-cadherin蛋白表达显著下降(P<0.05),Bax、E-cadherin蛋白表达显著升高(P<0.05)。见图3、表8。
表5 各组PC-3细胞增殖抑制率情况(±s,n=6,%)Tab.5 PC-3 cell proliferation inhibition rate in each group(±s,n=6,%)

表5 各组PC-3细胞增殖抑制率情况(±s,n=6,%)Tab.5 PC-3 cell proliferation inhibition rate in each group(±s,n=6,%)
Note:1)P<0.05 vs Blank group;2)P<0.05 vs Negativecontrol group.
Groups Blank Negative control miR-299-5p mimics F P 24 h 14.52±2.07 14.27±2.03 14.85±2.12 0.118 0.889 48 h 18.79±2.68 17.92±2.56 28.53±4.071)2)20.603 0.000 72 h 25.61±3.65 25.99±3.71 49.87±7.121)2)44.700 0.000

图1 各组细胞凋亡情况Fig.1 Cell apoptosis in each group
表6 各组细胞凋亡率比较(±s,n=6,%)Tab.6 Comparison of apoptosis rate in each group(±s,n=6,%)

表6 各组细胞凋亡率比较(±s,n=6,%)Tab.6 Comparison of apoptosis rate in each group(±s,n=6,%)
Note:1)P<0.05 vs Blank group;2)P<0.05 vs Negativecontrol group.
Groups Blank Negative control miR-299-5p mimics F P Apoptosis rate 13.28±2.12 13.95±2.09 21.37±3.841)2)15.370 0.000
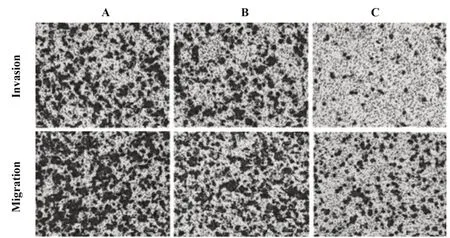
图2 各组PC-3细胞侵袭、迁移能力(×200)Fig.2 Invasion and migration ability of PC-3 cells in each group(×200)
表7 各组PC-3细胞侵袭、迁移细胞数比较(±s,n=6)Tab.7 Comparison of PC-3 cell invasion and migration in each group(±s,n=6)

表7 各组PC-3细胞侵袭、迁移细胞数比较(±s,n=6)Tab.7 Comparison of PC-3 cell invasion and migration in each group(±s,n=6)
Note:1)P<0.05 vs blank group;2)P<0.05 vs Negative control group.
Groups Blank Negativecontrol miR-299-5p mimics F P Number of invasive cells 345.71±49.38 358.88±51.26 126.85±18.121)2)56.677 0.000 Number of migrating cells 476.54±68.07 482.97±68.99 205.79±29.391)2)43.924 0.000

图3 各组PC-3细胞增殖、凋亡、侵袭、迁移相关蛋白表达情况Fig.3 Expressionsof PC-3 cell proliferation,apoptosis,in⁃vasion and migration related proteinsin each group
表8 各组PC-3细胞增殖、凋亡、侵袭迁移相关蛋白表达比较(±s,n=6)Tab.8 Expression comparison of PC-3 cell proliferation,apoptosis,invasion and migration related proteins in each group(±s,n=6)

表8 各组PC-3细胞增殖、凋亡、侵袭迁移相关蛋白表达比较(±s,n=6)Tab.8 Expression comparison of PC-3 cell proliferation,apoptosis,invasion and migration related proteins in each group(±s,n=6)
Note:1)P<0.05 vs Blank group;2)P<0.05 vs Negative control group.
Groups Blank Negativecontrol miR-299-5p mimics F P Ki67 0.45±0.06 0.43±0.06 0.29±0.041)2)15.545 0.000 Bax 0.18±0.02 0.20±0.03 0.32±0.041)2)35.586 0.000 Bcl-2 0.53±0.07 0.54±0.08 0.43±0.061)2)4.470 0.030 N-cadherin 0.45±0.06 0.45±0.06 0.30±0.041)2)15.341 0.000 E-cadherin 0.37±0.05 0.38±0.05 0.52±0.071)2)12.788 0.001
3 讨论
差异性基因表达对于预测肿瘤发生及治疗疾病具有一定指导意义。miR-299-5p定位于14q32.31,具有重要调控功能。LIU等[8]研究显示,子宫内膜癌中miR-299表达下调,是患者不良预后的独立风险因子。ZHENG等[9]研究表明miR-299在肺癌中低表达,且通过靶向ABCE 1促进对阿霉素的敏感性。PENG等[10]研究显示,miR-299-5p通过MAPK/ERK信号通路抑制胶质母肿瘤细胞增殖。相关研究显示miR-299-5p在胃腺癌、结直肠癌、鼻咽癌等肿瘤中发挥抑癌基因功能[11-13]。但其在前列腺癌中研究较少。本研究中,前列腺癌组织中miR-299-5p表达较癌旁组织低,与其他恶性肿瘤中表达趋势一致,提示miR-299-5p表达与前列腺癌的发生有关,miR-299-5p可能在前列腺癌中也发挥抑癌基因作用。本研究还发现有淋巴结转移、骨转移、临床分期高、预后不良患者中miR-299-5p低表达者比例高于miR-299-5p高表达者,提示miR-299-5p表达与前列腺癌患者病理严重程度有关,miR-299-5p低表达可能促进前列腺癌恶性转化过程。
肿瘤细胞通常具有增殖、凋亡能力异常,侵袭迁移能力增强等特征[14]。肿瘤的发生与癌基因及抑癌基因的失调密切相关[15]。为进一步检测miR-299-5p对前列腺癌细胞生物学功能的影响,本研究将miR-299-5p mimics转染至人前列腺癌PC-3细胞进行探讨,结果发现miR-299-5p mimics组细胞增殖、侵袭迁移能力显著低于空白组及阴性转染组,而细胞凋亡比例显著高于空白组及阴性转染组。以上实验结果提示miR-299-5p过表达可抑制PC-3细胞增殖,促进PC-3细胞凋亡,进一步提示miR-299-5p在前列腺癌中可能发挥抑癌基因作用。Ki67是增殖细胞相关的核抗原,其功能与有丝分裂密切相关,表达量越高,肿瘤生长速度越快,组织分化越差,是肿瘤细胞异常增殖的重要指标[16]。Bax、Bcl-2具有同源性,均属于Bcl-2基因家族,Bax主要发挥促凋亡作用,Bcl-2发挥抑制凋亡作用[17]。肿瘤细胞上皮间质转化(epithelial-mesenchymal transition,EMT)是肿瘤发生侵袭和转移的早期阶段,EMT发生过程中,上皮细胞标志物E-cadherin表达下调,而间质细胞标志物N-cadherin表达显著上调,这些基因表达受多种遗传学及表观遗传学因素调控[18-19]。王瑾等[20]研究显示,miR-299-5p过表达可抑制舌鳞状细胞癌EMT进展,抑制细胞侵袭迁移能力。本研究中miR-299-5p mimics组Ki67、Bcl-2、N-cadherin蛋白表达较空白组与阴性对照组降低,Bax、E-cad⁃herin蛋白表达则相反,进一步提示miR-299-5p过表达可抑制PC-3细胞增殖、侵袭、迁移相关蛋白表达,促进PC-3细胞凋亡相关蛋白表达,但其发挥作用的具体机制本研究未做探讨。
综上所述,miR-299-5p在前列腺癌组织中低表达,与淋巴结转移、骨转移、临床分期等临床病理特征密切相关,miR-299-5p过表达可抑制PC-3增殖、侵袭与迁移,促进凋亡,可能成为治疗前列腺癌潜在靶点。但本研究也存在一定不足,有关miR-299-5p在前列腺癌中的作用机制有待进一步探讨。

