LINC00665通过靶向miR-138/AKT1促进Hela细胞增殖和抑制凋亡的机制研究
刘晓娟,谢双双,张 晶,康燕华
(河北北方学院附属第一医院 妇产科,河北 张家口075002)
宫颈癌是女性排名第三位的最常见的妇科恶性肿瘤,也是引起癌症相关死亡的主要原因[1]。随着宫颈细胞学和宫颈病理活检技术的发展,早期和局部晚期癌症可以更早、更准确的被检测,宫颈癌的预后在最近的第2、3年中得到了显着改善,但是宫颈癌的发病机制尚不清楚,并且5年生存率仍不能令人满意[2]。微小RNA(microRNA,miRNA)是近年来发现的与肿瘤发生和发展密切相关的一段RNA,miRNA可通过碱基配对的方式特异性的与靶基因的信使RNA结合(message RNA,mRNA),转录后水平上调节基因的表达从而参与肿瘤的发展[3]。一项最新的研究显示miR-138的水平与宫颈癌患者化疗敏感性有关,但是关于miR-138在宫颈癌中的作用机制尚不清楚[4]。miRNA 的功能又受到长链非编码RNA(long non-coding RNA,LncRNA)的靶向调控,LncRNA会通过“海绵”的吸附方式影响miRNA对mRNA的靶向作用[5]。LINC00665是一种新发现的与肿瘤密切相关的LncRNA,在肝细胞癌中,LINC00665可通过靶向miR-186-5p调节MAP4K3蛋白的表达发挥促癌作用[6]。本文主要分析LINC00665通过靶向miR-138/AKT1调节宫颈癌细胞增殖和抑制凋亡的机制。
1 材料与方法
1.1 主要材料和仪器
人宫颈癌Hela细胞系(ATCC公司,美国)。DMEM培养基(Invitrogen公司,美国)。miR-138类似物(mimic)、LINC00665和AKT1过表达质粒以及相应的阴性对照(negative control,NC)(Thermo Fisher公司,美国)。Lipofectamine 2000(Invitrogen公司,美国)。双荧光素酶报告试剂盒和相应的1000 System荧光检测仪(Promega公司,美国)。细胞计数试剂盒-8(Cell Counting Kit-8,CCK-8)试剂盒和结晶紫染色试剂盒(Beyotime生物技术研究所,中国)。凋亡检测试剂盒和FACSCalibur TM流式细胞仪(BD Biosciencesg公司,美国)。PCR引物由Genewiz公司(中国)设计和合成。Trizol试剂(Invitrogen公司,美国)。逆转录cDNA试剂盒和SYBR Green PCR Master Mix qPCR试剂盒(Roche公司,瑞士)。ABI 7500 PCR检测系统(Life technology公司,美国)。AKT1、GAPDH抗体和二抗(Abcam公司,美国)。PVDF膜(Bio-Rad公司,美国)。雌性C57BL/6小鼠购自西安交通大学实验动物中心。
1.2 生物信息学分析
通过工具网站Kaplan-Meier Plotter分析TCGA数据库中宫颈癌患者miR-138水平与生存之间的关系,预测LINC00665靶向miR-138和miR-138靶向AKT1的结合位点。
1.3 双荧光素酶报告实验
将细胞分为NC组和mimic组,并分别通过质粒转染NC和miR-138 mimic。在验证miR-138靶向AKT1时,分别将野生型的AKT1(AKT1-wt)或突变的AKT1(AKT1-mut)克隆到pMIR-REPORT荧光素酶载体中。在验证LINC00665时靶向miR-138时,分别将LINC00665-wt和LINC00665-mut克隆到pMIR-REPORT荧光素酶载体中。将Hela细胞接种在6孔板中,然后使用Lipofectamine 2000将克隆和突变的序列转染至细胞中。使用荧光素酶报告检测仪评估荧光素酶活性。
1.4 qPCR检测LINC00665D、miR-138和AKT1 mRNA
通过Trizol获得细胞中总RNA并检测浓度和纯度。使用cDNA试剂盒将1 μg RNA逆转录合成cDNA(42℃ 60 min,70℃ 5 min,然后4℃保存)。使用SYBR Green PCR Master Mix进行qPCR实验(在95℃ 10 min,40个循环,94℃ 15 s,60℃ 1 min, 60℃ 1 min,4℃保存)。比较循环阈值(ΔΔCt)用于分析RNA的表达。GAPDH和U6表达用于标准化计算。
1.5 Western blot检测AKT1 蛋白的表达
将细胞裂解后收集总蛋白,并检测蛋白纯度和浓度。使用10%的SDS-PAGE进行电泳实验分离蛋白,90 V电压下进行120 min。然后使用PVDF膜转膜并在室温下用5%无脂牛奶封闭2 h。分别加AKT1和GAPDH抗体(稀释1∶1 000)室温震荡2 h,后在4℃孵育过夜,加入二抗(稀释1∶5 000),孵育 3 h。以GAPDH为内参,通过Quantity One软件分析条带的灰度值并计算目标蛋白质的表达量。
1.6 细胞培养、分组和转染
将Hela细胞在DMEM培养基中培养,37℃ 5% CO2,相对湿度100%。将细胞分为4组,即对照组、mimic组、mimic+LINC00665组和LINC00665组。使用Lipofectamine 2000试剂盒进行瞬时转染,其中mimic组和mimic+LINC00665组通过转染miR-138 mimic质粒以过表达miR-138,mimic+LINC00665组和LINC00665组转染AKT1质粒过表达AKT1。对照组转染两种NC质粒,在转染24 h 后收集细胞进行后续实验。
1.7 CCK-8检测细胞活力
将2×104个细胞接种于96孔板,在培养第24 h、48 h和72 h加入10 μl CCK-8试剂并在37℃培养,通过酶标仪450 nm处的光密度计算相对细胞活力。
1.8 流式细胞术检测细胞凋亡率
取消化后的2×105个细胞,分别加入FITC Annexin V和碘化丙啶(PI)10 μl和5 μl,然后室温、避光下分别孵育15 min,然后通过进行流式细胞术,通过配套Cell Quest软件分析凋亡率。
1.9 荷瘤裸鼠实验
将9只BALB/c裸鼠随机分为3组,即对照组、miR-138组和miR-138+LINC00665组,每组3只。根据1.6的方法分别制备NC转染的、miR-138 mimic转染的、miR-138和LINC00665共转染的Hela细胞。分别将3组细胞制成0.2 ml的细胞悬液(6×106个),皮下注射。当对照组小鼠瘤体生长至约1 000 mm3时处死小鼠,取出瘤体检测肿瘤体积和质量。
1.10 统计学处理
所有实验设立3个复孔。数据以平均值±标准偏差(SD)表示。 统计分析使用SPSS 19软件。 进行单因素方差分析,两两比较使用t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 生物信息学分析结果
在TCGA数据库中,根据Kaplan-Meier Plotter分析结果,miR-138高表达的患者的生存率显著高于miR-138低表达患者(P<0.05),见图1。

图1 Kaplan-Meier Plotter分析TCGA数据库中不同miR-138水平宫颈癌患者生存曲线
2.2 LINC00665直接靶向miR-138
LINC00665靶向miR-138的结合位点见图2。然后通过双荧光霉素实验结果验证了同时转染miR-138 mimic和LINC00665-wt的细胞的荧光酶素活性显著降低(P<0.05),见表1,说明LINC00665直接靶向miR-138。

图2 LINC00665直接靶向miR-138的结合位点

表1 LINC00665直接靶向miR-138的双荧光素酶报告结果(相对荧光强度)
2.3 miR-138靶向抑制AKT1
miR-138靶向AKT1的结合位点见图3。然后通过双荧光霉素实验结果验证了同时转染miR-138 mimic和AKT1-wt的细胞的荧光酶素活性显著降低(P<0.05),见表2,说明miR-138直接靶向AKT1。并且进一步研究也发现与NC组比较,转染miR-138 mimic后,细胞中AKT1 mRNA和蛋白的水平显著降低(P<0.05),见表2。

图3 miR-138直接靶向AKT1的结合位点

表2 miR-138直接靶向AKT1的双荧光素酶报告结果以及两组AKT1 mRNA和蛋白的水平(相对荧光强度)
2.4 各组细胞中LINC00665、miR-138、AKT1 mRNA和蛋白的水平
Mimic组的miR-138水平显著高于对照组,LINC00665、AKT1 mRNA和蛋白水平显著低于对照组(P<0.05)。LINC00665组miR-138水平显著低于对照组,LINC00665、AKT1 mRNA和蛋白水平显著高于对照组(P<0.05)。Mimic+LINC00665组的miR-138水平显著低于Mimic组,LINC00665、AKT1 mRNA和蛋白水平显著高于mimic组(P<0.05)。miR-138对AKT1的抑制作用被LINC00665阻断,见表3。

表3 各组细胞中LINC00665、miR-138、AKT1 mRNA和蛋白的水平
2.5 各组细胞的细胞生长情况比较
在第48 h和72 h,mimic组的细胞活力显著低于对照组(P<0.05),LINC00665组的细胞活力显著高于对照组(P<0.05),并且Mimic+LINC00665组的细胞活力显著高于Mimic组(P<0.05),过表达LINC00665会部分逆转miR-138对细胞生长的抑制作用,见表4。

表4 各组细胞的相对细胞活力比较(%)
2.6 各组细胞凋亡情况比较
Mimic组的细胞凋亡率显著高于对照组(P<0.05),LINC00665组的细胞凋亡率显著低于对照组(P<0.05),并且Mimic+LINC00665组的细胞凋亡率显著低于Mimic组(P<0.05)。过表达LINC00665会逆转miR-138对细胞凋亡的促进作用,见图4和表5。

图4 流式细胞术检测各组细胞凋亡率

表5 各组细胞凋亡率比较
2.7 各组小鼠皮下肿瘤的体积和质量比较
miR-138组荷瘤裸鼠的肿瘤体积和质量均显著低于对照组(P<0.05),miR-138+LINC00665组肿瘤体积和质量显著高于miR-138组(P<0.05),见图5和表6。

图5 荷瘤裸鼠实验检测LINC00665和miR-138对肿瘤生长的影响
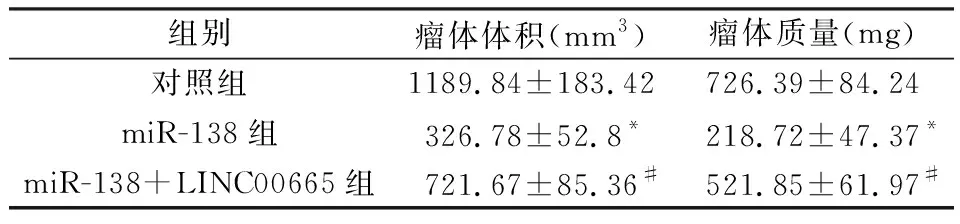
表6 各组小鼠肿瘤体积和质量比较
3 讨论
宫颈癌是妇科最常见的肿瘤之一,2018年的一项癌症统计显示全世界有570 000例新的宫颈癌病例,约有311 000例死于这种疾病[7]。尽管许多早期诊断宫颈癌的新生物标志物被发现,并且靶向疗法、免疫疗法等新的治疗手段被不断地应用于宫颈癌的治疗,但由于肿瘤的转移、复发和获得性耐药的发生,宫颈癌的5年总生存率仍然很差。探究宫颈癌发生、进展的分子机制,是提高早期的临床诊断,并发现宫颈癌癌的新治疗策略和靶标的重要手段。
最新研究显示LncRNA、miRNA以及靶基因的mRNA的调控途径在肿瘤发生和发展中发挥重要作用。miRNA是一系列小分子非编码单链RNA,由22个核苷酸组成,它可以识别并通过碱基配对的方式与mRNA结合并诱导mRNA降解或翻译抑制[8]。LncRNA是一类长链RNA,其长度超过200个核苷酸,不具有蛋白质翻译功能。LncRNA可以通过竞争内源性RNA的方式作为“海绵”miRNA,从而调节miRNA在mRNA降解和翻译中的作用[9]。在LncRNA-miRNA-mRNA途径中,miRNA是关键,但是miRNA种类繁多,从中寻找一种有意义的miRNA难度较大。生物信息学和人类基因组学的发展在一定程度上解决了这一问题,TCGA数据库收录了全球30多种肿瘤的标本,并通过基因探针的方式对人类基因组转录水平进行了检测,然后通过生物信息学方法分析不同基因的表达特点[10]。我们首先通过Kaplan-Meier Plotter分析了TCGA数据库中miR-138与宫颈癌患者生存率的关系,结果显示miR-138高表达的患者的生存率显著高于miR-138低表达患者,提示miR-138在宫颈癌中可能发挥抑癌作用。并且通过预测和双荧光素酶报告验证了miR-138靶向抑制AKT1 mRNA和蛋白的表达。AKT1是PI3K/AKT通路中的重要蛋白,并且过往研究已经证实了AKT1具有促进宫颈癌细胞增殖、迁移、侵袭以及耐药的作用[11-12]。这些结果显示miR-138可能通过靶向抑制AKT1发挥抑癌作用。一项最新研究显示miR-138可通过靶向抑制sirt-1调控肺癌细胞的增殖和转移[13]。并且miR-138在结直肠癌、膀胱癌、前列腺癌中均发挥抑癌作用[14-16]。国内一项研究显示miR-138的表达与宫颈癌患者化疗敏感性有关,但是miR-138-5p对宫颈癌细胞生物学行为的影响尚不明确,关于LncRNA对miR-138靶向调控AKT1的作用也不清楚。
LINC00665可以通过靶向miR-149-3p调控RNF2促进胃癌细胞的增殖和转移[17]。本次研究结果也显示LINC00665可直接靶向miR-138。为进一步分析LINC00665和miR-138对宫颈癌细胞的影响,我们将Hela细胞分为对照组、Mimic组、Mimic+LINC00665组和LINC00665组。结果显示过表达LINC00665显著抑制了miR-138的表达,并且阻断了miR-138对AKT1的抑制作用,说明LINC00665可通过靶向miR-138促进AKT1的表达。进一步的研究结果也显示了Mimic组的细胞活力显著低于对照组,细胞凋亡率显著高于对照组,LINC00665组的细胞活力显著高于对照组,细胞凋亡率显著低于对照组。Mimic+LINC00665组的细胞活力显著高于Mimic组,细胞凋亡率显著低于Mimic组。miR-138会抑制Hela细胞生长并促进细胞凋亡,而LINC00665会通过靶向miR-138阻断miR-138对细胞的抑制作用。体内实验也显示了miR-138组荷瘤裸鼠的肿瘤体积和质量均显著低于对照组,miR-138+LINC00665组肿瘤体积和质量显著高于miR-138组。这说明了LINC00665通过靶向miR-138参与宫颈癌的进展。
综上所述,miR-138靶向抑制AKT1的表达,LINC00665直接靶向miR-138,并且可通过靶向miR-138促进AKT1的表达。LINC00665通过靶向调控miR-138/AKT1促进Hela细胞的增殖并抑制凋亡。但是关于LINC00665通过miR-138/AKT1对宫颈癌的影响尚不清楚,并且关于LINC00665和miR-138在宫颈癌患者中的临床意义也需要进一步研究。

