热休克蛋白90对结肠癌荷瘤小鼠肝脏功能的影响
于 爽,吴 颖,李佳昕,齐 航,马娇艳,林 楠
(1.锦州市中心医院 消化科,辽宁 锦州121000;2.吉林大学基础医学院 病理生理学教研室,吉林 长春130021)
热休克蛋白90(HSP90)作为细胞内关键的伴侣分子,能够对多种客户蛋白的稳定性和功能发挥调控作用,这些客户蛋白直接参与调节细胞生长和存活[1-3]。在肿瘤细胞中多种HSP90客户蛋白发生突变或者过表达,因此,抑制HSP90能够同时降解多个客户蛋白为肿瘤的治疗提供了新途径[4-5]。线粒体是细胞的能量工厂,为细胞的生存提供了最基本的能量供应[6]。肝脏作为机体内药物代谢的主要场所,需要大量的能量维持其基本功能,因此维持肝细胞内线粒体功能的稳定是避免肝细胞损伤的重要靶点[7]。有研究发现,HSP90能够协助线粒体蛋白进入线粒体,进而调控线粒体功能[8]。但是,HSP90抑制剂作为新兴的抗肿瘤药对肝脏组织作用尚不明确。因此,本研究以结肠癌荷瘤小鼠为基础,分析HSP90在结肠癌介导肝脏损伤中的作用。
1 材料与方法
1.1 材料
1.1.1实验动物分组及给药 健康的SPF级BALB/C雄性6-8周龄小鼠20只购自长春亿斯实验动物技术有限公司[许可证号:SCXK(吉)-2020-0002],进行随机分组,分为对照组和PU-H71组,每组各10只。将5×106结肠癌CT-26细胞(购自中国科学院上海细胞库)接种至小鼠右后腿外侧。待肿瘤直径到3 mm时,经尾静脉给药,按2 mg/kg剂量给予PU-H71,每周2次,持续给药2周,对照组给予同样体积生理盐水。
1.1.2实验材料 天门冬氨酸氨基转换酶(AST)、丙氨酸氨基转换酶(ALT)、丙二醛(MDA)和超氧化物歧化酶(SOD)活性检测试剂盒购于南京建成生物工程研究所。IL-1β、IL-6和TNF-α 酶联免疫吸附试验(ELISA)检测试剂盒购于R&D公司。Trizol购于日本TAKARA公司。RT-PCR试剂盒、qPCR试剂盒购于上海翊圣生物科技有限公司。
1.1.3实验设备 光学显微镜(日本Olympus);恒温培养箱、离心机(美国Thermo Fisher);全波长酶标仪(美国Bio-Tek);PCR仪、实时定量荧光PCR仪(美国Bio-Red)。
1.2 方法
1.2.1血清生化指标检测 小鼠采取摘眼球取血,将获得的血样在室温条件下3 000 rpm离心10 min,将获得的血清严格按着AST、ALT、MDA和SOD检测试剂盒说明书对血清中各酶的活性进行检测。AST和ALT采用510 nm波长测定吸光度,MDA采用532 nm波长测定,SOD采用450 nm波长测定,根据标准曲线计算含量。
1.2.2病理学检测 取肝组织于4%多聚甲醛固定,经石蜡包埋后切片,经二甲苯进行脱蜡处理,梯度乙醇溶液清洗(100%乙醇-100%乙醇-95%乙醇-80%乙醇-75%乙醇),然后经蒸馏水水洗,苏木精染色后采用盐酸乙醇进行分化,自来水浸泡后进行伊红染色,伊红染色后经梯度酒精(80%乙醇-90%乙醇-95%乙醇-95%乙醇-100%乙醇-100%乙醇)、二甲苯进行脱水处理,最后经中性树脂封片,通过光学显微镜观察并拍照。
1.2.3血清炎症因子检测 小鼠采取摘眼球取血,将获得的血样在室温条件下3 000 rpm离心10 min,将获得的血清严格按酶联免疫吸附试验(ELISA)试剂盒说明进行操作,检测血清中IL-1β、IL-6和TNF-α的含量,经酶标仪检测570 nm波长的吸光度,通过标准曲线计算各炎症因子的含量。
1.2.4RT-PCR和qPCR检测 将剥离的肝脏组织加入Trizol进行匀浆,提取组织RNA,然后按RT-PCR试剂盒说明进行操作,获得cDNA,按qPCR试剂盒操作说明加入cDNA模板、引物和qPCR mix,通过Bio-red qPCR仪进行检测。引物序列信息见表1。
1.3 统计学分析
采用SPSS 20.0软件对数据进行分析,数据采用平均值±标准差来表示,采用χ2检验分析组间差异,以P<0.05为差异有统计学意义。

表1 qPCR引物序列信息
2 结果
2.1 PU-H71对小鼠肝功能的影响
取对照组和PU-H71组小鼠血清进行生化指标分析。结果见表2,在PU-H71的作用下,小鼠血清中AST、ALT的活性明显低于对照组(P<0.05);同时,对MDA和SOD活性检测结果见表3,PU-H71组血清中MDA活性明显降低,而SOD活性明显升高(P<0.05)。
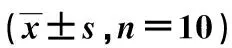
表2 PU-H71对小鼠血清AST和ALT水平的影响
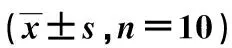
表3 PU-H71对小鼠血清MDA和SOD水平的影响
2.2 肝组织病理学检测
为了进一步从形态学上确定PU-H71对小鼠肝脏的作用,对肝脏标本进行病理学观察。对照组肝组织在肿瘤的影响下出现明显的病变,肝小叶结构破坏严重,肝血窦变窄,肝细胞出现明显的肿胀坏死,胞浆染色变淡,出现明显的气球样变。损伤严重的肝细胞只能见到细胞核,胞质透亮。与对照组比较,PU-H71组小鼠肝脏组织结构更接近于正常,肝小叶结构相对完整,肝血窦变窄程度较弱,相对清晰可见,肝细胞肿胀程度较轻,未见明显的气球样变。
2.3 PU-H71对血清炎症因子含量的影响
对照组和PU-H71组小鼠血清进行ELISA检测,结果见图1,相对于对照组,经PU-H71处理后,小鼠血清中IL-1β、IL-6和TNF-α明显的降低(P<0.05)。

图1 PU-H71对小鼠血清促炎因子的影响
2.4 PU-H71对肝组织中线粒体自噬相关基因表达的影响
为了确定PU-H71影响小鼠肝脏的具体机制,对小鼠肝组织中线粒体自噬相关基因的表达进行分析。结果见图2,相对于对照组,PU-H71处理组线粒体自噬相关基因PINK、Parkin、p62和LC3的表达明显上调(P<0.05)。
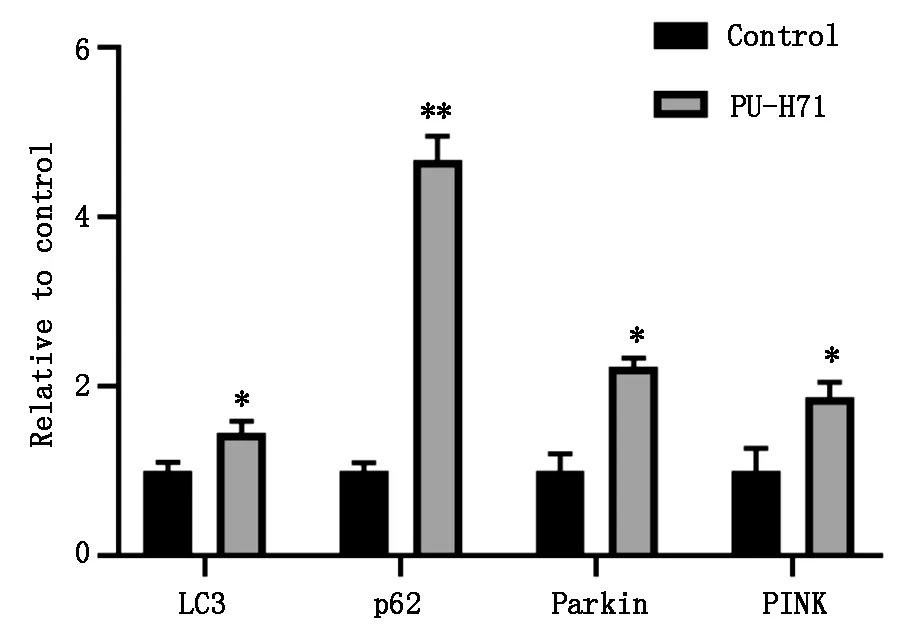
图2 PU-H71对肝脏细胞自噬的调控作用
3 讨论
HSP90作为细胞内关键的伴侣分子,占细胞总蛋白的1%-2%[9]。在真核生物细胞中,HSP90能够与10%的蛋白发生相互作用,目前发现大约有700余种蛋白能够与HSP90发生蛋白-蛋白直接相互作用,这表明HSP90能够参与调控多种生物学过程,进而影响细胞的生存[10-11]。研究表明,在肿瘤组织中HSP90的表达量要显著的高于正常组织,以保证肿瘤细胞快速增殖过程中所需蛋白的正确折叠[12-13]。因此,以抑制HSP90为靶点的研究为肿瘤的治疗提供了新途径。但是,抑制HSP90后对肝脏的影响目前尚不明确,有待进一步的研究。
肝脏作为机体药物代谢和排泄的主要场所,70%左右的药物需要经过肝脏的降解、灭火和转化,或者经胆汁进行排泄[14]。目前研究发现,化疗药物均具有一定的肝脏毒性,例如顺铂能够造成明显的肝脏损伤[15]。因此,寻求副作用小,且治疗效果好的抗肿瘤药一直是肿瘤学领域亟待解决的问题。本文研究结果表明,在持续给药2周后,相对于对照组,PU-H71组小鼠血清中肝损伤标志物AST和ALT的活性明显降低(P<0.05),并且伴随着MDA活性的降低和SOD活性的升高(P<0.05),说明PU-H71在抑制肿瘤增殖的情况下,能够在一定程度上缓解肿瘤对小鼠肝脏的损伤作用。
进一步的组织病理学观察发现,对照组在肿瘤的影响下肝组织出现了明显的病变,肝小叶结构紊乱,肝血窦变窄,肝细胞肿胀坏死。而PU-H71组肝组织结构相对正常,肝血窦变窄程度明显弱于对照组,肝细胞肿胀程度明显低于对照组,坏死的肝细胞和气球样变相对较少。因此,形态学结果进一步表明PU-H71能够在一定程度上逆转肿瘤增殖对肝脏的损伤作用。组织损伤伴随炎症反应和促炎因子的分泌进一步将炎症反应放大,过度的炎症反应是加重组织损伤的重要原因。本研究结果表明,PU-H71能够降低肝组织病变的同时抑制血清中促炎因子IL-1β、IL-6和TNF-α的表达,这可能是PU-H71逆转肿瘤所造成肝损伤的途径。
肝脏作为机体血液丰富的器官之一,对药物代谢需要消耗大量的能量,线粒体数量和功能对于肝脏发挥正常作用至关重要[16-18]。而线粒体自噬是细胞清除受损线粒体的主要途径。本文的结果表明,相对于对照组,PU-H71处理能够促进肝组织线粒体自噬相关基因的表达,能够有效清除受损线粒体,维持线粒体功能和肝细胞内环境稳态。综上所述,PU-H71在抑制肿瘤的同时,通过调控线粒体自噬逆转肿瘤对肝脏的损伤作用,为其进一步的临床试验提供一定的数据支持。

