食管癌组织中ADAMTS1、ADAMTS18 基因mRNA的表达及其意义
尹 蕾,郭丽丽*,郭 炜,任郁英,秦志梅,赵素斌
(1.河北省邯郸市中心医院 检验科,河北 邯郸056008;2.河北医科大学第四医院河北省肿瘤研究所病理研究室,河北 石家庄050011;3.河北工程大学附属医院 普外科,河北 邯郸056002)
食管癌(Esophageal cancer,EC)是一种常见的消化道肿瘤,中国是全球食管癌发病率最高的几个地区之一,在食管癌病例中约90%的病例为食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)[1-2]。因此,为降低ESCC的病死率,检测特异性肿瘤标志物对临床ESCC的早期诊断、治疗及预后具有积极意义。
含Ⅰ型血小板结合蛋白基序的解聚蛋白样金属蛋白酶(a disintegrin-like and metalloproteinase with thrombospondin type l motifs,ADAMTS),是一类广泛存在于哺乳动物和无脊椎动物体内的分泌蛋白,具有金属蛋白酶特性,属于新的Zn2+依赖的金属蛋白酶家族。目前,已发现的19个ADAMTSs成员,在人体的众多生理活动中发挥着重要作用。近年来研究发现,ADAMTS家族成员在肿瘤的发生和进展中扮演着重要的角色[3]。本实验通过对ESCC组织及癌旁组织中ADAMTS1和ADAMTS18 mRNA的表达进行检测,在基因表达水平上探讨与ESCC病理参数的相关性。
1 材料与方法
1.1 标本来源及临床资料
选取河北医科大学附属第四医院2008-2011年间食管鳞癌手术切除的70例患者癌组织标本,患者年龄43-76岁,平均61.2岁,其中男性52例,女性18例。全部患者术前未进行抗肿瘤治疗,术后病理检查均确诊为食管鳞状细胞癌,手术记录及临床病理资料完整。按照国际抗癌联盟(UCC)1997年标准进行TNM分期,Ⅰ期2例、Ⅱ期37例、Ⅲ期28例、Ⅳ期3例;根据有无淋巴结转移分组,有淋巴结转移组44例,无淋巴结转移组26例;按肿瘤组织分化程度分组,高分化组16例、中分化组26例,低分化组28例。每例患者均取癌旁正常粘膜及食管癌原发灶,将距离肿瘤边缘大于或等于5 cm的食管正常黏膜组织经镜检确认为癌旁正常组织,手术切取标本时先取癌旁组织后取肿瘤组织。组织标本取下后立即取部分放入液氮中冷藏,后转于-80℃低温冰箱保存,用于提取组织RNA。标本的收集均与所选受试者签署知情同意书,研究经医院伦理委员会审核批准。
1.2 主要试剂
TRIzol试剂盒购自美国SBS公司,总RNA提取试剂购于美国Promega公司,逆转录PCR试剂盒及绿色体系购于美国Forments公司,DNA marker 购于北京Solarbio 科学技术有限公司,焦磷酸二乙酯(DEPC)购自美国,ADAMTS1、ADAMTS18基因引物由赛百盛工程有限公司合成并纯化,氯仿、异丙醇购于上海化学试剂总厂。
1.3 RT-PCR 法检测ESCC组织和癌旁组织中ADAMTS1 及 ADAMTS18 mRNA的表达
ESCC组织及癌旁组织总RNA的提取采用Trizol试剂提取,实验步骤严格按照说明书进行。紫外分光光度仪测定RNA的量,琼脂糖凝胶电泳法检测RNA的完整性。取1 μg总RNA,按照逆转录PCR试剂盒说明书步骤,将其逆转录成cDNA。以上述制备的cDNA为模板,利用PCR扩增出ADAMTS1、ADAMTS18及GAPDH片段。反应条件:94℃预变性10 min,94℃变性45 s,退火45 s,72℃延伸 45 s,35个循环扩增后,72℃7 min,引物序列及扩增产物大小见表1。PCR产物进行2%琼脂糖凝胶电泳,采用Gel Pro Analysizer 3.1 软件对电泳图像中ADAMTS1及ADAMTS18 mRNA的表达量进行半定量分析,通过与GAPDH表达量比较计算得到相对表达量。
1.4 统计学分析
2 结果
2.1 ESCC组织中ADAMTS1及ADAMTS18 基因mRNA的表达水平
RT-PCR检测结果显示,ESCC组织中ADMATS1基因mRNA的表达水平显著低于癌旁组织[(0.384±0.113)vs(0.889±0.276),P<0.01],见图1,表2;与癌旁组织相比,ESCC组织中ADAMTS18基因mRNA表达水平也显著降低[(0.351±0.115)vs(0.881±0.275),P<0.01],见图2,表2。
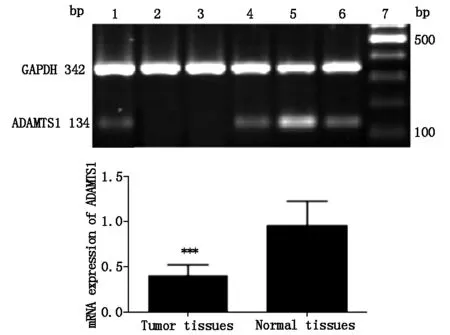
图1 食管鳞状细胞癌组织及癌旁正常组织中ADAMTS1 mRNA表达
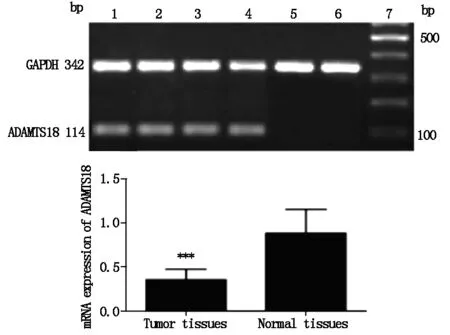
图2 食管鳞状细胞癌组织及癌旁正常组织中 ADAMTS18 mRNA表达

表1 RT-PCR 引物序列、退火温度和产物大小
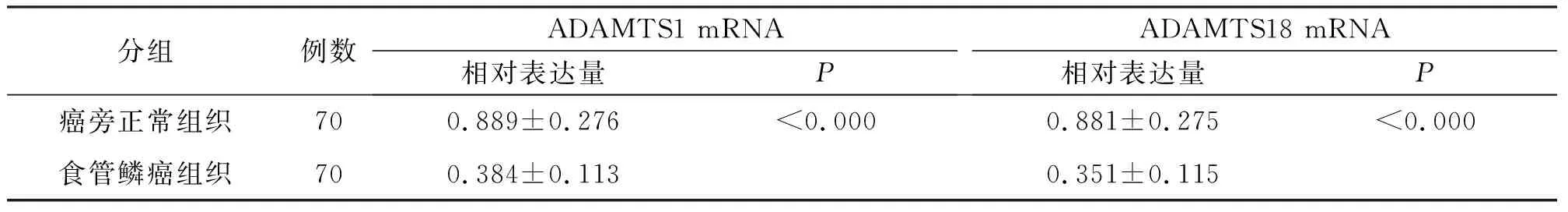
表2 食管鳞状细胞癌组织与癌旁正常组织中ADAMTS1、ADAMTS18 mRNA的表达
2.2 临床病理资料与ADAMTS1及ADAMTS18基因mRNA表达的关系
ESCC患者临床资料见表3。统计分析结果表明,ADAMTS1基因mRNA表达与ESCC患者的年龄、性别无统计学意义(P>0.05);有淋巴结转移组的ADAMTS1基因mRNA表达较无淋巴结转移组明显升高[(0.479±0.156)vs(0.288±0.098),P<0.05];与低分化鳞癌组织相比,高中分化鳞癌组ADAMTS1基因mRNA表达无明显统计学差异[(0.412±0.121)vs(0.395±0.118),P>0.05];TNM分期中,ADAMTS1 基因mRNA的相对表达量在Ⅰ+Ⅱ期组与Ⅲ+Ⅳ期组间无显著差异[(0.413±0.125)vs(0.379±0.112),P>0.05],见表3。
ADAMTS18基因mRNA表达与ESCC患者的年龄、性别无统计学意义(P>0.05);有淋巴结转移组的ADAMTS18基因mRNA表达较无淋巴结转移组无明显差异[(0.349±0.113)vs(0.374±0.112),P>0.05];与低分化鳞癌组织相比,高中分化鳞癌组ADAMTS18基因mRNA表达量显著增高[(0.496±0.153)vs(0.232±0.088),P<0.05];TNM分期中,ADAMTS18 基因mRNA的相对表达量在Ⅰ+Ⅱ期组与Ⅲ+Ⅳ期组间无显著差异[(0.368±0.109)vs(0.348±0.105),P>0.05],见表3。
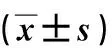
表3 ADAMTS1、ADAMTS18 MRNA表达与食管鳞状细胞癌患者临床病理特征的关系
3 讨论
食管癌位于我国恶性肿瘤发病率的第6位,发病数为24.6万人,而病死率位于我国恶性肿瘤死亡的第4位,死亡数为18.8万人[2]。ESCC为我国食管癌的高发类型,其发病机制复杂,与多种分子机制相关[4-5]。对食管癌发生及发展分子机制的研究有助于ESCC的早期诊断与靶向治疗[6]。ADAMTS家族为Zn2+依赖的金属蛋白酶家族,近年来研究发现,该家族的蛋白水解功能与肿瘤的发生、发展及侵袭扩散存在一定相关性。ADAMTS1和ADAMTS18基因的表达失调与多种肿瘤相关,但在ESCC中的作用报道较少,本文对此进行了研究。
ADAMTS1基因位于人染色体21q21-q22,其编码的蛋白质含951个氨基酸,分子量约为100 kD,在人体不同组织广泛表达,参与人体生长发育、泌尿系统及生殖系统的形成、结缔组织炎症、组织器官肿瘤的发生发展、动脉粥样硬化等生理和病理活动。ADAMTS1为抑癌基因,相关研究发现其在胰腺癌[7]、非小细胞肺癌[8]、前列腺癌[9]及乳腺癌[10]中表达下调。在肿瘤发生发展的过程中,浸润性生长及向远处组织转移是恶性肿瘤的两大特征,间质部位血管生成是其重要条件,新生血管的不断增加将加速肿瘤的迅速生长。ADAMTS1可抑制新生血管的生成,这种抗血管生成作用是通过对血管内皮生长因子(VEGF)或成纤维细胞生长因子(FGF2)的调节来发挥的[11],与ADAMTS1C-端的TSRS有关[12]。本研究通过对70例ESCC粘膜组织和70例癌旁正常黏膜组织研究发现,ESCC组织中ADAMTS1基因mRNA水平显著低于癌旁正常组织,表明ADAMTS1基因的低水平表达可能会促进ESCC的发生发展,即ADAMTS1对ESCC具有抑制作用,推测这种作用是通过上述ADAMTS1抑制血管生成而发挥的。此外,随着研究的深入,发现ADAMTS1还具备促进肿瘤生长及转移的作用。胃癌患者ADAMTS1表达水平下调,但淋巴结转移的胃癌患者组织中,ADAMTS1的阳性表达明显高于无淋巴结转移患者[13]。胰腺癌患者ADAMTS1表达低水平,但腹膜淋巴结转移患者ADAMTS1表达水平增高,预后较差[7]。本研究通过结合临床资料分析显示,ESCC淋巴结转移组ADAMTS1基因mRNA相对表达量高于无淋巴结转移组,这与上述研究结果一致。与此同时,ADAMTS1在肿瘤的发生发展中存在一些相反的作用,表现出组织特异性。研究发现其在肾癌和结肠癌细胞系中的上调表达能够抑制肝转移肿瘤的生长,但对肺转移的肿瘤则无此作用[14]。全长ADAMTS1能促进TA3小鼠乳腺肿瘤细胞的肺转移,还可以促进Lewis肺癌血管的增殖导致其肿瘤的发生发展及侵袭,但其片段则表现为抑制肿瘤的转移[15],对肿瘤具有促进和抑制的双向作用,功能复杂。
ADAMTS18位于16q23,含有13个外显子,属于全基因组关联基因,其编码的蛋白质含有1 222个氨基酸。研究发现,ADAMTS18在多种肿瘤组织中表达沉默,这种沉默是由其高甲基化所导致且与肿瘤分期无关,表明ADAMTS18在肿瘤发生发展过程中起抑制作用[16-17]。Wei等[18]的研究发现,ADAMTS18基因的突变可降低层黏连蛋白的黏附作用,促进黑色素细胞的生长、迁移和转移。本研究通过对70例ESCC粘膜组织和70例癌旁正常黏膜组织研究发现,ESCC组织中ADAMTS18基因mRAN水平较癌旁正常组织显著降低,表现为肿瘤抑制作用,这与上述研究报道相一致。通过结合临床资料分析显示,ESCC高中分化鳞癌组ADAMTS18基因mRNA表达水平高于低分化鳞癌组,表现为随着分化程度增高而表达减少的趋势。对于ADAMTS18是如何发挥肿瘤抑制作用的,目前研究尚无法揭示,其可能是通过直接结合生长促进或抑制因子来调节它们在肿瘤细胞中的作用;也可能是在溶解血小板栓子方面发挥重要作用以起到肿瘤抑制作用。
随着ADAMTS家族成员被不断发现,其家族成员参与人体血管新生、细胞凋亡、炎症、动脉粥样硬化、肿瘤等多种生理病理过程的研究被不断报道,尤其是其在肿瘤的发生、侵袭和转移方面成为国内外研究的热点之一。对ADAMTS家族成员功能结构及其与肿瘤关系的研究能够帮助发现肿瘤特异性标志物及其致病机制,不仅可以早期诊断肿瘤,还能为肿瘤的预后评估提供新的依据。本研究揭示了ADAMTS1和ADAMTS18 mRNA在ESCC组织中表达下调,且与肿瘤的转移、分化具有一定相关性,但其生物学功能和在病理生理活动中发挥的具体作用及其机制还不甚清楚,需进一步深入研究探讨。

