低氧联合GDNF诱导大鼠神经干细胞分化为TH阳性神经元的实验研究
杜 娟,刘昌红,梁 辉,吕晓红
神经干细胞(NSCs)作为干细胞的一种,具有自我更新及多向分化潜能,因此在神经系统疾病的移植治疗过程中,NSCs成为移植细胞的潜在来源。而NSCs的存活、增殖、分化以及迁徙过程均受到局部复杂微环境等因素的影响,氧浓度是NSCs所处微环境中重要的因素之一,且体内多种组织特别是含有干细胞的组织中氧浓度远远低于大气氧浓度[1,2]。
低氧可以影响NSCs的增殖及分化[3],且主要向多巴胺能神经元分化,但影响NSCs向多巴胺能神经元分化的最适低氧浓度尚无定论。本实验利用特定的诱导因子在低氧条件下对NSCs进行诱导分化,从而明确NSCs向多巴胺能神经元分化的最适低氧浓度并获得目的细胞,为神经系统变性疾病的治疗提供了新的思路和方法。
1 材料与方法
1.1 动物 清洁级孕14~16 d Wistar大鼠由吉林大学动物中心提供(SCXK-(Ji)2003-0001)。
1.2 试剂 培养基DMEM/F12,B27(Gibco),碱性成纤维细胞生长因子(bFGF),表皮细胞生长因子(EGF)和胶质细胞源性神经营养因子(GDNF)(Peprotech),FBS(杭州四季青公司),dbcAMP(Santa),兔抗鼠神经元特异性中间丝(Nestin)(武汉博士德公司),兔抗鼠5-溴脱氧尿苷(Brdu)(武汉博士德公司),兔抗鼠络氨酸羟化酶(TH)多克隆抗体(武汉博士德公司),山羊抗兔免疫组化试剂盒(武汉博士德公司),FITC标记山羊抗兔IgG(武汉博士德公司)。
1.3 神经干细胞的体外分离及原代培养 神经干细胞的体外分离与培养 取妊娠14~16 d的Wistar大鼠,给予乙醚吸入麻醉,无菌操作取出胚胎,置于冰浴的无菌磷酸盐缓冲液(PBS)内,分离胚胎中的脑组织,小心剥离脑膜及血管,将取出的脑组织剪成小组织块,加入0.125%胰蛋白酶消化30 min左右,用含10%胎牛血清终止消化, 0.01%DNaseI继续对脑组织消化30 min左右,离心,将离心后的细胞悬浮于干细胞培养基中,培养基包含bFGF 20 ng/ml和EGF 20 ng/ml及DMEM/F12培养基(另含2% B27,HEPES10 mmol/L,谷氨酰胺2 mmol/L,青霉素100 U/ml,链霉素100 U/ml),调整细胞密度至5×105/ml,接种至25 ml培养瓶。在37 ℃饱和湿度、5% CO2/95%空气的二氧化碳培养箱中培养。每2~3 d半量换液一次,7 d传代一次。
1.4 神经干细胞的鉴定 待培养至1 w左右时取细胞悬液1瓶,细胞离心(1000 rmp,5 min)后弃上清,重悬,吸管吹打分离细胞克隆,注意力度要适当均匀,重新细胞计数后以5×104/ml接种于装有细胞爬片的24孔板内,进行Nestin及Brdu鉴定。
1.5 不同低氧浓度下GDNF体外诱导NSCs 各实验组均应用冻存的第3代细胞,保证细胞的同源性。细胞复苏步骤如下:冻存管置于39 ℃~40 ℃水浴摇晃,1 min内融化;吸入离心管,加培养液至10 ml,轻轻混匀,离心(1000 rmp,5 min)后弃上清,重悬,重新细胞计数后以5×105/ml接种于25 cm2培养瓶内,继续常规培养。实验分组:实验组A常氧环境下(20%氧气)GDNF诱导组;实验组B 10%氧气环境下GDNF诱导组;实验组C 5%氧气环境下GDNF诱导组;实验组D 3%氧气环境下GDNF诱导组;实验组E 1%氧气环境下GDNF诱导组实验组A取出第3代冻存细胞复苏后培养1 w左右培养瓶内细胞悬液,细胞离心(1000 rmp,5 min)后弃上清,重悬,吸管吹打分离细胞克隆,注意力度要适当均匀,重新细胞计数后以5×104/ml密度接种于装有细胞爬片的24孔板内,每孔1.5 ml,以GDNF20 μg/L(每孔需分别添加GDNF储存液15 μ)进行诱导,共8孔,另外8孔添加等量PBS,24 h后加5-FU(每孔需分别添加5氟尿嘧啶储存液1.5 μl),每2~3 d半量换液,7 d后终止诱导,进行TH细胞鉴定。实验组B、实验组C、实验组D、实验组E均在不同氧浓度的缺氧培养箱中进行,余处理相同。
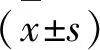
2 实验结果
2.1 孕14 d~16 d wistar大鼠无血清培养 应用无血清培养液培养神经干细胞,24 h可见大部分细胞分裂成3~4个的细胞球,且悬浮生长,随着时间推移,细胞球体积逐渐增大,数量增多,折光性较好,球体形状规则,5~6 d时少量神经球贴壁生长,并向外伸出突起。
2.2 Nestin鉴定 收集传代至第3代的神经干细胞培养至1 w左右时制作细胞爬片,进行免疫细胞化学染色鉴定,结果示神经球呈现棕黄色,而对照组基本无着色,差异明显,表明细胞具备干细胞特性。
2.3 Brdu鉴定 收集细胞前24 h给予Brdu,后制作细胞爬片,行免疫细胞化学染色,结果示神经球呈现棕黄色,而对照组基本无着色,差异明显,表明细胞具备干细胞增殖分化的能力。
2.4 不同氧浓度下GDNF诱导神经干细胞分化 在常氧、1%O2、3%O2、5%O2、10%O2环境下加入GDNF20 μg/L,分化1 w时平均阳性率分别为9.78%、14.56%、25.54%、14.17%、11.10%。1%O2、3%O2、5%O2组与常氧对照组相比较具有显著统计学差异(P<0.01);10%O2组与常氧对照组相比较无统计学差异;3%O2组与1%O2组、5%O2组相比较具有显著统计学差异(P<0.01),而1%O2组与5%O2组相比较无统计学差异,即在3%O2浓度下神经干细胞向多巴胺能神经元分化比率最高(见表1、图1)。

表1 不同氧浓度下GDNF诱导分化后多巴胺能神经元比率

不同氧浓度组与对照组相比*P<0.01
3 讨 论
传统观点认为,中枢神经系统的神经细胞是一种终末细胞。在神经系统疾病中,大部分病理过程如创伤、中毒及缺血缺氧等引起的神经元丢失都是不可逆的。因此,神经干细胞移植成为颇具前景的治疗手段,而充足、安全、可靠的NSCs是细胞移植的前提。有研究显示,运用细胞移植治疗相关神经系统疾病时,向疾病模型移植入向特定神经元方向分化的NSCs比移植入未分化的NSCs症状改善明显[4]。
目前,大部分NSCs培养均在常氧环境下进行,即与大气中氧浓度(21%,160 mmHg)相同,但NSCs在生物体内所处氧环境并非如此。如骨髓间充质干细胞所处的微环境中氧浓度约为1%~7%。已有大量研究显示,低氧可以促进神经干细胞增殖[5,6],对抗其凋亡[7],对其分化方向也有一定诱导作用,且主要向多巴胺能神经元分化[8]。低氧环境下获得足够的多巴胺能神经元也一度成为研究的热点,但既往的研究大部分在3%氧浓度环境下进行,但对于NSCs向多巴胺能神经元分化的最佳低氧浓度尚无系统研究。本实验着重研究NSCs向多巴胺能神经元分化的最佳低氧浓度。本实验中设立21%、10%、5%、3%、1%5个氧浓度梯度,结果显示在10%氧浓度时NSCs向多巴胺能神经元分化率与常氧组相比无明显提高;5%及更低氧浓度时NSCs向多巴胺能神经元分化率明显提高,与常氧组相比实验结果具有显著统计学意义,但各低氧组之间比较分化率与氧浓度梯度无线性相关性;3%O2组与1%O2组、5%O2组相比具有显著统计学差异(P<0.01),而1%O2组与5%O2组比较无统计学差异,即在3%O2浓度下神经干细胞向多巴胺能神经元分化比率最高。分析原因,可能是因为3%的氧浓度更易于启动神经干细胞向多巴胺能神经元分化的各项调控机制。而Studer L的研究中,低氧组NSCs向多巴胺能神经元分化率高达56%,后期研究很少能达到该比例,最主要的原因可能为取材部位不同,NSCs在胚胎脑组织中很多区域均有分布,而不同区域的NSCs分化时也有不同趋向,特别是胚胎后期,NSCs的多向分化潜能下降,更易向特定类型的神经元分化,例如中脑来源的NSCs更易分化为TH阳性神经元[9]。另外,低氧可以促进NSCs增殖,故增殖期低氧可增加NSCs基数,也有研究显示,低氧状态下延长增殖时间可以增加人类胚胎中脑前体细胞向TH阳性神经元的分化[10],故低氧处理时间及处理阶段、统计学处理不同也可以导致结果的差异较大。
低氧促进NSCs分化为多巴胺能神经元的机制非常复杂,目前研究所得结论主要集中于以下几方面。首先,低氧可以促进NSCs中某些细胞因子的合成。在此过程中,HIF-1在细胞表型及功能特征方面起决定性作用。HIF-1是氧浓度对神经干细胞增殖及分化调节过程中重要的细胞因子,有α和β两个亚基。HIF-1α是调节细胞缺氧适应过程中重要的转录激活因子,在多数细胞和组织中,其含量很低,在胞质内处于失活状态;但是在缺氧条件下其含量则升高,可被激活并转移到细胞核并与HIF-1β形成HIF-1 分子,识别并结合包含有低氧反应元件的DNA序列[11]。其次,低氧引起基因水平的改变。低氧状态下,Wnt通路在NSCs分化为多巴胺能神经元过程中起重要作用[12],同源异形盒转录因子Eng railed(En)家族成员En1和En2在后期维持中脑DA能神经元方面起重要作用,而Wnt1 能促进二者在大脑黑质和腹侧被盖区表达。在多巴胺能神经元的成熟方面,低氧促进mRNA表达更多的EPO和P27,而这些也影响神经细胞的分化,同时,Nurr1和Pitx3以及DA相关转运RNA的表达也上调,而这些与多巴胺能神经元的成熟有关。有研究显示,在3%~5%条件下培养出的多巴胺能神经元具有更多的突起,且突起较正常氧条件下更长,表型更成熟[13]。另外,在低氧条件下,D3和D4型突触后多巴胺受体的转录也会受影响。此过程中,可能涉及慢反应缺氧敏感的转录因子参与[14]。细胞因子和基因水平的调控密不可分,HIF-1α缺失会使Wnt/β-catenin信号通路受抑制,从而使干细胞的增殖、分化及成熟受累[15]。HIF-1还可以结合酪氨酸羟化酶mRNA启动子,进一步调控酪氨酸羟化酶基因的表达,从而使酪氨酸羟化酶的合成增加。第三,低氧本身减轻了氧化应激效应[16],对NSCs起到保护作用,减少其凋亡的同时促进其增殖,从而增加了NSCs向多巴胺能神经元分化的基数。当然,分化出的多巴胺能神经元是否成熟,功能如何,能否分泌多巴胺,这些需进一步研究,本研究旨在低氧对NSCs分化方向的影响。另外,GDNF是1993年Lin等发现的一种神经营养因子,是转化生长因子家族中的一员。主要分布于中枢神经系统中脑多巴胺区域,GDNF不仅在神经干细胞分化为多巴胺能神经元中起着重要作用,而且对多巴胺能神经元也具有营养、支持、保护和修复作用[17]。曾有研究显示GDNF诱导人类神经元祖细胞分化后,TH阳性细胞比例达50%,对照组分化比例仅为2.9%(P<0.05)[18]。本实验中低氧联合GDNF诱导NSCs分化为多巴胺能神经元的比例最高仅达30%,分析可能与取材部位、GDNF来源及剂量、诱导分化时间不同有关。
氧浓度对NSCs增殖和分化的研究使得干细胞学科更加完善和深入,并且必将推动神经干细胞移植治疗的进一步发展,尤其是在缺血缺氧性脑卒中中的应用与研究。虽然低氧条件下的NSCs培养实验已取得一定进展,但仍存在很多的未知,这需要我们进一步的研究。

