氮素和光照对甜菊生长、氮素吸收和甜菊糖苷相关指标的影响
孙玉明,张 婷,徐晓洋,张永侠,杨永恒,原海燕
〔江苏省中国科学院植物研究所(南京中山植物园),江苏 南京 210014〕
甜菊(SteviarebaudianaBertoni),又名甜叶菊,为菊科(Asteraceae)多年生草本植物,因其叶片中含有的甜菊糖苷具有高甜度、低热量的特性而备受关注[1]。氮素和光照是影响植物生长发育和生理代谢过程的关键环境因子,在作物产量和品质形成中发挥重要作用。氮素作为植物体内氨基酸、蛋白质以及光合同化酶的主要组成成分,可以促进甜菊叶片的光合速率及叶片干质量形成[2-3]。氮素还会影响甜菊叶片中甜菊糖苷含量,如Tavarini等[4]报道,甜菊叶片中不同甜菊糖苷的含量随着施氮量的增加而逐渐升高;杨永恒等[5]认为,随着施氮量的增加,甜菊叶片总甜菊糖苷含量先升高后降低;而Sun等[2]和包亚英等[6]的研究则发现氮素会抑制甜菊糖苷的合成。因此,目前关于氮素对甜菊糖苷的影响尚没有明确结论。光照强度也会影响甜菊生长及叶片品质。与正常光照相比,弱光处理会推迟甜菊的生育进程并抑制叶片单株干质量形成[7]。曾小燕[8]发现,甜菊叶片中的游离氨基酸和蛋白质含量随着光照强度的降低先升高后降低,但是甜菊糖苷含量对光照强度的响应不敏感。但目前鲜有研究关注光照和氮素的互作对甜菊生长和甜菊糖苷含量影响。
本研究选取2个遗传背景完全不同的甜菊品种‘守田3号’(‘Shoutian No.3’)和‘中山8号’(‘Zhongshan No.8’)作为研究对象,比较不同氮素和光照条件下2个甜菊品种生长、氮素吸收以及甜菊糖苷含量和积累量的变化,旨在明确氮素和光照调控甜菊生长及甜菊糖苷含量的生理机制,为高产优质甜菊的栽培管理提供理论指导。
1 材料和方法
1.1 材料
供试材料为甜菊品种‘守田3号’(引自日本)和‘中山8号’(江苏省中国科学院植物研究所自主选育)的1年生扦插苗,栽种于江苏省中国科学院植物研究所甜菊种植资源圃。供试土壤取自林下,土壤中有机质含量27.22 mg·g-1、全氮含量1.53 mg·g-1、速效磷含量63.97 mg·g-1、速效钾含量347.72 mg·g-1,pH 6.72。实验在江苏省中国科学院植物研究所温室进行。
1.2 方法
1.2.1 实验设计 采用双因素随机区组设计。设置不施氮(N0)和施氮(N)2个处理。每盆装土约12.5 kg,参考文献[2],每盆磷肥和钾肥用量分别为4.16 g过磷酸钙(P2O5含量12%)和0.7 g氯化钾(K2O含量60%),装盆时一次性施入。施氮处理每盆氮肥用量为3.63 g尿素(总氮含量大于等于46%),分别于装盆时(5月24日)和移栽后约1个月(6月20日)各施入50%。每个氮素处理再设置正常光照(LN)和弱光(LW)2个处理。正常光照处理为日光光照,光照强度约为1 000 μmol·m-2·s-1;弱光处理在盆栽上方搭建黑色中性尼龙网遮光,光照强度约为250 μmol·m-2·s-1。于5月25日移栽甜菊扦插苗,每盆3株,每处理4盆(记为4次重复)。于7月1日开始弱光处理,连续处理2周后于7月15日(移栽后50 d)从每盆中随机选取1株进行各项指标的测定。
1.2.2 指标测定方法
1.2.2.1 样品采集 距甜菊茎基部2 cm处收割后带回实验室,用蒸馏水清洗样品后将叶片和茎分离。将每株甜菊所有叶片在标尺背景下拍照并使用Image J软件(Image-Pro Plus 6.0)统计叶面积。然后分别于105 ℃烘箱中杀青30 min,再于70 ℃烘干至恒质量,使用JJ1000型百分之一电子天平(常熟市双杰测试仪器厂)分别称取干质量,然后计算甜菊的单株地上部干质量(单株叶片干质量和单株茎干质量之和)、叶茎比(单株叶片干质量与单株茎干质量的比值)和比叶质量(单株叶片干质量与单株叶面积的比值)。
1.2.2.2 叶片叶绿素相对含量(SPAD)测定 使用SPAD-502便携式叶绿素测定仪(日本柯尼卡美能达公司)测定完全展开新叶的SPAD值。每枚叶片随机选取6个点(避开叶脉)测定,计算平均值。
1.2.2.3 氮素含量测定 参考文献[9],将干样磨碎后,准确称取0.05 g样品,采用H2SO4-H2O2法高温消解,定容后使用KDY-9820凯氏定氮仪(北京瑞邦兴业科技有限公司)通过凯氏定氮法测定消化液中的氮素浓度。甜菊各部位中氮素的含量、单株积累量以及分配比例分别根据以下公式进行计算:某部位氮素含量=某部位氮素浓度×消化液体积/样品质量;单株某部位氮素积累量=某部位氮素含量×单株该部位干质量;某部位氮素分配比例=(单株某部位氮素积累量/单株各部位氮素积累量之和)×100%。
1.2.2.4 叶片中甜菊糖苷的提取和测定 称取甜菊叶片样品约0.1 g,参考文献[2]提取甜菊糖苷,使用LC-100高效液相色谱仪(包括紫外检测器和色谱工作站)(上海伍丰科学仪器有限公司)测定甜菊糖苷含量。色谱柱为Hypersil-NH2(4.6 mm×250.0 mm,5 μm)(大连依利特分析仪器有限公司),工作温度25 ℃,波长210 nm,进样量10 μL。流动相为乙腈-磷酸缓冲液(体积比32∶68),流速1 mL·min-1。
分别称取甜菊苷、莱鲍迪苷A和莱鲍迪苷C标准品(日本和光纯药工业株式会社,纯度均大于99.0%),用甲醇(色谱级)分别配置质量浓度0.1、0.2、0.4、0.6、0.8和1.0 mg·mL-1标准品溶液,采用上述色谱条件分别测定3种标准品溶液中各甜菊糖苷含量。以标准品浓度为纵坐标(y)、峰面积为横坐标(x)绘制标准曲线。甜菊苷、莱鲍迪苷A和莱鲍迪苷C的标准曲线方程分别为:y甜菊苷=0.000 2x-0.045 0;y莱鲍迪苷A=0.000 3x-0.057 3;y莱鲍迪苷C=0.000 24x-0.053 00。通过标准曲线方程换算样品提取液中的甜菊糖苷浓度。各甜菊糖苷含量、总甜菊糖苷含量和单株总甜菊糖苷积累量分别根据下列公式进行计算:某甜菊糖苷含量=〔(某甜菊糖苷浓度×样品提取液体积/样品质量)/10〕×100%;总甜菊糖苷含量=甜菊苷含量+莱鲍迪苷A含量+莱鲍迪苷C含量;单株总甜菊糖苷积累量=(总甜菊糖苷含量×单株叶片干质量/100)×1 000。
1.2.2.5 叶片可溶性糖含量测定 参考王学奎[10]的方法测定叶片样品中的可溶性糖含量。
1.3 数据分析
采用EXCEL 2010软件进行数据处理,采用SPSS 16.0软件进行方差分析,采用Duncan’s多重范围检验进行多重比较。
2 结果和分析
2.1 氮素和光照对2个甜菊品种生长和叶片叶绿素相对含量(SPAD)的影响
氮素和光照对2个甜菊品种生长指标和叶片SPAD值的影响见表1。由表1可见:正常光照处理下,与不施氮处理相比,施氮处理下2个甜菊品种单株叶片干质量、单株茎干质量、单株地上部干质量、单株叶面积和叶片SPAD值显著升高,叶茎比和比叶质量显著或不显著降低;弱光处理下,与不施氮处理相比,施氮处理下2个甜菊品种单株叶面积和叶片SPAD值显著升高,比叶质量显著降低,其他指标无显著变化。
由表1还可见:同一氮素处理下,与正常光照处理相比,弱光处理下甜菊品种‘守田3号’单株叶片干质量、单株茎干质量、单株地上部干质量、叶茎比、单株叶面积、比叶质量和叶片SPAD值总体上显著降低。施氮处理下,与正常光照处理相比,弱光处理下甜菊品种‘中山8号’上述指标显著降低;而不施氮处理下,与正常光照处理相比,弱光处理下甜菊品种‘中山8号’叶茎比和比叶质量显著降低,其他指标无显著变化。
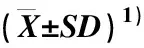
表1 氮素和光照对2个甜菊品种生长指标和叶片叶绿素相对含量(SPAD)的影响
方差分析结果显示:氮素和光照对甜菊上述生长指标和叶片SPAD值有显著或极显著影响。氮素与光照的互作对甜菊单株叶片干质量、单株茎干质量、单株地上部干质量和单株叶面积有极显著影响,而对叶茎比、比叶质量和叶片SPAD值无显著影响。氮素与品种的互作以及光照与品种的互作对甜菊叶茎比、单株叶面积、比叶质量和叶片SPAD值有显著或极显著影响,而对单株叶片干质量、单株茎干质量、单株地上部干质量无显著影响。氮素、光照与品种的互作对甜菊单株叶片干质量和单株叶面积有极显著影响。
2.2 氮素和光照对2个甜菊品种氮素含量、积累量及分配比例的影响
氮素和光照对2个甜菊品种氮素含量、积累量及分配比例的影响见表2。由表2可见:同一品种和光照处理下,与不施氮处理相比,施氮处理下2个甜菊品种叶片和茎中氮素含量分别升高了5.3%~26.4%和5.8%~35.6%,总体上差异达显著水平。同一品种和氮素处理下,与正常光照处理相比,弱光处理下2个甜菊品种叶片中氮素含量升高了20.7%~42.5%,差异达显著水平。不施氮处理下,与正常光照处理相比,弱光处理下2个甜菊品种茎中氮素含量显著升高;但施氮处理下,与正常光照处理相比,弱光处理下2个甜菊品种茎中氮素含量无显著变化。
由表2还可见:同一品种和光照处理下,与不施氮处理相比,施氮处理下2个甜菊品种单株叶片和茎中氮素积累量分别升高了71.4%~243.8%和72.9%~323.1%。而同一品种和氮素处理下,与正常光照处理相比,弱光处理下甜菊单株叶片和茎中氮素积累量有不同程度的降低。
由表2还可见:同一光照处理下,与不施氮处理相比,施氮处理下甜菊品种‘守田3号’叶片氮素分配比例显著降低,茎氮素分配比例显著升高;甜菊品种‘中山8号’叶片和茎的氮素分配比例无显著变化。同一品种和氮素处理下,与正常光照处理相比,弱光处理下2个甜菊品种叶片氮素分配比例有不同程度的降低,茎氮素分配比例则有不同程度的升高。此外,在同一氮素和光照处理下,甜菊品种‘中山8号’叶片氮素分配比例高于甜菊品种‘守田3号’,而其茎氮素分配比例低于甜菊品种‘守田3号’。
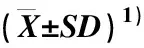
表2 氮素和光照对2个甜菊品种氮素含量、积累量及分配比例的影响
方差分析结果显示:氮素和光照对甜菊叶片和茎的氮素含量、单株氮素积累量和氮素分配比例有显著或极显著影响。氮素与光照的互作对甜菊叶片和茎的单株氮素积累量有极显著影响,但是对叶片和茎的氮素含量和氮素分配比例无显著影响。氮素与品种的互作对甜菊叶片中氮素含量和单株总氮积累量以及叶片和茎的氮素分配比例有显著或极显著影响,光照与品种的互作仅对甜菊叶片中氮素含量有显著影响。氮素、光强与品种的互作对甜菊上述指标均无显著影响。
2.3 氮素和光照对2个甜菊品种叶片中甜菊糖苷含量和积累量以及可溶性糖含量的影响
氮素和光照对2个甜菊品种叶片中甜菊糖苷含量和积累量以及可溶性糖含量的影响见表3。由表3可见:同一品种和光照处理下,与不施氮处理相比,施氮处理下2个甜菊品种叶片中甜菊苷、莱鲍迪苷A、莱鲍迪苷C和总甜菊糖苷的含量分别降低了16.6%~31.8%、8.9%~28.4%、7.1%~17.5%和14.5%~27.0%。同一氮素处理下,与正常光照相比,弱光处理下甜菊品种‘守田3号’叶片中3种甜菊糖苷含量和总甜菊糖苷含量无显著变化。不施氮处理下,与正常光照处理相比,弱光处理下甜菊品种‘中山8号’叶片中甜菊苷、莱鲍迪苷A和总甜菊糖苷的含量显著降低,莱鲍迪苷C含量无显著变化;施氮处理下,与正常光照处理相比,弱光处理对甜菊品种‘中山8号’叶片中3种甜菊糖苷含量和总甜菊糖苷含量无显著影响。此外,同一光照和氮素处理下,与甜菊品种‘守田3号’相比,甜菊品种‘中山8号’叶片中甜菊苷含量较高而莱鲍迪苷A含量较低,但是2个甜菊品种叶片中莱鲍迪苷C含量接近。
由表3还可见:正常光照处理下,与不施氮处理相比,施氮处理下2个甜菊品种单株总甜菊糖苷积累量显著升高;弱光处理下,与不施氮处理相比,施氮处理对2个甜菊品种单株总甜菊糖苷积累量的影响不显著。同一品种和氮素处理下,与正常光照处理相比,弱光处理下甜菊单株总甜菊糖苷积累量降低了64.5%~73.5%,差异达显著水平。
由表3还可见:同一品种和氮素处理下,与正常光照处理相比,弱光处理显著降低了甜菊品种‘中山8号’叶片中可溶性糖含量,但是对甜菊品种‘守田3号’叶片中可溶性糖含量无显著影响。正常光照处理下,与不施氮处理相比,施氮处理下2个甜菊品种叶片中可溶性糖含量显著降低;弱光处理下,与不施氮处理相比,施氮处理对2个甜菊品种叶片中可溶性糖含量无显著影响。
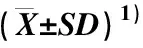
表3 氮素和光照对2个甜菊品种叶片中甜菊糖苷含量和积累量以及可溶性糖含量的影响
方差分析结果显示:氮素对甜菊叶片中3种甜菊糖苷含量、总甜菊糖苷含量和可溶性糖含量以及单株总甜菊糖苷积累量有显著或极显著影响;光照对甜菊苷含量和可溶性糖含量以及单株总甜菊糖苷积累量有极显著影响。氮素与光照的互作对甜菊叶片中甜菊苷、莱鲍迪苷A、总甜菊糖苷和可溶性糖的含量以及单株总甜菊糖苷积累量有显著或极显著影响,对莱鲍迪苷C含量无显著影响。氮素与品种的互作仅对甜菊叶片中甜菊苷含量有显著影响,光照与品种的互作对甜菊苷、总甜菊糖苷和可溶性糖的含量有极显著影响,氮素与品种以及光照与品种的互作对莱鲍迪苷A和莱鲍迪苷C的含量以及单株总甜菊糖苷积累量无显著影响。氮素、光照与品种的互作对甜菊叶片中甜菊苷和可溶性糖的含量有显著影响。
3 讨论和结论
氮素和光照是影响植物叶片光合速率的关键环境因子,缺氮或弱光条件下,植物叶片光合速率及叶绿素荧光效率显著降低,植物的干质量形成受到抑制[11-12]。本研究中,与正常光照或施氮处理相比,弱光及不施氮处理下甜菊品种‘中山8号’和‘守田3号’单株叶片干质量、单株茎干质量和叶片叶绿素相对含量总体上显著降低。比叶质量和叶茎比是衡量植物响应环境变化的重要指标。Poorter等[13]研究认为,低光照水平会导致植物的干质量更多地向茎分配,而营养缺乏则会降低干质量向叶片分配的比例。Yao等[14]的研究结果表明:棉花(GossypiumhirsutumLinn.)可以通过调整比叶质量优化冠层对光照和氮素的利用效率。本研究中,弱光和氮素处理均会影响甜菊的叶茎比和比叶质量,甜菊通过改变自身干质量的分配比例和叶片形态适应外界环境变化[15]。
氮素是核酸、蛋白质及酶的关键组成成分,参与植物生长发育的各个环节,植物体内的氮素含量及积累特征是影响干质量的关键因子[16-17]。本研究中,与正常光照相比,弱光处理下2个甜菊品种叶片和茎中氮素含量总体上显著升高,这可能与弱光条件下植物生长受阻造成的氮素“浓缩效应”[18]有关。施氮可以缓解弱光对植物生长的抑制作用[12,19]。本研究中,弱光处理下,施氮处理下甜菊的干质量和氮素含量较不施氮处理升高,说明适当增施氮肥能有效调节植物在弱光条件下的氮素吸收和生长发育。
总体上看,施氮处理下2个甜菊品种叶片中甜菊糖苷含量较不施氮处理显著降低,弱光处理下甜菊糖苷含量与正常光照处理相比无显著变化,与前人的研究结果[2,6,8]一致。Yoneda等[20]的研究表明:光质变化会显著影响甜菊糖苷合成,但是光照强度的改变对KO、UGT85C2、UGT74G1和UGT76G1等甜菊糖苷合成关键基因的表达并无显著影响。值得注意的是,不施氮处理下,弱光处理下甜菊品种‘中山8号’叶片中总甜菊糖苷含量较正常光照处理显著降低,说明不同甜菊品种的光敏感性存在差异,且施氮可以缓解弱光处理对甜菊糖苷合成的抑制作用。
施氮和弱光处理下,2个甜菊品种叶片中可溶性糖含量的变化趋势与总甜菊糖苷含量基本一致,表明氮素可能通过影响甜菊体内的碳代谢以及糖酵解过程调控甜菊糖苷合成底物的含量[21]。此外,对海滨木巴戟(MorindacitrifoliaLinn.)[22]和丹参(SalviamiltiorrhizaBunge)[23]的研究结果也显示:适量喷施蔗糖能有效提高植物体内碳基次级代谢产物的合成,进一步证明糖代谢在甜菊糖苷合成调控中具有重要作用。
在实际生产中,与单一的甜菊产量或叶片品质相比,甜菊叶片中总甜菊糖苷积累量最终决定其经济价值。本研究中,与正常光照和施氮处理相比,弱光或不施氮处理总体上显著降低了甜菊单株总甜菊糖苷积累量。此外,甜菊单株总甜菊糖苷积累量的变化与单株叶片干质量的变化更为接近,而与总甜菊糖苷含量的变化不同,推测造成这种现象的主要原因是植物“生长-分化/防御平衡”的内在调控机制。植物处于不利环境时,由于自身资源的限制,通过一系列的调控机制介导生长和分化之间的平衡[24-25]。弱光处理下,植物倾向于提高次级代谢而抑制植物生长,从而提高其防御和生存能力;反之,尽管施氮提高了甜菊的叶片干质量,但抑制了甜菊糖苷的合成。
综上所述,供试2个甜菊品种的干质量和氮素含量均受光照和氮素水平的影响,而叶片甜菊糖苷含量主要受氮素水平的调控。此外,甜菊叶片甜菊糖苷含量与可溶性糖含量的变化有关。在甜菊的栽培生产过程中,应根据甜菊品种特性进行氮素和光照管理,从而获取高产优质的甜菊叶片。

