轻症COVID‐19患儿流行病学和临床特征分析
田继东 谢敏 温在驰 徐军美 文川
(中南大学湘雅二医院 1.儿童医学中心;2.麻醉科, 湖南长沙 410011)
2019年12月,中国武汉市暴发了由严重急性呼吸综合征冠状病毒‐2(severe acute respiratory syndrome coronavirus‐2, SARS‐CoV‐2) 所致的2019‐冠状病毒病(coronavirus disease 2019,COVID‐19),快速传播并扩散至中国的其他地区[1‐3]。为了有效控制疫情扩散,根据中国政府的决定,中南大学湘雅二医院国家紧急医学救援队运行并管理了中国武汉市第一所方舱医院——武汉武昌方舱医院,救治确诊的轻症COVID‐19患者。截至2021年2月,全世界COVID‐19疫情仍严峻。目前有关儿童COVID‐19的流行病学特征和临床特征的资料仍十分有限[4‐5]。本研究对武昌方舱医院住院的轻症COVID‐19患儿进行了流行病学特征和临床特征分析,并对SARS‐CoV‐2抗体的意义进行了初步探讨。
1 资料与方法
1.1 研究对象
武昌方舱医院由武汉洪山体育馆临时改建而成,负责治疗政府分配的在社区医院确诊的轻症COVID‐19患者。本研究以该院2020年2月5日至3月10日收治的≤18岁儿童患者为研究对象。本研究中所有轻症COVID‐19患儿均按照中国国家卫生健康委员会制定的《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》进行诊断和治疗[6]。随访时间为患儿出院后14 d隔离期结束为止。该病例系列分析获得了中南大学湘雅二医院医学伦理委员会批准(No.LYF2020060)。
1.2 数据采集
通过电子病历系统采集患儿流行病学、临床、实验室和影像学特征数据,并通过电话随访患儿14 d隔离期情况。
1.3 患儿评估
由于方舱医院仅是疫情防控策略形式的一部分,因此方舱医院的实验室检查条件相当有限。患儿入院后仅检测全血细胞计数、C‐反应蛋白(C‐reactive protein, CRP)和肺部 CT。
根据国家卫生健康委员会制定的《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》标准[6],在患儿临床症状消失及肺部CT炎症明显吸收后,采用RT‐PCR方法对患儿呼吸道标本(咽拭子)进行第1次评估:2次SARS‐CoV‐2核酸检测(采样时间间隔至少24 h),并根据患儿或监护人的意愿采用化学发光免疫法检测血清SARS‐CoV‐2 IgM和IgG。
如果第 1 次评估 2 次 SARS‐CoV‐2 核酸检测(采样时间间隔至少24 h)均为阳性,则在7 d后进行第2次评估:2次SARS‐CoV‐2核酸检测(采样时间间隔至少24 h),并根据患儿或监护人的意愿检测SARS‐CoV‐2 IgM和IgG。如果2次评估SARS‐CoV‐2核酸检测均阳性,则转至定点医院进一步治疗。
根据患儿或监护人的意愿,可以多次进行SARS‐CoV‐2 IgM和IgG检测。患儿出院后在14 d隔离期内至少进行2次SARS‐CoV‐2核酸检测(采样时间间隔至少24 h)。
1.4 SARS‐CoV‐2 RT‐PCR 检测
在患儿临床症状消失和肺部CT炎症明显吸收后采集患儿咽拭子样本,然后送到指定的权威实验室检测 SARS‐CoV‐2。采用呼吸道样本 RNA 分离试剂盒(中国武汉中智公司)在 2 h内提取总RNA。在RT‐PCR 检测过程中,同时扩增并检测了两个靶基因,包括开放阅读框 1ab(open reading frame 1ab, ORF1ab)和核衣壳蛋白(nucleoprotein,N)。靶标 1(ORF1ab):正向引物CCCTGTGGG‐TTTTACACTTAA;反向引物ACGATTGTGCATCA‐GCTGA;探 针 5'‐VICCCGTCTGCGGTATGTGGAA‐AGGTTATGGBHQ1‐3'。靶 标 2(N):正向引物GGGGAACTTCTCCTGCTAGAAT;反 向 引 物 CA‐GACATTTTGCTCTCAAGCTG;探针 5'‐FAMTTGCT GCTGCTTGACAGATTTAMRA‐3'。使用 SARS‐CoV‐2核酸检测试剂盒,按照生产商(中国上海伯杰医疗科技有限公司)的方案进行RT‐PCR 检测。扩增的条件是50℃ 15 min,95℃ 3 min,然后是45个循环,分别是95℃ 15 s和60℃ 30 s。循环阈值(Ct 值)低于 37 定义为阳性;Ct 值≥40 定义为阴性;若Ct 值在37~40之间,需要重新检测进行确认。这些诊断标准基于中国病毒病预防控制所的推荐(http://ivdc.chinacdc.cn/kyjz/202001/t20200121_211337.html)。
1.5 化学发光法检测 SARS‐CoV‐2 IgM 和 IgG
采用化学发光法对患儿血清进行SARS‐CoV‐2 IgM和IgG检测。按照生产商(深圳市亚辉龙生物科技公司)试剂盒说明书进行操作。首先加入稀释的患儿血清样本、标本处理液、包被SARS‐CoV‐2抗原的磁珠,形成SARS‐CoV‐2抗原-抗体复合物,然后清洗,再加入标记有鼠抗人 IgM抗体的吖啶酯标记物,与已形成的抗原-抗体复合物共同反应,形成抗原-抗体-二抗复合物,再次清洗,在反应复合物中加入预激发液和激发液,通过相对发光强度测定化学发光反应。测试结果通过产品标准品的校准系数确定。根据试剂盒说明书进行结果判断:血清标本IgM/IgG浓度<10 AU/mL,判定为阴性;如≥10 AU/mL,判定为阳性。
2 结果
2020 年2 月5日至 3 月10 日武昌方舱医院共收治轻症COVID‐19患者(包括儿童和成人)1 124例,其中儿童患者13例,占1.16%,均为武汉市居民。儿童患者中位年龄16岁(范围:10~18岁),男性7例(54%),女性6例(46%)。家庭聚集性发病9例(69%),感染源不详4例(31%)。有明确接触史的9例患儿从接触感染源到发病的平均时间为6.8 d(范围:2~13 d)。有症状患儿6例(46%),主要表现为发热、咳嗽、乏力和肌肉疼痛,这6例患儿从发病到住院的平均时间为9.2 d;仅SARS‐CoV‐2核酸检测阳性的无症状患儿7例(54%)。肺部CT异常4例(31%),其影像学表现为肺野磨玻璃影(2例:病例1和病例9)和斑片状影(2例:病例7和病例12)。无症状并且肺部CT正常患儿6例(46%)。所有患儿血常规及CRP检测均正常。
13例患儿中,8例进行了至少1次SARS‐CoV‐2 IgM 和 IgG 检测,其中 6例 SARS‐CoV‐2 IgM阴性,而 SARS‐CoV‐2 IgG 阳性(2 例 SARS‐CoV‐2 IgG浓度呈动态增高趋势);2例(病例3和病例4)2次SARS‐CoV‐2 IgM和IgG检测均阴性。
11例患儿满足出院标准,2次 SARS‐CoV‐2核酸检测均阴性并出院;2例患儿(病例2和病例12)4次SARS‐CoV‐2核酸检测均阳性,转移至定点医院进一步治疗,后失访。在11例随访患儿中,其中1例(病例1)在隔离点进行2次SARS‐CoV‐2核酸检测均呈阳性,其余10例SARS‐CoV‐2核酸检测均呈阴性。13例患儿平均住院时间为10.9 d(范围:6~18 d)。11例随访患儿均痊愈,生活及学习情况良好。
13例患儿的基本特征和流行病学资料见表1,临床特征见表2。
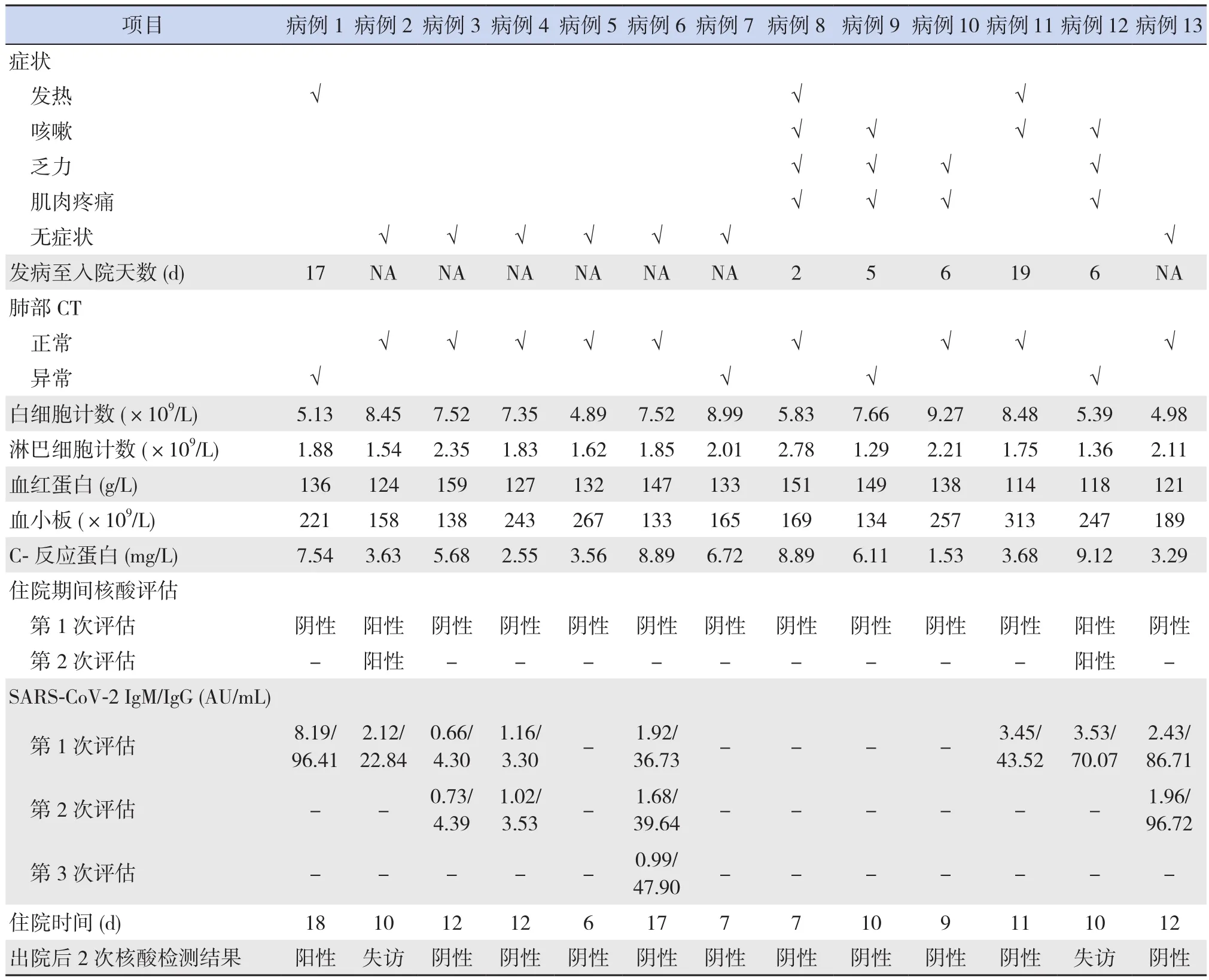
表2 13例患儿的临床特征
3 讨论
随着COVID‐19疫情的全球蔓延和病原学检测工作的快速开展,儿童感染病例报告正逐渐增多,并出现新生儿感染病例[7]。本研究表明,在所有轻症患者中,儿童病例占1.16%,这与相关报道类似[4]。
对于成人COVID‐19患者,可依据流行病学史、症状及影像学表现作出COVID‐19临床诊断。在本研究中,虽然69%的轻症患儿有密切的家庭患者接触史,但31%的轻症患儿感染源不详,需要加强排查潜在感染源,早诊断,早防范。
有研究显示,儿童与普通人群均易被感染SARS‐CoV‐2[8]。近期临床数据分析也表明,所有年龄段的儿童均易感染SARS‐CoV‐2[8]。幼儿,尤其是婴儿更容易被感染,并且没有明显的性别差异[9]。儿童COVID‐19病例的临床症状通常较成人轻[8‐9]。机体对抗病毒的免疫反应决定了患者的临床症状,如果宿主免疫反应迅速而强烈,患者清除病毒前可能不出现症状或只有轻微的症状;如果免疫反应延迟和微弱,患者可能长期成为病毒载体并且没有症状;如果免疫炎症反应产生失控,强烈的炎症反应形成“炎症因子风暴”,造成严重病情,病死率将会明显增高[10]。本研究中,46%的患儿有轻微症状,主要表现为发热、咳嗽、乏力和肌肉疼痛,但54%的患儿无症状,仅SARS‐CoV‐2核酸检测呈阳性。46%的患儿无症状,且肺部CT正常。因此,对有密切接触史的儿童需要及时就诊,早期诊断,以免传播给其他人;对于儿童患者来说,病原学诊断比临床诊断更为重要。
本组病例中转院至定点医院治疗的2例患儿(病例2和病例12)在症状和肺部CT表现方面均满足出院标准[6],但是这2例患儿的2次SARS‐CoV‐2核酸检测评估均阳性,提示在轻症患儿中SARS‐CoV‐2排毒时间长,存在临床表现和SARS‐CoV‐2核酸检测结果不平行的情况。同时,本研究所有患儿的血常规和CRP均正常,表明炎症反应轻微,机体对抗SARS‐CoV‐2时产生的破坏作用小,这也许是SARS‐CoV‐2排毒时间长的原因之一。
随着 SARS‐CoV‐2 IgM 和 IgG 检测试剂盒的快速开发,SARS‐CoV‐2 IgM和IgG已经逐步用于COVID‐19的诊断、预后及康复评价。在本研究中,8例患儿进行了SARS‐CoV‐2 IgM和IgG检测,所有患儿SARS‐CoV‐2 IgM检测均呈阴性,提示8例患儿已进入疾病恢复期;其中病例6和病例13不仅产生SARS‐CoV‐2 IgG并呈现逐渐升高趋势,符合普通病毒感染规律。
由于对SARS‐CoV‐2的自然特性缺乏清楚的认识,并且SARS‐CoV‐2 IgM和IgG检测的累积数据有限,因此,对 SARS‐CoV‐2 IgM 和 IgG 的临床意义有待进一步探讨。(1)在本研究中,病例1满足出院条件而出院,住院期间SARS‐CoV‐2 IgG阳性(96.41 AU/mL),并且患儿从接触家庭COVID‐19患者到入院时已经24 d,但在隔离期SARS‐CoV‐2核酸检测呈阳性。可能原因为:此患儿存在SARS‐CoV‐2间歇排毒情况;或者此患儿处于SARS‐CoV‐2隐性感染状态;或者此患儿SARS‐CoV‐2 IgG处于动态变化之中。(2)本研究中,病例2和病例12住院期间SARS‐CoV‐2 IgG检测呈阳性,但是2次评估SARS‐CoV‐2核酸检测(共4次检测)均阳性,提示机体对SARS‐CoV‐2产生的体液免疫反应可能不显著或产生的SARS‐CoV‐2 IgG对机体尚未产生保护作用。(3)本研究中,病例3和病例4是姐妹关系,其母亲确诊COVID‐19并在武昌方舱医院住院治疗。两患儿在住院期间SARS‐CoV‐2 IgM和IgG检测均阴性,可能与检测时间的选择和患儿免疫功能状态有关。尚需增加连续检测抗SARS‐CoV‐2抗体的次数来解释产生上述现象的可能原因。
综上所述,本研究显示,轻症COVID‐19患儿存在如下特征:接触史多不确定,可能无临床症状;病原学诊断比临床诊断更为重要;临床表现消失和 SARS‐CoV‐2 核酸检测结果不平行,SARS‐CoV‐2排毒时间长,甚至可能出现SARS‐CoV‐2复阳病例;SARS‐CoV‐2 IgM和IgG的产生规律及其对机体的作用需进一步研究。由于方舱医院的医疗资源有限,无法进行淋巴细胞亚群检测、细胞因子测定、抗SARS‐CoV‐2抗体动态检测等,无法探讨这些指标与临床特征之间的相关性,这是本研究的局限性。本研究将有限的儿童COVID‐19病例资料提供给大家,以便大家了解儿童COVID‐19的特征,并引发读者对COVID‐19儿童病例与成人病例表现异同进行深入思考。
利益冲突声明:所有作者均声明不存在利益冲突。

