生物标志物联合创伤评分对创伤后脓毒症的诊断价值
阿米娜·阿不列孜,阿合买提江·帕哈丁,黄扬眉,朱功兵
(1.新疆医科大学第一附属医院急救创伤中心,乌鲁木齐 830000;2.重庆市急救医疗中心,重庆 400014)
每年我国因创伤就医者高达6 200万,其中致死人数70~80万,是45岁以下人群的首要致死原因[1]。严重创伤会导致机体与外界环境直接接触的屏障损伤,增加病原菌入侵的机会,使机体发生感染[2],从而破坏免疫系统的平衡与稳态,导致免疫抑制,并极易并发脓毒症,最终发展为不可逆的多器官功能衰竭[3-4]。脓毒症成为严重创伤后常见并严重的并发症,创伤引起脓毒症的病死率17%~23%[5]。早期快速准确的预测诊断和治疗成为降低脓毒症发病率和病死率的关键[6]。由于创伤后脓毒症发病机制复杂多样且存在个体差异,精确定时的检测是一项艰巨的挑战。脓毒症生物标志物可以帮助预测脓毒症的诊断和预后,并监测治疗反应,但单一的生物标志物难以实现有效诊断及预测,因此可能需要多种生物标志物联合检测协助实现创伤后脓毒症的早发现、早治疗。
近年来,关于创伤后脓毒症预警标志物的基因及分子等层面的相关研究逐渐增多,包括巨噬细胞迁移抑制因子、硫氧还蛋白、可溶性CD14亚型、微小核糖核酸等[7-8]。脓毒症诊断不仅仅基于实验室检测,新的临床研究表明,脓毒症新的定义和损伤严重程度评分(ISS)对脓毒症的早期识别和诊断具有重要意义[9]。多种生物标志物联合检测是创伤后脓毒症研究的一个新方向,也是近年来研究的热点。由于各种生物标志物在诊断及预测创伤患者预后方面存在局限性,本研究前瞻性研究2019年12月—2020年6月新疆医科大学第一附属医院急救创伤中心收治严重创伤患者196例,通过ISS及血液学检查指标联合对创伤患者发展为脓毒症及预后进行预测,探讨评估创伤患者病情危重程度及预后的新思路。
资料与方法
1 一般资料
纳入标准:年龄≥18岁;ISS≥16分;入院后新发出现脓毒症。排除标准:免疫系统缺陷疾病;妊娠及哺乳期妇女;有血液系统疾病和(或)长期使用糖皮质激素;创伤时间超过24h后住院或转院。参照2016年第三次国际脓毒症及脓毒性休克治疗指南定义的脓毒症诊断标准[10]:机体对感染反应失调导致的危及生命的器官功能障碍。发病以远离感染部位的器官功能障碍开始为特征。可疑感染患者+序惯性器官衰竭评分(sequential organ failure assessment score,SOFA)增加2分。
本组收治严重创伤患者196例,男性129例,女性67例;年龄20~94岁,平均49.7岁。致伤原因包括物理性(机械力、高热、电击),化学性(如强酸、强碱及糜烂性毒剂)等。根据脓毒症诊断标准将患者分为脓毒症组(61例)和非脓毒症组(135例),并根据预后结果将脓毒症组分为死亡组(26例)和存活组(35例)。本研究经医院医学伦理委员会批准(K202103-08)。
2 研究方法
收集研究对象基本信息,包括性别、年龄、主诊断、住院时间、ISS、入院时及病情变化时的SOFA及转归情况。创伤患者入院后10min内完成ISS,并在24h内严密监测ISS≥16分的患者,结合病情及其相关重要脏器功能指标持续上升考虑患者此时已有脓毒症高风险。
本研究选取24h内监测此次研究所选择的各项指标,以尽早预防脓毒症发生为目的,并判断各生物标志物在脓毒症发生之前早期的潜在预测价值。患者入院24h内抽取外周血标本并检测T细胞亚群项目(主要包括CD4、CD8、CD4/CD8)、降钙素原(PCT)、白介素-6(IL-6)、乳酸、中性粒细胞、淋巴细胞等。CD4、CD8、CD4/CD8检测采用流式细胞法,使用BD FACS calibur流式细胞仪;PCT、IL-6采用电化学发光法检测,使用罗氏cobas E411电化学发光免疫分析仪;乳酸检测使用强生VITROS 5600全自动生化免疫分析仪;中性粒细胞及淋巴细胞使用希森美康XE5000全自动五分类血细胞分析仪检测。
3 统计学分析
结 果
脓毒症组与非脓毒症组以及死亡组与存活组中,CD4、CD8、CD4/CD8、PCT、IL-6、乳酸、ISS比较差异均有统计学意义(P<0.05)。而年龄仅在死亡组与存活组间有统计学意义(P<0.05)。男性患者在各组占比均高于50%。年龄在脓毒症组与非脓毒症组患者中差异无统计学意义,淋巴细胞及中性粒细胞死亡组与存活组患者比较差异无统计学意义(P>0.05)。
CD8、ISS、PCT、IL-6、乳酸及中性粒细胞数平均水平在脓毒症组和死亡组中均比非脓毒症及存活组高,而CD4、CD4/CD8水平在脓毒症组和死亡组中比非脓毒症组和存活组低,而这种变化在死亡组中较脓毒症组更显著。见表1、2。

表1 创伤后脓毒症组与非脓毒症组患者基本情况比较

组别IL-6(pg/L)乳酸(mmol/L)淋巴细胞(×109/L)中性粒细胞(×109/L)脓毒症组(n=61)369.04±106.813.10±2.421.00±0.5311.95±4.90非脓毒症组(n=135)59.62±77.882.06±1.041.44±0.788.54±4.33检验值Z-5.608-3.054-4.065-5.136P值<0.0010.002<0.001<0.001

表2 创伤后脓毒症死亡组与存活组基本情况比较

组别IL-6(pg/L)乳酸(mmol/L)淋巴细胞(×109/L)中性粒细胞(×109/L)死亡组(n=26)661.79±213.094.09±3.181.09±0.5515.61±4.65存活组(n=35)151.58±136.432.36±1.070.93±0.7615.30±4.66检验值Z值-2.997-2.007-1.240-0.254P值0.0030.0450.2150.081
对脓毒症组与非脓毒症组,死亡组与存活组均有统计学意义的7项指标,即CD4、CD8、CD4/CD8、PCT、IL-6、乳酸、ISS进行Logistic回归单因素分析,结果显示上述7项指标均与创伤后脓毒症有关(P<0.05或P<0.01)。见表3。再进行多因素Logistic回归分析以确定诊断脓毒症的独立因素,分析结果CD4/CD8及ISS是诊断创伤后脓毒症独立影响因素(P<0.01),CD4/CD8值越低,ISS评分越高,患脓毒症的可能性越大。见表4。
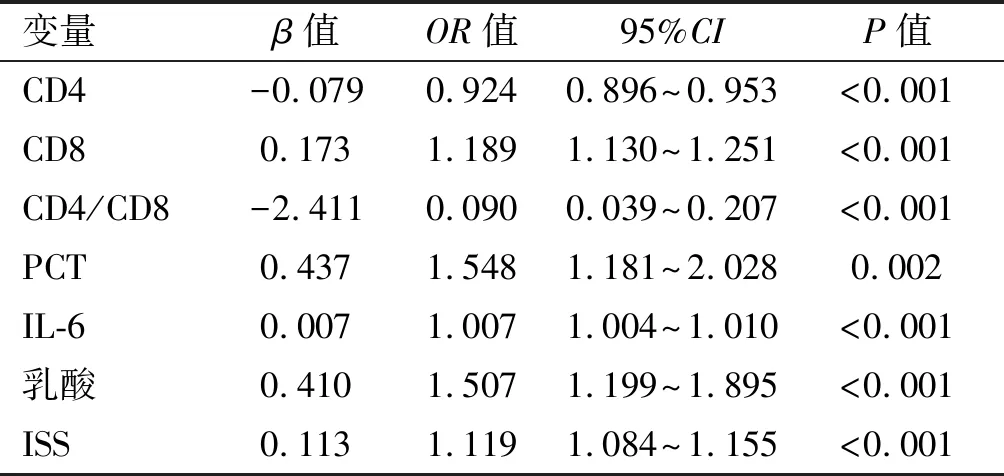
表3 单因素Logistic回归对创伤患者诊断脓毒症的分析
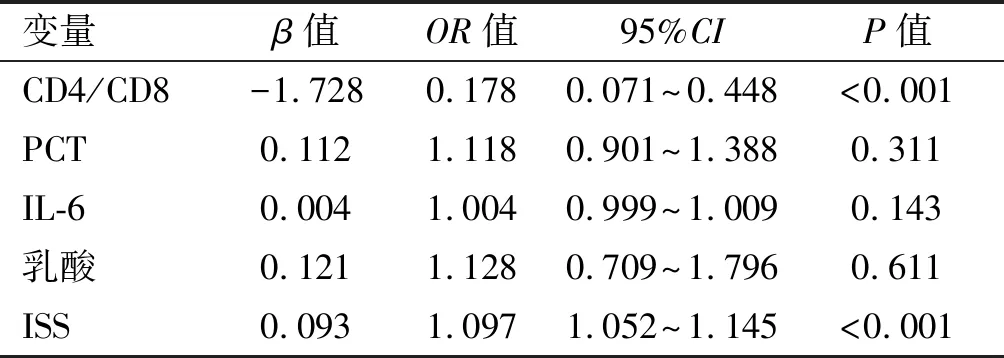
表4 多因素Logistic回归对创伤患者诊断脓毒症的分析
经统计分析可知ISS在各生物标志物单独诊断创伤后脓毒症时的效能最高,ROC曲线下面积AUC 0.866,灵敏度77.05%,特异度80.74%,这可能与此研究中研究对象均为严重创伤患者有关;其次CD4/CD8(AUC=0.847),其灵敏度65.57%,特异度87.41%;第三位PCT(AUC=0.840),灵敏度72.13%,特异度81.48%。而IL-6及乳酸的诊断效能远不及其他生物标志物,其AUC、灵敏度均低于其他生物标志物。笔者从创伤后脓毒症发生发展机制的不同方面选取PCT、ISS及CD4/CD8形成新的组合,检测其联合诊断的效能,ROC曲线下面积AUC=0.927,灵敏度91.80%,特异度81.48%,高于任何生物标志物及评分单独使用时的AUC,且对早期诊断重要的灵敏度及阴性预测值也比单独使用时有明显提高。见表5、图1。
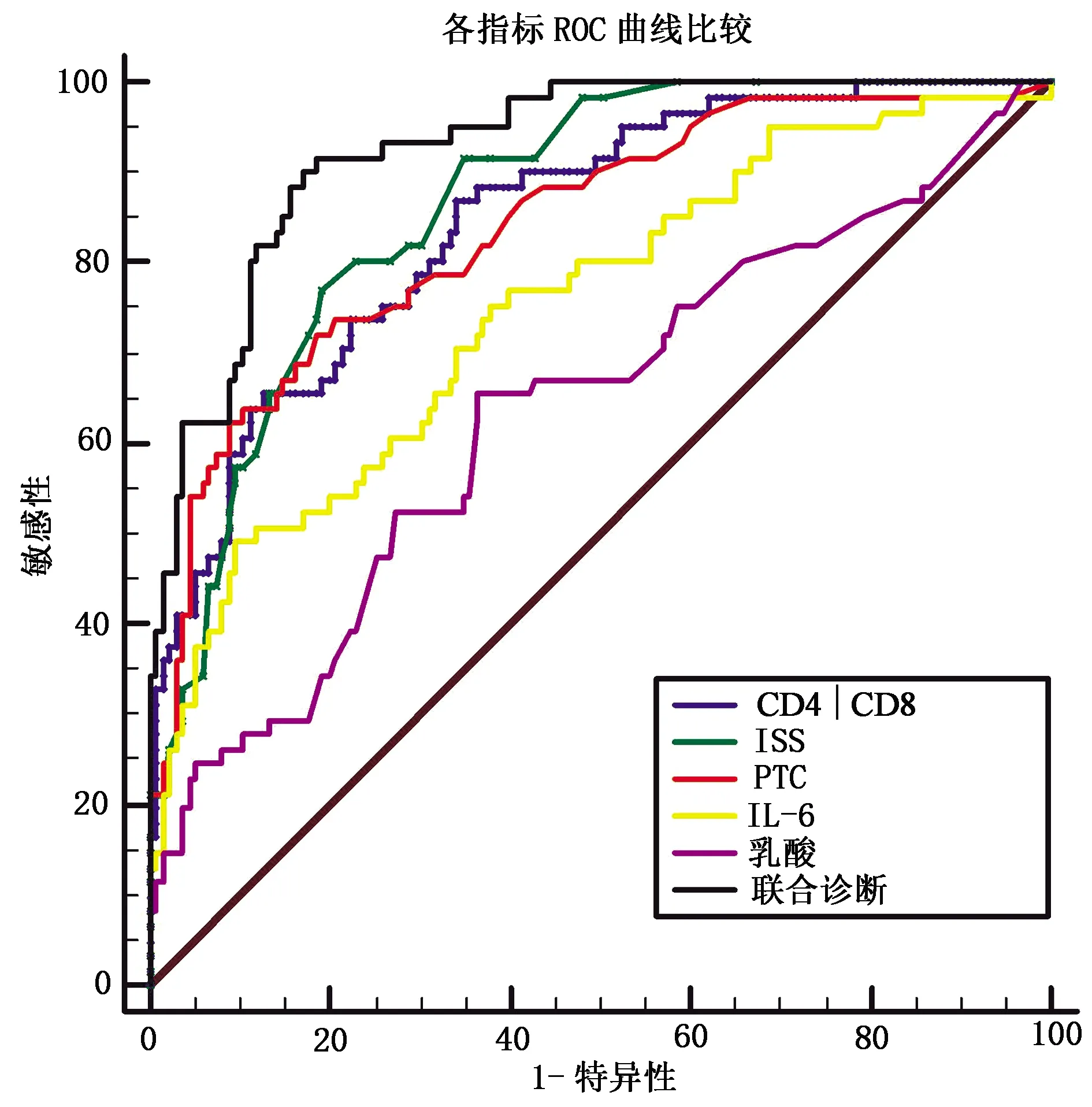
图1 CD4/CD8,PCT,ISS组合和各生物标志物单独诊断脓毒症的ROC曲线

表5 各项生物标志物及评分单独与联合诊断创伤后脓毒症的诊断效能比较
通过多因素Logistic回归分析创伤后脓毒症死亡患者26例的预后影响因素,结果提示ISS为创伤后脓毒症患者死亡的独立危险因素(P<0.05)。其OR值0.199,95%CI为1.015~1.466,反映ISS越高,创伤患者死亡风险越大。见表6。
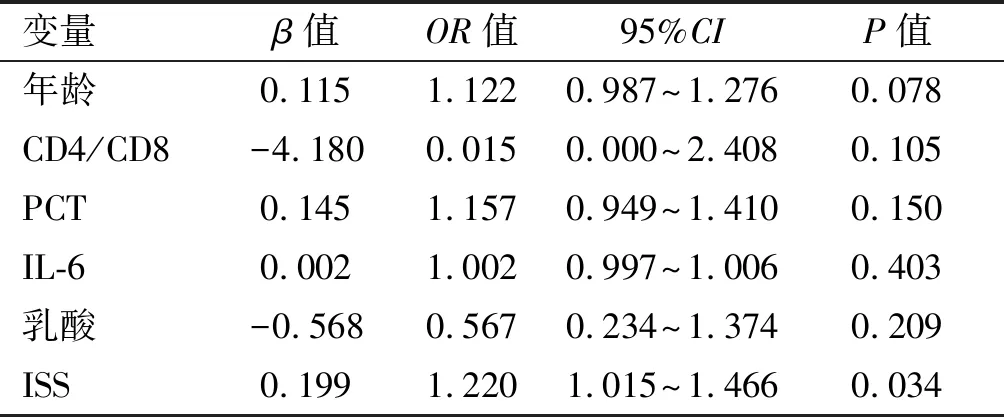
表6 多因素Logistic回归对创伤性脓毒症患者死亡的分析
讨 论
严重创伤患者初始复苏后因创伤后并发症在院内病死率较高,因为创伤后诱发的早期急性应激及随之而来的炎症反应和免疫异常等事件的进行性发展,最终导致不可逆的器官衰竭直至死亡,因此快速、准确、有效地诊断创伤后脓毒症对改善病情及预后有着非常重要的作用。
创伤患者对脓毒症易感性最重要的特征之一是免疫平衡紊乱导致持续的免疫抑制[11]。脓毒症复杂的免疫学改变领域的新研究表明,持续的免疫抑制是脓毒症高病死率的关键决定因素。其免疫抑制特点是T细胞分化和功能障碍,循环中CD4+T淋巴细胞数量的减少及其向Th2表型的转变为特征的获得性免疫系统抑制并伴有先天性免疫系统激活[12-14]。一旦设法获得创伤后的免疫抑制和免疫刺激过程的详细特征,以及能够区分患者免疫状态的特定生物标志物,就意味着可以结合创伤后脓毒症患者的免疫状态以及创伤程度的个体差异来进行个体化治疗[13]。T淋巴细胞被认为是宿主对脓毒症反应的有效早期介体,在先天及获得性免疫中扮演重要的角色[14]。它们在创伤后炎症反应中发挥着重要但尚未具有深刻特征的作用,因此可能也是创伤后免疫抑制程度的重要决定因素[15]。T淋巴细胞从骨髓源性前体在胸腺里表达CD4和CD8受体从而达到成熟状态。CD4+T细胞分化为效应T辅助细胞,CD8+T细胞分化为细胞毒性T细胞,其中辅助型T淋巴细胞在T淋巴细胞中数量最多且作用关键,代表着机体特异性免疫系统功能状态,其数量减少代表机体的细胞免疫受到损害。因此,机体CD4和CD8T淋巴细胞数量的平衡和紊乱也代表机体免疫功能的平衡和紊乱[16-17]。本研究中,各组之间CD4、CD8及其比值均有统计学意义(P<0.05),且脓毒症组较非脓毒症组,死亡组较存活组CD4/CD8比值下降更显著,表明T淋巴细胞亚群可敏感反映脓毒症的严重程度。研究发现,在多微生物脓毒症模型中,CD4+T淋巴细胞尤其容易凋亡[9,18],又有研究表示,CD4+T淋巴细胞百分率和CD4/CD8比值在脓毒症患者中显著降低[19],这与本研究结果相符。并且CD4/CD8比值的下降在创伤后患脓毒症的多因素回归分析中成为独立危险因素,提示着CD4/CD8代表的细胞免疫状况值相对更加准确地反映患者的预后。ROC曲线分析发现CD4/CD8诊断脓毒血症的ROC曲线下面积显著高于IL-6、乳酸,与PCT相近,亦说明CD4/CD8在诊断、评估脓毒症的预后方面具有一定优势。
PCT是降钙素的肽前体,由甲状旁腺细胞以及肺和肠内的神经内分泌细胞分泌,是机体对如脓毒症引起的组织损伤和坏死所产生的钙外流引起的高钙血症产生反应[20]。当细菌感染特别是全身感染时显著升高。监测PCT水平有助于创伤后脓毒症的早期诊断、评估严重程度、指导抗生素治疗、判断预后结果,其临床意义已经得到了广泛的认可和应用[21-22]。但严重创伤、外科术后等患者早期血清PCT等指标也会显著升高,因此,应将PCT与至少一种其他生物标记物联合使用,以避免对脓毒症诊断尚未确定的患者进行生存或死亡的错误假设[23]。本研究中,脓毒症组与死亡组的PCT水平较各自的对照组显著升高,表明PCT对于严重创伤后脓毒症的预后作用较好。ROC曲线比较诊断效能中,PCT在曲线下面积较高(AUC=0.840),并且有较好的灵敏度及特异度,对创伤后脓毒症诊断有一定价值。
ISS可间接量化大量软组织损伤的创伤患者并可用于定义创伤的严重程度,评估住院死亡的风险,以及多发伤患者发生严重感染的风险[24]。但ISS也存在较大局限性,因ISS以解剖部位为基础,对患者伤后的生理功能紊乱状况并未反映。由于每名患者对创伤的承受能力及治疗的反应性存在个体差异,临床表现也呈现多样性,患者解剖部位损伤严重程度与其创伤后病理生理改变状况并不一致[25]。本研究中,ISS在各组中的差异同样均有统计学意义(P<0.05),Logistic回归分析提示患脓毒症及发展为死亡的独立危险因素,ISS越高,患脓毒症及死亡的风险越高,这与国内外研究相符[26-27]。据报道,创伤后患者脓毒症的总发病率2%~10%[28]。在笔者的研究中,脓毒症的发生率31.1%,可能反映较高的损伤严重程度,平均ISS(37.44±14.93)分。这些发现与Gouel-Chéron等[29]描述的比率相似,其队列研究中创伤后脓毒症的发生率37%,平均ISS(37±10)分。本研究中ISS诊断脓毒症截断值>24分,死亡组平均值(46.58±13.45)分。结合回归分析结果,认为ISS>24分的创伤患者更容易发展成为脓毒症,且评分越高,创伤后脓毒症的结局越倾向于死亡。对于ISS<16分的轻中度创伤患者也有可能会发生脓毒症,但因时间及人员等有限原因,无法追溯这些患者的预后。
除了创伤性损伤(“第一次打击”)之外,第二次打击(如手术、输血或感染)都可能影响全身生物标志物的浓度。此外,损伤严重程度及分布,甚至患者的特定因素,如性别和年龄、创伤前药物治疗、肥胖、先前存在的慢性疾病或酗酒都可能影响创伤后各项指标的浓度。故使用单一的标记物来预测并发症或决定具体的治疗策略是不够可靠的[30]。ROC曲线分析发现,CD4/CD8、PCT与ISS联合诊断的诊断效能较任何单项指标诊断创伤后脓毒症的准确性高。可能的原因是不同指标在脓毒症的发生发展过程中有着不同或互补的机制:CD4/CD8代表创伤患者的免疫状态,PCT代表着是否有细菌感染,而ISS提示创伤严重程度,若联合评估各类指标,诊断的敏感性和特异性会相应增加。虽然这三种指标与评分的组合还没有被使用过,但是每一种生物标志物都已经在其他组合测试中应用。在联合使用在同一测试时,这三种生物标志物及评分可能提高其诊断和预后的准确性。
本研究仍存在一些不足之处。首先,本研究为单中心研究,样本量相对较小,研究结果难免存在一定偏移;其次,本研究为横断面研究,未能描述各生物标志物的动态变化。如果能够分析患者CD4、CD8、PCT等的动态变化与疗效及预后的关系,可能会更有利于指导临床的治疗。
综上所述,本研究包括的创伤患者中,ISS、CD4/CD8、PCT等均与患脓毒症及病情严重程度有关。CD4/CD8、PCT与ISS联合诊断能有效地早期诊断脓毒症,ISS及CD4/CD8为创伤后脓毒症独立影响因素,可以有效评估患者预后。