血流动力学不稳定骨盆骨折的致病因素和早期处理措施
方加虎
(南京医科大学第一附属医院,南京 210029)
骨盆骨折临床上较为常见,约占全身骨折的3%[1],多由高能量损伤所致,主要见于道路交通伤。由于骨盆处血运丰富,骨盆骨折容易伴随大出血,引起血流动力学不稳定。对于血流动力学不稳定骨盆骨折,首先要判断出血情况,同时积极止血治疗,具体治疗措施包括损害控制性复苏(DCR)、骨盆固定、骨盆填塞以及动脉造影等[2]。
1 血流动力学不稳定骨盆骨折致病因素及临床特征
血流动力学不稳定骨盆骨折是指创伤大、血流动力学不稳定的骨盆骨折。Young-Burgess分型中侧方挤压型(LC)中的LC3型损伤,前后挤压型(APC)中APC2型、APC3型损伤,垂直压缩型(VS)损伤及复合型(CM)损伤都属于血流动力学不稳定的骨折类型。而在Tile分型中,B3型及C型骨折属于血流动力学不稳定骨盆骨折。不稳定骨盆骨折患者常伴有大量出血引起的低血容量性休克,出血来源包括:(1)骨折端松质骨渗血;(2)静脉丛破裂出血;(3)骨折周围肌肉、软组织损伤出血;(4)主要动、静脉出血;(5)盆腔脏器损伤后出血。骨盆骨折常引起直肠、膀胱和尿道等盆腔脏器损伤。尿道损伤一般并发于耻骨支的损伤移位,同时伴有会阴部的撕裂;膀胱损伤多为闭合性损伤,破碎骨片刺破膀胱引起尿外渗,常导致腹膜外间隙的感染和脓肿;直肠损伤见于骨折片的刺伤和骨盆环移位导致的撕裂伤。常见的表现有尿道口出血、血尿、阴道出血、直肠出血、前列腺向上移位、无法通过导尿管等表现。骨盆骨折导致的出血中,约80%来源于松质骨和静脉,一般可以通过稳定骨盆和减小骨盆容积控制出血。在稳定骨盆的基础上,可考虑采用骨盆填塞止血。其他约20%出血来源于动脉,上述措施若不能有效控制出血,常需进行血管造影栓塞来止血[3]。
骨盆骨折引起的低血容量性休克常导致低体温、凝血障碍以及代谢性酸中毒,临床上把这三个病理特征组合称为创伤后致命三联征,是导致并发症出现和患者死亡的重要病理基础。三种因素相互促进,逐渐成为不可逆的病理过程,即患者的生理状态呈螺旋式的恶化。
1.1低体温 血流动力学不稳定骨盆骨折的患者,体温通常下降至35℃,原因主要包括:(1)大量失血,氧气的运输减少导致氧气消耗减少,机体产热不足,导致低体温出现;(2)患者入院后脱去衣服,暴露在外界冰冷环境,输注大量的低温度晶体液和血液制品,都会直接导致患者体热丢失导致体温下降;(3)患者大出血导致的血流动力学不稳定,破坏内环境的稳定,引起体内代谢紊乱,导致产热功能的损害。体温降低引起血小板的活性下降等,进而引起凝血功能的障碍,使患者的出血难以遏制。
1.2凝血障碍 主要是低体温引起凝血酶、血小板功能的损害,凝血因子Ⅴ、Ⅷ合成的减少;同时,纤溶系统的激活,纤维蛋白原降解产物大量增加,使得内源性凝血通路激活受阻,从而引起凝血障碍进一步加重。患者入院后输注的复苏液体会导致血液的稀释,引起凝血因子、血小板浓度的下降,都会导致患者的出血症状加重。
1.3代谢性酸中毒 血流动力学不稳定骨盆骨折患者,由于大量出血,会导致血容量的下降,而在持续性低灌注状态下,细胞的能量代谢由有氧代谢逐渐转换为无氧代谢,代谢产物乳酸过多引起乳酸堆积,体内pH值下降,即代谢性酸中毒。患者持续性低血压情况下使用升压药物,以及低血容量引起的低体温,都会进一步加重酸中毒,最终会损害体内凝血功能,其机制是人体在酸性环境下,血小板的细胞结构与形态均会发生改变,引起血小板的凝血功能改变。
2 DCR
血流动力学不稳定骨盆骨折患者常因创伤后致命三联征引起病理状态的急剧恶化,因此,对于该类患者的救治成功与否取决于是否能够全面快速纠正严重内环境紊乱。参照中国2015年版《血流动力学不稳定骨盆骨折急诊处理专家共识》[4]中有关DCR的论述,对于急性出血的患者,要尽快开始液体治疗。
2.1复苏液体量 目前,临床上对于使用晶体液体复苏改善患者循环功能已成为共识,但在复苏早期,复苏液体量的计算缺乏理想的公式。大量快速静脉输注晶体液可能会稀释血液,降低血液中血小板和凝血因子的浓度,同时引起血凝块的脱落,不利于凝血系统的稳定,加剧凝血功能障碍,还会提高多器官功能衰竭(MODS)以及病死率。因此,在实际的治疗中,应该保守性地使用晶体液,将收缩压控制在80~90mmHg[4],即允许性低血压,避免上述因大剂量液体输注而造成并发症情况出现。可以根据入院时患者的血压、心率和体重评估失血量,若患者失血得到有效控制,则可以补充之前的失血,稳定血压。如果血压呈波动性变化,判断患者仍有失血,则停止输注晶体液,避免血小板,凝血因子浓度进一步被稀释,改用去甲肾上腺素或血管加压素等血管活性药物来升高血压[5]。
2.2复苏液体选择 血栓弹力图提示纤维蛋白原功能低下或实验室检查血浆纤维蛋白原不足15~20g/L者,需要适量补充纤维蛋白原;对于血小板计数明显减少者,需适当补充血小板,将血小板计数控制在50×109/L以上水平;对于持续性大量出血者,应将血小板计数控制在100×109/L以上水平;对于伴有大量出血者,有以下两种方案:(1)红细胞、新鲜冰冻血浆、血小板6∶4∶1输注;(2)红细胞、新鲜冰冻血浆、血小板1∶1∶1输注[6]。对于出血量较大而引起血液中钙离子浓度下降的患者,应适当的补充钙离子以减轻患者的低钙血症,钙离子浓度维持在0.9mmol/L[7]。大量出血也会导致患者血液凝血因子下降,可适当应用凝血因子Ⅶ制剂[8]。
2.3复苏液体输注途径选择 在输注途径选择方面以外周深静脉为宜,如锁骨下静脉、颈内静脉、股静脉,但有观点认为锁骨下静脉穿刺需要较高的技术要求并且容易出现气胸、出血等并发症,使得病情复杂化,在严重创伤患者救治中需谨慎选用;可使用操作简单、成功率高的股静脉,但在骨盆骨折时应避免使用。在外周静脉建立困难情况下,尤其是儿童,骨髓腔输液是一个很好的选择[9]。一般选择在患者胫骨结节处穿刺建立骨髓腔内输液通道。如果患者伴有下肢骨折,则选取肱骨大结节处作为穿刺点。
3 血流动力学不稳定的骨盆骨折早期救治
对于血流动力学不稳定骨盆骨折患者,在早期液体控制复苏的同时,控制出血,维持血流动力学稳定是早期救治的首要任务。早期损害控制的主要措施包括骨盆固定、骨盆填塞以及动脉造影与栓塞。
3.1骨盆固定 包括骨盆固定带、床单固定、外固定支架和C型钳。
骨盆固定带在临床上较为常见,是一种非侵入性的骨盆固定方法,能够迅速稳定骨折,减少骨盆容积。常用的骨盆固定带包括山姆Ⅱ型骨盆固定带、创伤骨盆矫形器(T-POD)。操作时先在髂窝添加棉垫,再以股骨大转子为中心加压包扎。缺点是骨盆带面积较大,容易造成视线上的遮挡从而影响对伤者病情的判断。如果骨盆带加压过大,可能对盆腔内脏器造成损伤,压迫盆腔内神经肌肉组织[10]。在病情较为紧急、急救器械缺乏的情况下,可用床单代替骨盆带等固定装置对患者进行骨盆固定[11]。
外固定支架和C型钳相对于骨盆带对严重受伤的患者有很大的优势,可以固定更长时间,也方便后续手术通道建立[12]。外固定支架适用于多数骨盆骨折,通过对骨折端移动的限制来减少活动性出血量。尤其对于旋转不稳定的“开书样”损伤患者,可以恢复骨盆腔容积,减少腹膜后出血[13]。具体手术方法是在髂骨内置入4枚固定螺钉,把持髋臼以上骨质,再基于固定螺钉连接固定支架来稳固骨盆。
髂前上棘支架(anterior superior iliac spine Frames,ASIS Frames)。操作简单易行,以固定骨盆前环为主,安装此支架患者坐起来困难。外固定支架螺纹针的置入方法:在髂前上棘后方1.5~2.0cm处,髂嵴内外板中心处置入第1枚固定螺钉,第2枚螺钉在第1枚螺钉上方相隔2~3cm处,螺钉均朝向髋关节方向,置入深度6~7cm,对侧使用同样的方法,连接杆连接,稳定骨盆。
髂前下棘支架(anterior inferior iliac spine Frames,AIIS Frames)。具有更好的固定稳定性和牢固性,同时患者可以坐起来,护理方便。但此种支架螺纹钉的置入需要在透视下完成,拍摄闭合出口位片(图1a)确定入钉点,闭孔入口位片(图1b)确定螺钉的走向,髂骨位片验证螺钉的正确位置(图1c)。否则会有螺钉进入盆腔损害血管和脏器的风险。螺钉贯穿髂前和髂后,有较好的生物力学稳定性(图1d)。
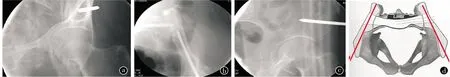
图1 髂前下棘支架。a.闭孔出口位片;b.闭口入口位片;c.髂骨位片;d.螺钉通道示意图
对于骨盆后环完全断裂的C型骨盆骨折,C型钳(图2)是良好的骨盆复位固定方式,C型钳的半针直接作用于骶髂关节,对前环和后环损伤有良好的复位和固定作用。但C型钳操作时间较长,步骤有一定的复杂性,C型钳的安置同样要在透视的监视下完成。对于病情相对严重的血流动力学不稳定骨盆骨折患者,应当尽量选择简单、快速、有效的骨盆固定方法[14]。
3.2骨盆填塞 骨盆填塞是一种传统的压迫止血方法,通过在患者腹膜外填塞纱布,压迫骨折所导致的出血,一直为欧洲创伤中心所提倡[15]。应用骨盆填塞技术前提是对患者提前进行骨盆外固定,在限制骨折移动端、稳定盆腔容积的基础上填塞纱布,进一步减少盆腔容积。通过物理加压止血,对于静脉源性出血尤其是髂前静脉丛有很好的效果。对于开放性骨盆骨折,可以直接用无菌纱布填塞于创面止血,待创面清理干净后再次进行骨盆填塞。对于非开放性骨盆骨折,有两种入路方式,分别是髂腹股沟入路以及Stoppa入路(腹部正中纵向切口)[16]。一般切口长度应>10cm,便于准确填塞,后续纱布取出和判断止血情况,是否需要二次填塞[17]。具体方式是在耻骨后方与骶髂关节之间,沿弓状线填塞无菌纱布(图3)。骨盆填塞方便快捷,且止血效果明显,可有效提高血流动力学不稳定骨盆骨折患者生存率。但是骨盆填塞属于侵入性手术,感染发生率及并发症发生率均高于血管造影栓塞[18-19];对动脉源性出血效果不确定,因此其应用受限。
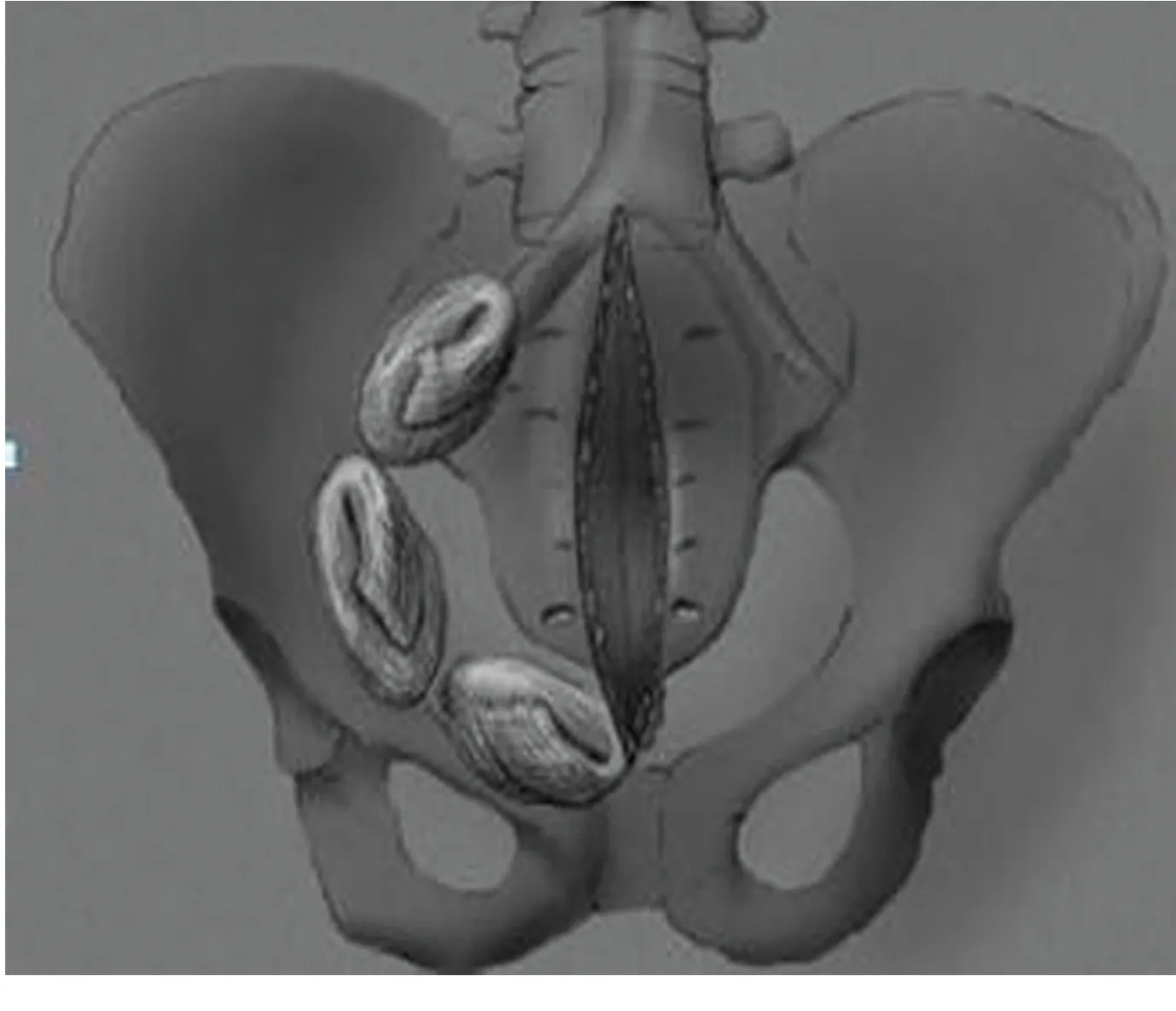
图3 骨盆填塞示意图
3.3血管造影和栓塞 血管造影和栓塞止血主要应用于动脉源性的出血,其特点是快速、微创、止血准确等[20]。在临床上,在进行骨盆外固定联合骨盆填塞处理后多数患者出血情况得到明显控制,但仍约15%的患者依然存在血流动力学不稳定的情况,此时考虑应用血管造影,并进行精准的动脉栓塞止血[17]。
一般栓塞臀上动脉、阴部动脉和髂内动脉等。栓塞方式分为:(1)选择性动脉栓塞,可以降低例如肠梗死、臀肌缺血等并发症发生率;(2)非选择性动脉栓塞(髂内动脉栓塞),当血管造影提示多支动脉出血,或患者存在血流动力学不稳定的情况时选择。有数据显示10%~15%骨盆骨折必须行动脉造影,63%~66%栓塞有效[21]。目前关于血管造影栓塞技术的应用仍缺乏明确指标,具体的选择和范围由患者生理、骨折形态等因素综合确定[22]。对于静脉源性出血,血管造影栓塞效果一般,且有时在早期急救过程中难以判断出血的原因,此时行动脉造影栓塞会耽误救治。多数学者主张动脉造影和栓塞是应用于液体复苏、外固定和盆腔填塞后患者仍存在低血压时的最后选择[23-24]。
4 多学科联合救治
对于血流动力学不稳定骨盆骨折的处理,有必要组建一个高水平、多学科参与的团队[4]。由于各科室专业背景不同,而血流动力学不稳定骨盆骨折患者需要医师做出快速反应,因此需要各个成员对疾病的认识高度一致,才能展开后续一系列的处理[25]。目前国内已有创伤中心在严重创伤救治中采取多学科联合模式并证实其救治效果优于传统救治模式的报道[26],但临床上对于血流动力学不稳定骨盆骨折多是根据伤情分科室邀请相关专科进行会诊,根据治疗的不同节点进行分科室治疗,即分科-分段式救治模式[27]。因此,有必要推进多学科联合救治模式的建设,提高血流动力学不稳定骨盆骨折患者的生存率和救治效果。
对于血流不稳定骨盆骨折的患者,首先要稳定骨盆,减少骨盆容积。从院前急救就开始简单的固定维持,到早期的创伤控制、外固定支架和C型钳固定,必要时骨盆填塞及动脉栓塞等措施,及时控制住出血是早期救治的关键[28]。在救治的过程中,还要及时输注液体保持血容量的稳定,避免致命三联征的发生。但由于血流动力学不稳定骨盆骨折的致伤机制极为复杂,因此需要多学科团队合作进行治疗。
血流动力学不稳定骨盆骨折患者的生存率取决于是否能够尽快地控制出血。松质骨出血是骨盆骨折出血的主要来源,其次是静脉丛,再次是动脉出血。所以快速控制出血是救治的关键,处理措施包括:首先,稳定骨盆环,尽量减少检查和搬动,尽快恢复骨盆的容积。具体固定措施包括骨盆带固定、外固定支架固定和C型钳固定;其次,在稳定骨盆环的基础上,仍不能有效维持患者的血压,应首选立即采用腹膜外填塞;再次,在实施填塞的同时,准备行选择性的动脉栓塞(需较长时间准备)。当然,对于首诊医师,首先要评估患者的生命体征,遵循创伤急救的ABCDE原则是基础,维持允许性低血压,成比例输血(红细胞、新鲜冰冻血浆、血小板6∶4∶1输注),同时关注多发伤的联合诊断和处理,组建多学科联合救治都是抢救成功的关键。值得警示的是,对于少部分骨盆环稳定的骨盆骨折仍可能出现血流动力学不稳定的状况,甚至危及生命,不能疏忽大意,放松警惕。