小白菊内酯对脑缺血大鼠的脑保护作用及机制
乔会敏 陈林玉 杜媛媛 吴冰洁 董梅 张祥建
在急性脑卒中中,氧化应激和炎症在神经功能缺损中起重要作用。小白菊内酯是甘菊(tanacetum parthenium)中发现的主要倍半萜内酯,具有广泛的药理和生物活性,包括抗炎和抗氧化等[1,2]。重要的是,其亲脂性有利于良好的血脑屏障(BBB)通透性[3]。小白菊内酯的结构明确。已被广泛用于多种炎症性疾病的治疗,包括发热和偏头痛,不良反应很少[4,5]。近期研究表明小白菊内酯对心脏缺血再灌注损伤有保护作用[6]。然而,小白菊内酯对脑梗死是否具有脑保护作用,其机制如何,研究较少。因此,本研究通过脑缺血模型,观察小白菊内酯的作用及机制。
1 材料与方法
1.1 实验动物与分组 采用健康成年清洁级雄性SD大鼠72只[购自北京维通利华实验动物有限公司,合格证号:SCXK(京2016-0006)],体重230~289 g。分为假手术组(sham+0.05% Tween80),溶剂对照组(MCAO+0.05% Tween80)和小白菊内酯组(MCAO+小白菊内酯 500 μg/kg,含0.05% Tween80)。
1.2 药品与试剂 小白菊内酯(美国 Santa Cruz 公司),兔抗TLR4多克隆抗体(1∶500,美国 Santa Cruz 公司),兔抗 NF-κB 多克隆抗体(1∶300美国 Santa Cruz),兔抗GAPDH 多克隆抗体(1∶500,北京中山生物技术有限公司),兔抗Claudin-5多克隆抗体(1∶150,美国 Santa Cruz 公司), SOD,CAT,MDA测定试剂盒(中国南京建成公司)。
1.3 动物模型 (1)溶剂对照组:参照Longa等[7]线栓法改良后制备大鼠右侧大脑中动脉闭塞模型(MCAO)。腹腔注射0.05% Tween80。(2)假手术组:除不插线栓外,其余同溶剂对照组。(3)小白菊内酯组:制备脑缺血模型后即刻腹腔注射小白菊内酯500 μg/kg。
1.4 实验方法
1.4.1 神经功能缺损评分:采用Longa等[7]的6级5分法。
1.4.2 脑组织含水量测定:采用干湿法[8]在脑缺后24 h测定脑组织含水量。
1.4.3 脑梗死体积测定:将脑组织切成切片(3 mm厚),37℃2% TTC染色20 min,4%多聚甲醛固定。TTC染色切片拍照。计算:梗死体积百分比=(矫正梗死体积/非缺血侧半球体积)×100%。
1.4.4 Western-blot:取梗死侧皮层脑组织,用蛋白提取试剂盒提取蛋白,再用BCA试剂盒测蛋白浓度,制备SDS-聚丙烯酰胺凝胶,上样,电泳,转膜。加入一抗,TLR4、NF-κB、Claudin-5多克隆抗体。过夜后加二抗,以 GAPDH 的做为内参,各指标与GAPDH的比值代表蛋白相对表达水平。最后扫膜并采集图像。
1.4.5 实时定量PCR:取梗死侧皮层脑组织,立即加入液氮,再放入-80℃冰箱,按照说明书,使用Trizol试剂从冰冻缺血缺血脑组织提取总RNA。然后用试剂盒逆转录成cDNA。最后采用实时荧光定量 PCR 检测Claudin-5,NF-κB,TLR4和 mRNA 表达,以GADPH作为内参基因,与对照组相比,得到目的基因表达的CT值,进行数据相对定量分析(n=6)。见表1。

表1 引物如下

2 结果
2.1 小白菊内酯的脑保护作用
2.1.1 小白菊内酯对脑水肿的作用:患侧脑组织含水量结果显示,溶剂对照组(86.53±1.37)%明显高于假手术组(78.16±1.55)%,差异有统计学意义(P<0.05);小白菊内酯组(81.06±1.12)%明显低于溶剂对照组(86.53±1.37)%,差异有统计学意义(P<0.05)。
2.1.2 小白菊内酯对神经功能缺损评分的作用:神经功能缺损评分显示,假手术组神经功能评分均为0分,未见神经功能缺损,小白菊内酯组神经功能缺损评分(1.8±0.25)分,明显低于溶剂对照组(3.3±0.3)分(P<0.05)。
2.1.3 小白菊内酯对脑梗死体积的作用:TTC染色后,梗死体积显示,假手术组未见梗死灶,小白菊内酯组梗死体积(32.36%±6.9%),明显低于溶剂对照组(44.87%±4.6%)(P<0.05 ) 。
2.1.4 小白菊内酯对Claudin-5基因表达的影响:与溶剂对照组比较,小白菊内酯组Claudin-5的基因表达明显高于溶剂对照组(P<0.05)。见表2。
2.1.5 小白菊内酯对Claudin-5蛋白表达的影响:与溶剂对照组比较,小白菊内酯组Claudin-5的基因表达明显高于溶剂对照组(P<0.05)。见表2。
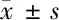
表2 Claudin-5的基因及蛋白表达水平
2.2 小白菊内酯对脑梗死的抗氧化作用
2.2.1 小白菊内酯对脑梗死大鼠SOD活性的影响:SOD活性结果显示,溶剂对照组(66.79±2.527)U/mg明显低于假手术组(123.22±3.956)U/mg(P<0.05);小白菊内酯组(102.36±5.331)U/mg明显高于溶剂对照组(66.79±2.527)U/mg(P<0.05)。见表3。
2.2.2 小白菊内酯对脑梗死大鼠CAT活性的影响:溶剂对照组(1.621±0.097)U/mg明显低于假手术组(2.733±0.126)U/mg(P<0.05);小白菊内酯组(2.372±0.155)U/mg明显高于溶剂对照组(1.621±0.097)U/mg(P<0.05)。见表3。
2.2.3 小白菊内酯对脑梗死大鼠MDA水平的影响:溶剂对照组(4.799±0.208)nmol/mg明显高于假手术组(2.057±0.109)nmol/mg(P<0.05);小白菊内酯组(2.906±0.137)nmol/mg明显低于溶剂对照组(P<0.05)。见表3。
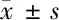
表3 3组SOD、CAT、MDA活性比较
2.3 小白菊内酯对脑梗死的抗炎作用
2.3.1 小白菊内酯对TLR4和NF-κB基因表达的影响:与溶剂对照组比较,小白菊内酯组TLR4基因表达明显低于溶剂对照组(P<0.05);小白菊内酯组NF-κB基因表达明显低于溶剂对照组(P<0.05)。见表4。
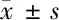
表4 TLR4和NF-κB的基因表达水平
2.3.2 小白菊内酯对TLR4和NF-κB蛋白表达的影响:与溶剂对照组比较,小白菊内酯组TLR4蛋白表达明显低于溶剂对照组(P<0.05);小白菊内酯组TLR4蛋白表达明显低于溶剂对照组(P<0.05)。见表5。
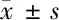
表5 TLR4和NF-κB的蛋白表达水平
3 讨论
SOD是一种重要的自由基清除剂,能特异地将超氧自由基解毒给过氧化氢,保护机体免受自由基的侵害。SOD1作为SOD家族的重要成员之一,可在缺血后急性期减少神经元丢失,减少梗死面积[9,10]。在生理条件下,受内源性抗氧化剂如SOD、谷胱甘肽过氧化物酶、谷胱甘肽和CAT的控制,ROS的生成水平较低[11,12]。SOD通过灭活氧自由基保护人体免受过氧化和组织损伤。CAT是一种常见的酶,几乎存在于所有暴露在氧气中的生物体内,是所有酶中周转次数最高的酶之一[13]。过氧化氢可能转化为其他自由基,而谷胱甘肽过氧化物酶可以消除过氧化氢[14]。MDA是脂质过氧化的一种有毒终产物,是典型的氧化应激标志物之一。其表达水平可直接反映脂质过氧化的速率和程度,间接反映清除自由基的能力。线粒体在功能失常的情况下产生更多的活性氧簇(ROS),ROS介导的线粒体氧化损伤有助于更多ROS的产生[15,16]。因此减少MDA的表达可以减轻氧化应激反应[17]。本研究中,大鼠脑缺血后24 h,小白菊内酯治疗组SOD及CAT活性明显升高,MDA水平明显降低,说明小白菊内酯在脑缺血后起到抗氧化作用。
Toll样受体(TLRs)可以识别受伤或坏死细胞释放的内源性危险信号,并促进炎症反应和细胞凋亡的启动[18]。各种证据证实Toll样受体4(TLR4)参与缺血后的炎性反应[19-21],到目前为止,已经发现的有11个人类和13个小鼠TLR[22]。TLR4在细胞内信号通路均通过MyD88-TRAF6通路。髓样分化因子88(MyD88)招募启动白细胞介素1受体关联激酶4(IRAK4)的激活和白细胞介素1受体关联激酶1(IRAK1)磷酸化,导致TNF受体关联因子6(TRAF6)和转化生长因子β(TGF-β)激活激酶1 (TAK1)。这些事件在丝裂原激活蛋白激酶p38和核因子-κB(NF-κB)的激活中达到高潮,这两者对于激活诱导的炎症介质的表达是必需的,包括趋化因子和细胞因子[23-25]。本研究发现,缺血24 h后,TLR4表达上调,而小白菊内酯明显降低了这些因子的表达。
众所周知,TLR-MyD88关联激活NF-κB级联反应,这两者对激活诱导的炎性介质的表达都是至关重要的[26]。现有数据表明,TLR4缺乏小鼠对缺血性脑损伤有保护作用。NF-κB在炎性反应和细胞生存中扮演重要角色,它可以控制大量的基因比如编码细胞因子[白细胞介素1α(IL-1α),白细胞介素6(IL-6),肿瘤坏死因子α(TNF-α)等),以及死亡和生存的蛋白质B淋巴细胞瘤2基因(Bcl-2)、p53、Bcl-2相关X蛋白(Bax)]、细胞间粘附分子(ICAM)cyclooxygenase-2 (cox-2)和诱导一氧化氮合酶[27]。NF-κB作为死亡和存活蛋白的调节因子,在中枢神经系统神经元的存活中发挥着双重作用,这取决于缺血性损伤的性质(永久性或短暂性、持续时间和缺血再灌注的严重程度)[28],NF-κB的短暂激活有助于缺血损伤后神经元的存活,NF-κB的持续激活使神经元易受缺血损伤。而在本研究中,小白菊内酯能抑制TLR4及NF-κB的表达,说明小白菊内酯在脑缺血中发挥了抗炎症作用。
小白菊内酯作为一种抗氧化剂和抗炎剂,在多种疾病中发挥着重要的保护作用。已经证明,小白菊内酯可以抑制促炎细胞因子,例如在体外研究中,降低TNF-α,环氧合酶2(cox-2), 单核细胞趋化蛋白1(MCP-1)的表达[29,30]。小白菊内酯还可以减轻心血管损伤,延缓动脉粥样 硬化病变,对心肌缺血有有益作用[31]。小白菊内酯通过抑制过氧化氢,升高SOD的表达减轻成骨细胞凋亡[32]。此外,近期研究表明小白菊内酯还可以作为NF-κB的天然抑制剂,对抗肿瘤[33]。因此我们推测,小白菊内酯可能通过调节SOD、CAT、MDA、TLR4和NF-κB的表达保护脑缺血损伤。
BBB将中枢神经系统的循环血液与脑脊液分离,并且BBB的通透性较低[34]。脑损伤后BBB的破坏会导致血管源性脑水肿的发生,这是脑梗死后最严重的并发症[35]。所以保护BBB也是治疗脑梗死的关键步骤。紧密连接发育良好,在血脑屏障的形成中起着核心作用[36]。紧密连接蛋白5(Claudin-5)是脑内皮细胞紧密连接的主要细胞黏附分子,在脑毛细血管内皮细胞屏障特性的出现中起关键作用。已有研究证明,仅破坏claudin-5就足以引起BBB的功能改变[37]。通过降解claudin-5可以打开BBB,增加BBB的通透性[38]。鉴于claudin-5在调节BBB通透性和维持脑血管内皮细胞血脑屏障完整性方面的基础作用,我们评估小白菊内酯是否对claudin-5有影响。在我们的研究中,我们发现小白菊内酯著增加了脑缺血后claudin-5的表达。提示小白菊内酯可能通过诱导claudin-5来改善缺血后血脑屏障的破坏。
总之,我们已经表明小白菊内酯对脑缺血大鼠具有神经保护作用,可以减轻脑水肿,减小脑梗死体积,降低神经功能缺损评分,这个作用可能是通过升高SOD和CAT的水平,降低MDA的水平,下调TLR4和NF-κB的表达,增加Claudin-5的表达实现的,但是小白菊内酯应用的剂量,应用的时间,以及是否还通过其他途径起到脑保护作用,还需进一步研究。

