大黄素调控NF-κB信号通路抗缺氧缺糖/复氧复糖诱导的PC12细胞损伤
刘炳园 罗婷婷 刘柳芳
心脑血管疾病已经成为威胁中老年人生命健康的重要原因,其中脑缺血再灌注损伤最为常见[1]。脑缺血再灌注损伤是由多种因素引起的,包括氧化应激、细胞凋亡等[2]。细胞内过量的氧自由基可以激活Caspase凋亡反应,促进细胞凋亡发生[3]。大黄素主要来源于蓼科植物掌叶大黄根茎,其是大黄的主要活性成份,大黄素属于蒽醌类衍生物,传统中医认为大黄素具有抗菌、消炎、保肝、抗肿瘤等功效[4]。大黄素还具有抗氧化功能,其可以清除机体内多余的氧自由基,促进氧化平衡[5]。以前的研究显示,大黄素处理后的脑缺血再灌注损伤大鼠模型脑组织中细胞凋亡水平降低,脑梗死面积减小,大黄素还可以改善大鼠记忆功能[6]。大黄素抑制过氧化氢诱导的PC12细胞损伤[7]。现阶段对于大黄素的作用机制还不明确,大黄素可以通过抑制核因子-κB(nuclear factor-κB,NF-κB)减轻巨噬细胞损伤和大鼠脊髓损伤[8,9]。本次实验以明确大黄素对缺氧缺糖/复氧复糖PC12细胞氧化应激和细胞凋亡的影响和机制为目的,以期为大黄素治疗脑缺血再灌注损伤提供理论资料。
1 材料与方法
1.1 材料 超氧化物歧化酶(SOD)含量检测试剂盒(WST-8法)购自北京普利莱基因技术有限公司;PC12细胞购自上海弘顺生物科技有限公司;谷胱甘肽(GSH)含量检测试剂盒(比色法)购自上海通蔚生物有限公司;大黄素购自上海宝曼生物科技有限公司;CCK-8细胞活力检测试剂盒购自大连美仑生物技术有限公司;乳酸脱氢酶(LDH)含量测定试剂盒(L-P法)购自上海岚派生物科技有限公司;NF-κBp65抗体购自湖南艾佳生物科技股份有限公司;丙二醛(MDA)含量检测试剂盒(TBA法)购自上海铭博生物科技有限公司;Cleaved Caspase-3抗体购自美国Abcam;活性氧(ROS)水平检测试剂盒(DCFH-DA法)购自上海联迈生物工程有限公司。
1.2 实验分组处理方法
1.2.1 PC12细胞用含有10%胎牛血清的High-DMEM细胞培养液培养,培养条件设置为:37℃,5% CO2培养箱。缺氧缺糖/复氧复糖模型构建方法[10]为:将PC12细胞种植到96孔板中,细胞接种密度为6×104个/ml,48 h以后,在细胞中添加无糖Earles培养液体外模拟缺血,将细胞放在37℃含有5% CO2、1%O2、94%N2的培养箱中缺氧培养,缺氧缺糖培养3 h以后,将培养液更换成含有10%胎牛血清的High-DMEM细胞培养液,放在37℃,5% CO2培养箱中培养12 h。
1.2.2 PC12细胞分成Normal、Model、EMO-L、EMO-M、EMO-H组,处理方法如下:Model组为缺氧缺糖/复氧复糖模型细胞;EMO-L、EMO-M、EMO-H组细胞在缺氧缺糖/复氧复糖处理之前的24 h,以30、60、90 mmol/L的大黄素处理;Normal组细胞为空白对照。
1.3 CCK-8测定细胞活力 Normal、Model、EMO-L、EMO-M、EMO-H组按照上述处理方法缺氧缺糖/复氧复糖处理以后,在超净工作台中加入10 μl的CCK-8溶液,放在37℃继续孵育3 h以后,用多功能酶标仪检测各孔490 nm的OD值。OD值代表细胞活力。
1.4 LDH、MDA、SOD、GSH和ROS水平检测 Normal、Model、EMO-L、EMO-M、EMO-H组按照上述处理方法缺氧缺糖/复氧复糖处理以后,收集细胞和培养液上清,LDH含量测定试剂盒(L-P法)检测培养液上清中LDH含量,MDA含量检测试剂盒(TBA法)检测细胞中MDA水平,SOD含量检测试剂盒(WST-8法)检测细胞中SOD活性,GSH含量检测试剂盒(比色法)检测细胞中GSH活性,ROS水平检测试剂盒(DCFH-DA法)检测细胞中ROS水平,步骤均参照试剂盒说明书。
1.5 流式细胞术测定细胞凋亡 Normal、Model、EMO-L、EMO-M、EMO-H组按照上述处理方法缺氧缺糖/复氧复糖处理以后,收集细胞(每组收集106个细胞),添加PBS溶液反复洗涤细胞2次,最后将细胞悬浮在500 μl的结合缓冲液中,吸取5 μl的PI和Annexin V-FITC添加到细胞中,充分混合后,用流式细胞仪测定凋亡变化。
1.6 Western blot测定NF-κBp65、Cleaved Caspase-3蛋白表达 将RIPA同PMSF按照100∶1的比例混合,添加到 Normal、Model、EMO-L、EMO-M、EMO-H组细胞中,放在冰上裂解30 min,期间每隔5 min涡旋1次,在4℃,12 000 g条件下离心15 min。取2 μl的蛋白用BCA法测定蛋白浓度,剩余的蛋白中加入Loading Buffer混合煮沸5 min。将制好的浓缩胶和分离胶放入电泳槽中,添加蛋白电泳缓冲液,电泳参数设置为:浓缩胶70 V,30 min;分离胶90 V,2 h。PVDF膜裁剪成合适大小,以25 V电压转膜30 min。将PVDF膜放在提前配置好的5%牛血清白蛋白溶液中,在室温孵育2 h。PVDF膜经过TBST洗涤以后,置于一抗溶液中,在4℃孵育过夜。TBST再次洗涤PVDF膜,放入二抗溶液中,在室温中反应2 h。ECL发光。Image J分析灰度值。GAPDH作为内参,分析各目的蛋白表达水平。
1.7 NF-κB信号激活剂对大黄素影响缺氧缺糖/复氧复糖PC12细胞损伤作用检测 PC12细胞用含有60 mmol/L的大黄素和20 ng/ml的NF-κB信号激活剂TNF-α共同处理24 h,然后给予缺氧缺糖/复氧复糖处置,记为EMO-M+TNF-α组,以EMO-M组作为参照,按照上述方法测定细胞活力(步骤同1.3)和LDH、MDA、SOD、GSH、ROS水平(步骤同1.4)、细胞凋亡(步骤同1.5)以及NF-κBp65、Cleaved Caspase-3蛋白水平(步骤同1.6)。

2 结果
2.1 大黄素对缺氧缺糖/复氧复糖PC12细胞OD值、LDH、MDA水平影响 与Normal组比较,Model组细胞OD值降低,LDH和MDA水平升高(P<0.05);与Model组比较,EMO-L、EMO-M、EMO-H组细胞OD值逐渐升高,LDH和MDA水平逐渐降低(P<0.05)。大黄素提高缺氧缺糖/复氧复糖PC12细胞活力,减少细胞损伤。见表1。
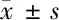
表1 大黄素处理后缺氧缺糖/复氧复糖PC12细胞OD值、LDH、MDA水平比较
2.2 大黄素对缺氧缺糖/复氧复糖PC12细胞SOD、GSH和ROS水平影响 与Normal组比较,Model组细胞SOD、GSH活性降低,ROS水平升高(P<0.05);与Model组比较,EMO-L、EMO-M、EMO-H组细胞SOD、GSH活性逐渐升高,ROS水平水平逐渐降低(P<0.05)。大黄素减少缺氧缺糖/复氧复糖PC12细胞中ROS水平,提高细胞中SOD、GSH活性。见表2。
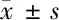
表2 大黄素处理后缺氧缺糖/复氧复糖PC12细胞中SOD、GSH和ROS水平比较
2.3 大黄素对缺氧缺糖/复氧复糖PC12细胞凋亡和Cleaved Caspase-3蛋白表达影响 与Normal组比较,Model组细胞凋亡率和Cleaved Caspase-3蛋白水平升高(P<0.05);与Model组比较,EMO-L、EMO-M、EMO-H组细胞凋亡率和Cleaved Caspase-3蛋白水平逐渐降低(P<0.05)。大黄素减少缺氧缺糖/复氧复糖PC12细胞凋亡。见图1,表3。
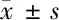
表3 大黄素处理后缺氧缺糖/复氧复糖PC12细胞凋亡率和Cleaved Caspase-3蛋白水平比较
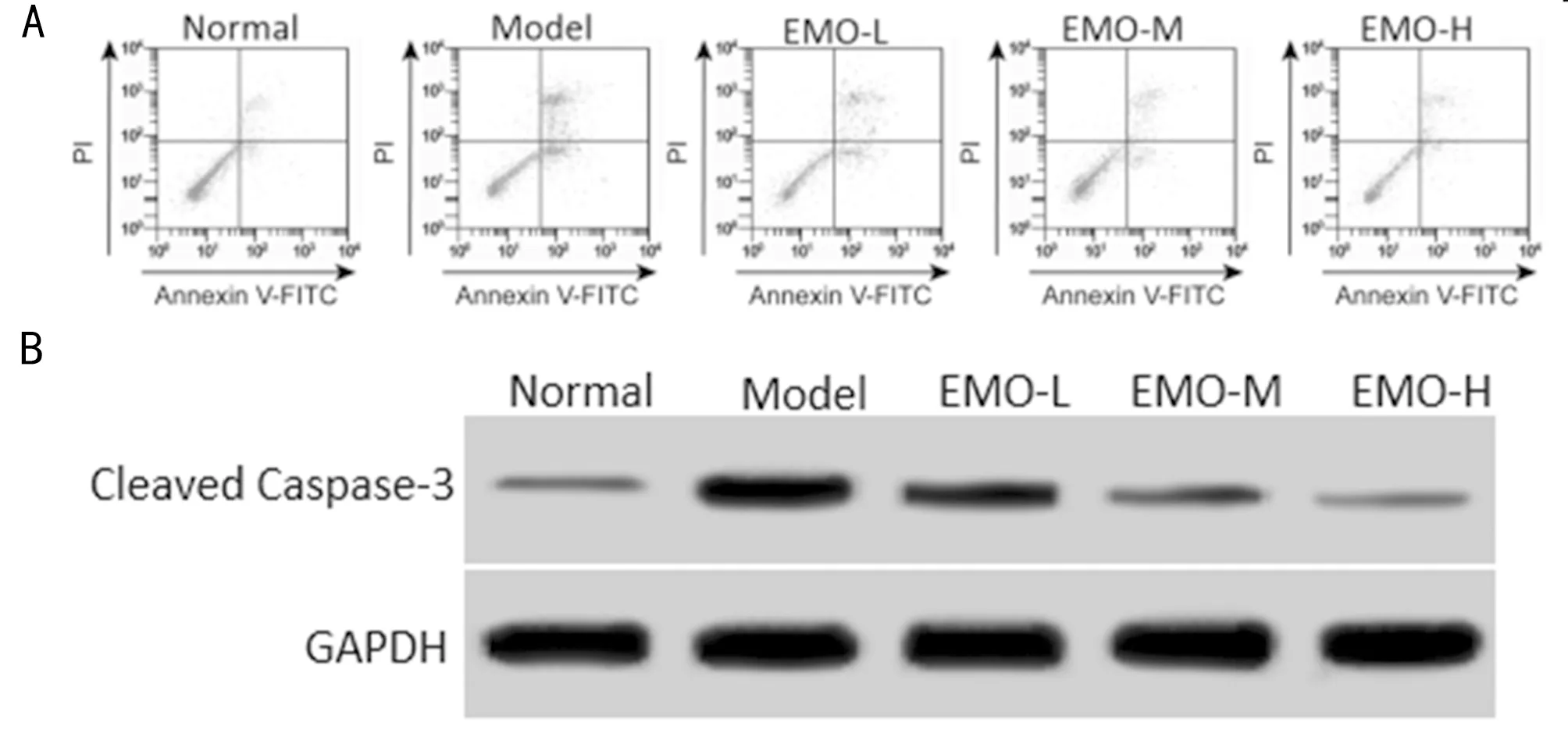
图1 大黄素对缺氧缺糖/复氧复糖PC12细胞凋亡和Cleaved Caspase-3蛋白表达影响;A 流式细胞术测定PC12细胞凋亡;B Western blot测定Cleaved Caspase-3蛋白表达
2.4 大黄素对缺氧缺糖/复氧复糖PC12细胞NF-κBp65蛋白表达影响 与Normal组比较,Model组细胞NF-κBp65蛋白水平升高(P<0.05);与Model组比较,EMO-L、EMO-M、EMO-H组细胞NF-κBp65蛋白水平逐渐降低(P<0.05)。大黄素减少缺氧缺糖/复氧复糖PC12细胞中NF-κBp65蛋白表达。见图2,表4。
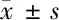
表4 大黄素处理后缺氧缺糖/复氧复糖PC12细胞NF-κBp65蛋白水平比较

图2 Western blot测定大黄素对缺氧缺糖/复氧复糖PC12细胞中NF-κBp65蛋白表达影响
2.5 NF-κB激活剂对大黄素抗缺氧缺糖/复氧复糖PC12细胞损伤的影响 与EMO-M组比较,EMO-M+TNF-α组PC12细胞OD值降低,LDH、MDA、ROS水平升高,SOD、GSH活性下降,细胞凋亡率和NF-κBp65、Cleaved Caspase-3蛋白水平升高(P<0.05)。NF-κB激活剂逆转大黄素抗缺氧缺糖/复氧复糖PC12细胞损伤作用。见图3,表5。
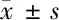
表5 大黄素和NF-κB激活剂TNF-α联合处理后缺氧缺糖/复氧复糖PC12细胞OD 值、LDH、MDA、SOD、GSH、ROS、凋亡率和NF-κBp65、Cleaved Caspase-3蛋白水平比较

图3 大黄素和NF-κB激活剂TNF-α联合处理对缺氧缺糖/复氧复糖PC12细胞凋亡和NF-κBp65、Cleaved Caspase-3蛋白表达影响;A 流式细胞术测定细胞凋亡;B Western blot测定NF-κBp65、Cleaved Caspase-3蛋白表达
3 讨论
研究报道显示,缺氧缺糖/复氧复糖可以体外诱导神经细胞氧化损伤,降低细胞活力,促进细胞凋亡[11]。细胞在受到外界因素刺激以后,细胞中的抗氧化酶活性降低,使得存在于细胞内的ROS不能被及时降解而聚集在细胞内,过量的ROS可以将脂质过氧化,造成细胞膜损伤,使得原本存在于细胞内的LDH释放至细胞外[12]。MDA是脂质发生过氧化的产物[13]。SOD、GSH是存在于机体内的抗氧化酶[14]。氧化应激可以诱导细胞凋亡发生,过量的氧自由基可以激活存在于细胞内的Caspase蛋白成员,诱导细胞凋亡发生[15]。Caspase是与细胞凋亡关系密切的促凋亡因子,其在正常情况下以没有活性的酶原形式存在,只有被激活后才可以诱导细胞凋亡[16]。Caspase-3是细胞凋亡的执行因子,其活化后能够形成Cleaved Caspase-3,激活细胞凋亡[17]。本次实验表明,缺氧缺糖/复氧复糖处理后的PC12细胞活性下降,LDH和MDA水平升高,SOD、GSH活性降低,ROS水平升高,细胞凋亡和Cleaved Caspase-3蛋白表达水平升高,缺氧缺糖/复氧复糖诱导PC12细胞氧化损伤,促进细胞凋亡发生,说明成功构建了缺氧缺糖/复氧复糖PC12细胞损伤模型。
大黄素具有多种药理学作用,具有抑制组织炎症、清除氧自由基、杀菌等功效[5,8]。以前的研究报道显示,大黄素对于心脑血管疾病具有明显的改善作用[18]。大黄素能够减少心肌缺血再灌注大鼠心肌细胞凋亡,减少氧化应激[19]。脑缺血再灌注大鼠模型经过大黄素治疗以后,大鼠脑组织中Cleaved Caspase-3蛋白表达减少,细胞凋亡减少[20]。过氧化氢条件下的PC12细胞经过大黄素处理以后,细胞中ROS水平下降,细胞活性增加[21]。本次实验显示,大黄素可以减少缺氧缺糖/复氧复糖PC12细胞中ROS水平,提高细胞SOD、GSH活性和细胞活力,减少细胞凋亡,提示大黄素具有抗缺氧缺糖/复氧复糖PC12细胞氧化损伤,减少细胞凋亡的作用,这与上述研究结果相一致,提示大黄素具有保护缺氧缺糖/复氧复糖PC12细胞损伤作用。
NF-κB是一个与细胞凋亡、氧化平衡维持等有关的信号转导通路,其在缺血再灌注损伤中过度激活[22]。NF-κBp65是NF-κB发挥作用的必需亚单位[23]。研究报道显示,大黄素作用机制与NF-κB有关,其可以下调组织中NF-κBp65蛋白表达而发挥抗氧化损伤作用[24]。本次实验显示,大黄素处理后的缺氧缺糖/复氧复糖PC12细胞中NF-κBp65蛋白表达减少,并且NF-κB信号激活剂可以逆转大黄素对缺氧缺糖/复氧复糖PC12细胞损伤保护作用,说明大黄素作用机制与下调NF-κB信号激活程度有关。
总而言之,大黄素可能具有抗脑缺血再灌注损伤的作用,其可以抑制缺氧缺糖/复氧复糖PC12细胞氧化损伤,减少细胞凋亡,作用机制与下调NF-κB信号通路的激活水平有关。本次实验为研究大黄素在脑缺血再灌注损伤中的作用机制提供了参考,为大黄素治疗脑缺血再灌注损伤提供了理论支持。

