CT成像评估心房颤动患者CPVA术疗效的临床研究*
孟 岩 王 静 邢 艳
新疆医科大学第一附属医院影像中心室(新疆 乌鲁木齐 830000)
心房颤动(atrial fibrillation,AF)为临床常见的快速型心律失常,大部分AF患者异位兴奋病灶位于肺静脉心肌袖,而AF又能造成左心房及肺静脉结构及电重构,使患者心功能损伤[1]。环肺静脉口电隔离术(CPVA)为目前治疗AF最常用术式,可破坏AF发生与维持机制,避免AF发生,也能使肺静脉、左心房、左心耳逐渐恢复至窦性心律时的正常功能,从而发生逆重构,以长期维持窦性心律[2]。目前,临床多通过超声评估手术前后血流动力学情况,以判断CPVA手术疗效,但超声对组织解剖结构的诊断效果不佳,难以直观评估手术前后左心房及肺静脉结构变化[3]。电子计算机断层扫描(CT)则具有较高的组织分辨率及空间分辨率,可多方位、多角度分析活体左心房、肺静脉解剖结构,不仅能为制定手术方案提供参考依据,还能评估术后左心房、肺静脉结构变化,以观察手术疗效[4]。基于此,本研究回顾性分析我院68例行CPVA治疗的AF患者临床资料,分析CT成像对CPVA治疗效果的诊断价值,现报告如下。
1 资料与方法
1.1 一般资料回顾性分析2017年1月至2018年3月我院68例行CPVA治疗的AF患者临床资料。
纳入标准:符合《2014年AHA/ACC/HRS心房颤动管理指南》[5]中AF诊断标准者;术前及术后行CT三维重建者;术后随访时间≥3个月者;临床资料完整者。
排除标准:心脏瓣膜病变者;伴甲状腺功能亢进者;合并肝、肾等重要器官功能不全者;碘剂过敏者。68例患者根据术后3个月内出现持续性房性心律失常(房性心动过速、心房扑动、再发房颤)判断为复发,并分为无复发组(有效组)和复发组(无效组)。68例患者男性39例,女性29例;年龄41~66岁,平均年龄(53.49±10.16)岁;病程2~10年,平均病程(5.26±1.27)年;合并高血压7例。
1.2 方法68例患者均在局麻下行CPVA治疗,且术前完成3个
月华法林抗凝治疗,术后予以华法林、胺碘酮治疗3个月。于术前及术后3个月行左房及肺静脉CT成像:使用64排螺旋CT扫描仪(美国通用电气公司,型号:Light speed VCT),管旋转速度0.4s/r,管电压120kV,管电流400mA,层厚0.5mm,视野200mm×200mm至240mm×240mm,矩阵512×512;扫描时,指导患者取仰卧位,连接静脉通路及心电门控,行双定位扫描;以胸锁关节上方水平至心膈面下方10mm为扫描范围,取左心房平面为感兴趣层面;使用高压注射器注射对比剂碘海醇(生产企业:上海通用电气药业有限公司,规格:50mL/15g,批准文号:H20000593)50~60mL,注射速率3.5~4.0mL/s,对比剂注射完毕后注射30mL 0.9%生理盐水冲洗;注射对比剂时对感兴趣层面行同层连续动态扫描,以左心房密度达80~100HU为触发点,嘱患者吸气后屏气,心电门控下采集容积参数,采集时间4~7s;扫描后将容积数据传输至工作站,行三维容积重组(VR)、最大密度投影(MIP);测量各支肺静脉开口的径线及其横截面积。
1.3 观察指标记录68例患者左上肺静脉口最大径及最小径(LSPVdmax、LSPVdmin)、左下肺静脉口最大径及最小径(LIPVdmax、LIPVdmin)、右上肺静脉口最大径及最小径(RSPVdmax、RSPVdmin)、右下肺静脉口最大径及最小径(RIPVdmax、RIPVdmin)、左上肺静脉口截面积(LSPVCSA)、左下肺静脉口截面积(LIPVCSA)、右上肺静脉口(RSPVCSA)、右下肺静脉口(RIPVCSA);并根据术后直径减少≥50%定义为狭窄,记录肺静脉最大径及最小径狭窄发生率。
1.4 统计学方法数据采用SPSS 19.0统计软件进行分析,符合正态分布的计量资料以(±s)表示,采用t检验;计数资料以n(%)表示,行χ2检验;P<0.05表示差异具有统计学意义。
2 结 果
2.1 有效组手术前后各支肺静脉开口的径线及其横截面积比较68例行CPVA治疗的AF患者无复发52例,纳入有效组;有效组手术前后LIPVdmax、LIPVdmin水平比较,差异无统计学意义(P>0.05);而术后3个月时,LSPVdmax、LSPVdmin、RSPVdmax、RSPVdmin、RIPVdmax、RIPVdmin、LSPVCSA、LIPVCSA、RSPVCSA、RIPVCSA水平均较术前降低(P<0.05),见表1。
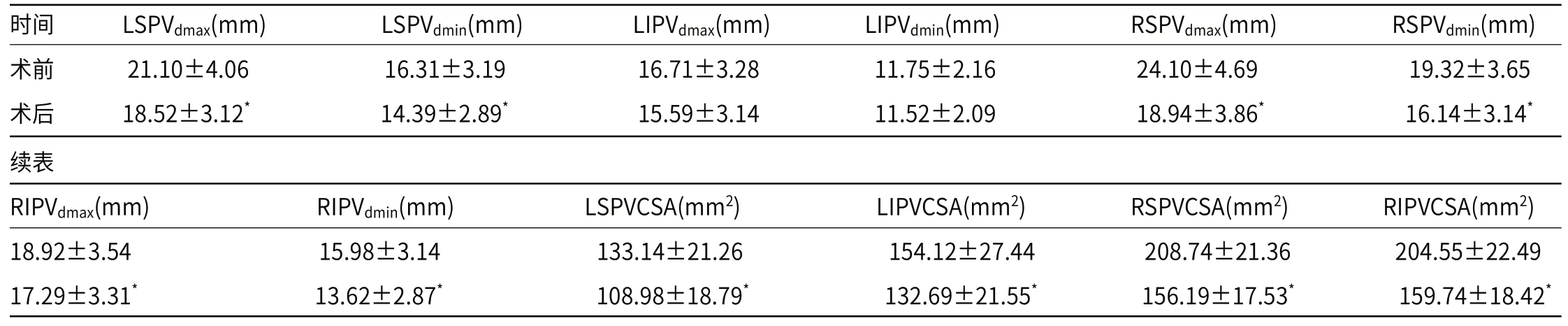
表1 有效组手术前后各支肺静脉开口的径线及其横截面积比较(x-±s)
2.2 无效组手术前后各支肺静脉开口的径线及其横截面积比较68例行CPVA治疗的AF患者复发16例,纳入无效组;无效组手术前后LSPVdmax、LSPVdmin、LIPVdmax、LIPVdmin、RSPVdmax、RSPVdmin、RIPVdmax、RIPVdmin、LSPVCSA、RSPVCSA水平比较,差异无统计学意义(P>0.05);而术后3个月时,LIPVCSA、RIPVCSA水平较术前降低(P<0.05),见表2。

表2 无效组手术前后各支肺静脉开口的径线及其横截面积比较(x-±s)
2.3 两组肺静脉最大径及最小径狭窄发生率比较两组肺静脉最大径及最小径狭窄发生率比较,差异无统计学意义(P>0.05),见表3。
2.4 CT成像分析CT横断面测量肺静脉口面积(图1A),矢状面测量肺静脉口面积(图1B);测量右肺静脉口最大径及最小径(图1C),测量左肺静脉口最大径及最小径(图1D)。

表3 两组肺静脉最大径及最小径狭窄发生率比较[n(%)]

图1 同一患者各肺静脉管径及其面积的测量图像
3 讨 论
临床研究发现,AF患者心房重构的宏观表现为心房体积增大、心房壁变薄,微观表现则为肌细胞排列紊乱、肥大、肌纤维减少;肺静脉结构重构在宏观上表现为肺静脉扩张,微观表现为缝隙连接蛋白与钙蛋白酶重构[6]。CPVA可逆转左心房结构重构,但术后AF的复发仍然能引起肺静脉微观结构重构,且CPVA对左心房后肌壁、肺静脉开口处造成的损伤情况仍需进一步探讨[7]。因此,评估AF患者CPVA手术前后左心房与肺静脉解剖结构及功能,以观察是否复发,有其必要性。
本研究结果显示,有效组术后LSPVdmax、LSPVdmin、RSPVdmax、RSPVdmin、RIPVdmax、RIPVdmin、LSPVCSA、LIPVCSA、RSPVCSA、RIPVCSA水平均较术前降低。说明经CPVA手术治疗无复发的AF患者可出现肺静脉结构逆重构,以长时间维持窦性心律。推测此结果由以下2个因素共同作用引起:AF引起的肺静脉及心房结构重构,而CPVA即使解除AF的发生予维持机制,术后AF停止,心房即可出现逆重构,随着左心房容积缩小,肺静脉口径及其截断面积也缩小;CPVA术中产生的消融能量能损伤心内膜及肺静脉,而在术后早期出现凝固性坏死,继而形成瘢痕组织,导致肺静脉口缩小。而无效组手术前后LSPVdmax、LSPVdmin、LIPVdmax、LIPVdmin、RSPVdmax、RSPVdmin、RIPVdmax、RIPVdmin、LSPVCSA、RSPVCSA水平比较,差异无统计学意义,仅术后LIPVCSA、RIPVCSA水平较术前降低。这也提示CPVA术后AF复发可导致肺静脉难以逆重构,使患者不能维持窦性心律。故上述结果也表明,临床可利用手术前后CT成像,观察左心房及肺静脉解剖结构,以评估是否发生逆重构,而预测患者预后。
此外,本研究还发现,两组肺静脉最大径及最小径狭窄发生率比较,差异无统计学意义,且发生率均处于较低水平。这一结果也可能与CPVA术中消融的为肺静脉口外的心房肌组织,并未直接影响肺静脉结构有关。但消融术后肺静脉狭窄在6个月后达到稳定状态,而本研究随访时间不足6个月。因此,需要延长随访时间,以准确评估CPVA术对患者肺静脉狭窄的影响。
综上所述,CT成像可通过测量CPVA手术前后肺静脉开口的径线与面积,观察患者术后肺静脉逆重构情况,而评估CPVA术疗效,为完善AF诊疗创造条件。