核桃低聚肽对大鼠胃黏膜损伤的保护作用
刘 睿,珠 娜,郝云涛,刘欣然,康家伟,毛瑞雪,胡佳妮,于晓晨,李 臻,李 勇
(北京大学医学部公共卫生学院,北京 100191)
乙醇摄入体内后,通过食管进入胃与小肠,大约有20%可以通过胃黏膜被吸收,大部分通过小肠吸收入血液,吸收入血液的乙醇可以迅速分布于全身组织。乙醇进入消化道后,会对消化道黏膜造成损伤,其中以胃出血、胃溃疡最为常见。因此,饮酒人群的消化道疾病的发病率明显高于非饮酒人群。世界卫生组织报告显示,2016年酒精造成了全球约300万 人死亡(男性约230万、女性约70 万),占所有死亡人数的5.3%,而在可归因于饮酒的死亡人数中,消化系统疾病所占比例为21.3%,对全球公共卫生造成了巨大负担[1]。随着酒精消费和饮酒人数的增加,乙醇相关胃黏膜损伤性疾病的发病率呈逐年上升趋势[2]。但现有临床治疗药物多存在疗效不佳、副作用大、易复发和需长期使用等弊端。因此,从营养治疗的角度出发,寻找安全、有效、能保护胃黏膜免受有害因素侵袭的功效成分,具有重要的科学意义和应用价值。
近年来,生物活性肽,尤其是来源于食品的外源性生物活性肽,因其易被机体吸收、独特的生理活性和安全且无毒副作用的特性已逐渐引起了研究者的关注[3-6]。已有文献报道,几种肽类物质如乳清蛋白和胶原蛋白水解产物[7]、鳕鱼皮胶原肽[8]、水解小麦蛋白肽[9]、小分子大豆多肽[10]等对胃黏膜损伤均有一定的保护作用。核桃低聚肽(walnut oligopeptides,WOPs)是利用生物酶解技术从核桃中提取的小分子生物活性肽,主要是由分子质量很小但活性很高的短肽分子组成,前人研究已证实WOPs具有提高记忆力[11]、抗辐射[12]、润肠通便[13]、提高性功能[14]、抗疲劳[15]及辐射防护[16-17]等多种作用,但目前尚缺乏针对胃黏膜损伤性疾病的研究报道。因此,本实验将在既往研究的基础上,建立无水乙醇诱导的大鼠胃黏膜损伤模型,探讨WOPs对大鼠胃黏膜损伤的保护作用及其可能机制,为胃黏膜损伤疾病的防治和WOPs的开发利用提供理论和实验依据。此外,由于本课题组前期在小鼠背部皮肤切口手术模型中发现牛骨胶原低聚肽(bovine collagen oligopeptides,BCOPs)具有一定的促进皮肤伤口愈合的作用,其机制可能与提高小鼠营养状况、抑制炎症反应和促进基质细胞衍生因子分泌有关[18-19],因此,本实验设置了BCOPs与WOPs的配伍组,以探讨它们配伍后对胃黏膜损伤的联合保护效应。
1 材料与方法
1.1 动物、材料与试剂
80 只健康雄性SD大鼠,体质量(200±20)g,购自北京大学医学部实验动物中心,使用许可证号:SYXK(京)2016-0041;生产许可证号:SCXK(京)2016-0010。
WOPs购自吉林肽谷生物工程有限责任公司。通过高效液相色谱法分析WOPs分子质量及氨基酸组成,分子质量小于1 000 Da的低聚肽占86.5%,小于2 000 Da的肽类比例高达96.5%,游离氨基酸含量为2.98 g/100 g,其中精氨酸、苯丙氨酸、酪氨酸、亮氨酸含量较高。
BCOPs由吉林肽谷生物工程有限责任公司提供,用凯氏定氮仪测定其肽含量为92.77 g/100 g、酸溶蛋白含量为95.5 g/100 g。由高效液相色谱仪分析其游离氨基酸组成,发现氨基酸总量占2.73%,其中精氨酸、酪氨酸、苯丙氨酸、亮氨酸和赖氨酸含量较高。
无水乙醇(分析纯) 国药集团化学试剂北京有限公司;丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、肌酐(creatinine,CR)、肌酸激酶(creatine kinase,CK)试剂盒 英科新创(厦门)科技有限公司;胃蛋白酶原(pepsinogen,PG)、黏蛋白(mucin,MUC)、胃泌素(gastrin,GAS)试剂盒 北京麦格泰克科技有限公司。
1.2 仪器与设备
AdventurerTM通用型分析天平 美国奥豪斯国际贸易有限公司;LXJ-IIC低温高速离心机 德国Eppendorf公司;GNP-9080型隔水式恒温培养箱 上海创奕科教设备有限公司;FSH-2A可调高速电动匀浆机 金坛市金南仪器厂;AU400全自动生化仪 英科新创(厦门)科技有限公司;FLUOstar Omega多功能酶标仪 德国BMG Labtech公司;JEM-100CXII透射电子显微镜日本电子株式会社。
1.3 方法
1.3.1 实验动物分组与处理
本课题组前期研究发现,WOPs以440 mg/kgmb剂量灌胃实验动物时,表现出较好的提高学习记忆、抗疲劳和增强免疫力的效果[11,15]。因此,本实验在此基础上,以440 mg/kgmb为中间剂量,设置了低、中、高3 个WOPs剂量组,以进一步探索WOPs的最佳干预剂量。此外,研究发现当BCOPs以1.5 g/kgmb的剂量进行干预时,表现出较好的促进皮肤伤口愈合的效果,因此选择该剂量为与WOPs的配伍剂量。本实验除设立蒸馏水对照组外,还设置了乳清蛋白作为蛋白质对照组,乳清蛋白是一种营养价值较高的优质蛋白,所含必需氨基酸种类齐全、数量充足且比例适当,具有抗氧化、抗病毒、免疫调节等多种生理功能;并选用临床常用质子泵抑制剂奥美拉唑作为阳性药物对照组,其干预剂量是根据药物说明书按人推荐服用剂量通过体质量比例换算得出。
实验大鼠饲养在北京大学医学部屏障环境,温度为(22±2)℃,相对湿度为50%~60%,昼、夜明暗交替时间为12 h/12 h。动物实行分笼饲养,每笼3 只,自由饮水、进食。在适应性喂养一周后,根据体质量将大鼠随机分为8 组:正常对照组、模型对照组、乳清蛋白组(440 mg/kgmb)、阳性药物组(奥美拉唑,20 mg/kgmb)和3 个WOPs低、中、高剂量干预组(分别为220、440、880 mg/kgmb)和1 个配伍组(WOPs 440 mg/kgmb+BCOPs 1.5 g/kgmb),每组10 只。正常对照组和模型对照组给予蒸馏水,乳清蛋白组、奥美拉唑组、WOPs剂量组和配伍组给予相应剂量受试物,灌胃量为1 mL/100 gmb。动物每周称体质量两次,灌胃干预时间为30 d。
1.3.2 胃黏膜损伤模型建立
灌胃30 d后,所有大鼠严格禁食24 h(不禁水)。于末次给药1 h后,除正常对照组外,所有实验组大鼠给予无水乙醇5 mL/kgmb灌胃造模,正常对照组灌胃等量生理盐水[20-21]。1 h后,乙醚麻醉处死动物,股动脉采血,4 ℃、3 000 r/min离心10 min,吸取上清液保存,快速剖腹取出全胃,进行指标的测定。
1.3.3 胃黏膜损伤观察及评分
将胃组织沿胃大弯剪开,冰冻生理盐水洗净胃内容物,用游标卡尺测量出血点或出血带的长度和宽度,并对胃黏膜损伤进行评分,指标包括各实验组胃黏膜损伤程度以及损伤发生率(按公式(1)计算)、损伤积分指数和损伤抑制率(按公式(2)计算)。

损伤积分指数根据下述评分标准进行计算:正常胃黏膜为0 分,损伤长度<1 mm(包括糜烂点)为1 分,1~2 mm为2 分,2~3 mm为3 分,3~4 mm为4 分,损伤长度>4 mm分段测量;若损伤宽度>2 mm,分数乘以2;全胃损伤分数之和为该动物的损伤积分指数[22-23]。

式中:A为模型对照组的损伤积分指数;B为乳清蛋白组、奥美拉唑组、WOPs剂量组和配伍组的损伤积分指数。
1.3.4 大鼠胃黏膜上皮细胞超微结构观察
取胃组织样本(长约2 mm、宽约1 mm)放入体积分数3%的戊二醛溶液中4 ℃固定2 h后,再用质量分数1%四氧化锇常温固定1.5 h,用醋酸双氧铀染色1 h后,采用体积分数50%~100%的乙醇逐级脱水(各15 min),并用无水乙醇/纯丙酮(体积比1∶1)、纯丙酮各脱水10 min后,将组织浸入环氧树脂/纯丙酮(体积比1∶1)中2 h进行渗透,随后采用环氧树脂进行包埋,聚合后,用超薄切片机进行切片(50~70 nm),切片经醋酸铀、枸橼酸铅染色,干燥,最后在电子显微镜下进行观察。
1.3.5 血清生化指标测定
使用全自动生化仪按试剂盒说明书测定血清ALT、AST、CR、CK水平。
1.3.6 胃组织中PG、GAS、MUC质量浓度的测定
取各组大鼠相同部位胃组织,匀浆后采用酶联免疫吸附法,根据试剂盒说明书测定PG(PGI、PGII)、GAS、MUC的质量浓度。
1.4 数据统计与分析
实验数据用平均值±标准差表示,使用SPSS 24.0软件对数据进行分析。单因素方差分析采用最小显著性差异法进行组间的统计检验,以P<0.05具有统计学意义。
2 结果与分析
2.1 WOPs对大鼠体质量的影响
在30 d的实验周期内,各实验组大鼠外观体征和行为活动、粪便性状、食量等均未见异常,无中毒体征及死亡。如图1所示,WOPs灌胃干预30 d后,各组间动物体质量未见明显差异。

图1 WOPs对大鼠初始体质量和终末体质量的影响Fig.1 Effects of WOPs on initial body mass and final body mass of rats
2.2 WOPs对无水乙醇模型大鼠胃黏膜损伤评分的影响
大鼠无水乙醇5 mL/kgmb灌胃造模后,各组大鼠胃黏膜组织均出现不同程度的损伤,损伤发生率达到100%,其中模型对照组大鼠胃黏膜损伤最为严重,损伤积分指数显著高于WOPs各组(P<0.05,P<0.01)。与模型对照组相比,其余各组大鼠胃黏膜损伤情况明显减轻,WOPs高剂量组大鼠的胃黏膜损伤抑制率达到57.39%,高于其他各组。与乳清蛋白组相比,WOPs各组胃损伤积分指数均降低,损伤抑制率升高,其中WOPs高剂量组损伤积分指数与乳清蛋白组相比差异极显著(P<0.01)。奥美拉唑组的干预剂量是根据药物说明书按人推荐服用剂量通过体质量比例换算得到的,在此剂量下大鼠胃损伤积分指数低于模型对照组,但差异并不显著(P>0.05),损伤抑制率仅为12.79%。WOPs高剂量组和WOPs+BCOPs配伍组的损伤积分指数显著低于奥美拉唑组(P<0.01,P<0.05)。

表1 WOPs对无水乙醇模型大鼠胃黏膜损伤评分(n=10)Table 1 Gastric mucosal injury evaluation of absolute ethanol-induced model rats administered with WOPs (n= 10)
2.3 WOPs对无水乙醇模型大鼠胃黏膜上皮细胞超微结构的影响

图2 大鼠胃黏膜细胞超微结构观察(×10 000)Fig.2 Observation on the ultrastructure of rat gastric mucosa (× 10 000)
如图2所示,正常对照组的大鼠胃黏膜细胞结构清晰,细胞核呈圆形,核内染色质分布基本均匀,细胞质内线粒体丰富,嵴短小,细胞内可见较多堆叠排列的粗面内质网(图2A);模型对照组的大鼠胃黏膜壁细胞及主细胞明显肿胀,壁细胞数量增多、体积较大,核内常染色质稀疏,线粒体肿胀,部分线粒体嵴溶解、消失,粗面内质网减少、呈囊泡化(图2B);乳清蛋白组(图2C)和奥美拉唑组(图2D)的胃黏膜壁细胞及主细胞结构清晰,壁细胞轻度肿胀,细胞核呈圆形,核内染色质轻度凝集,细胞质内线粒体丰富,轻度肿胀;WOPs各剂量组随剂量的增加,胃黏膜壁细胞及主细胞结构逐渐趋于正常,细胞肿胀度减轻,细胞核形状逐渐规则,核内染色质均匀,线粒体肿胀度逐渐减轻,粗面内质网丰富(图2E~G);配伍组胃黏膜壁细胞及主细胞结构趋于正常,细胞核形状较为规则,核内线粒体肿胀度较轻(图2H)。
2.4 WOPs对无水乙醇模型大鼠血清生化指标的影响
血清ALT、AST水平可以敏感地反映肝细胞功能状态,如图3所示,与正常对照组相比,模型对照组大鼠血清ALT、AST水平均极显著上调(P<0.01);与模型对照组相比,WOPs低、中、高剂量组及WOPs+BCOPs配伍组ALT水平显著下调(P<0.05,P<0.01),WOPs高剂量组及WOPs+BCOPs配伍组AST水平显著下调(P<0.05);CK、CR水平在各实验组间无显著性差异(P>0.05)。


图3 WOPs对大鼠血清生化指标ALT、AST、CK活力和CR浓度的影响Fig.3 Effects of WOPs on serum ALT, AST, CK and CR levels of rats
2.5 WOPs对大鼠胃组织PG、MUC及GAS质量浓度的影响
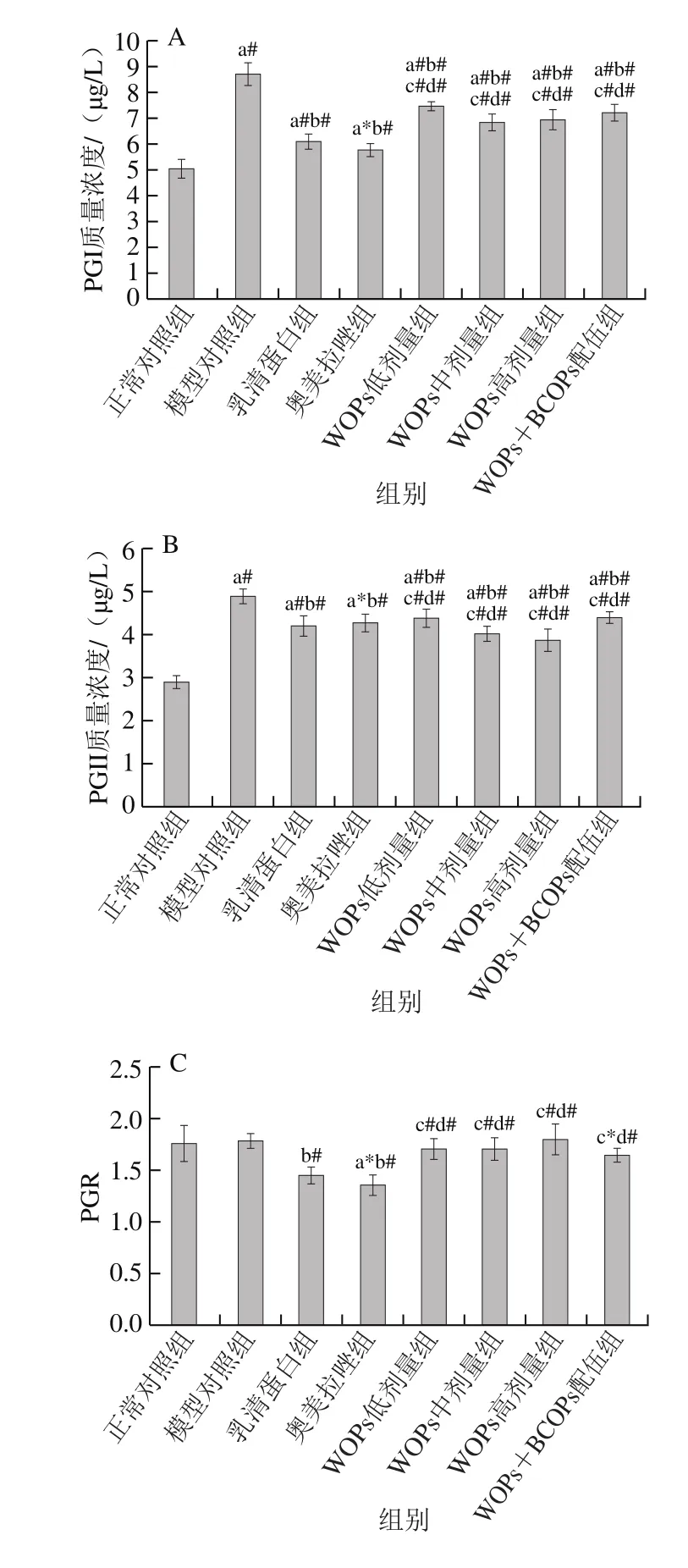

图4 WOPs对大鼠胃组织PGI、PGII、PGR(PGI/PGII)、MUC和GAS质量浓度的影响Fig.4 Effects of WOPs on gastric PGI, PGII, PGR (PGI/PGII), MUC and GAS levels of rats
如图4所示,与正常对照组相比,模型对照组大鼠胃组织PGI、PGII及GAS质量浓度极显著增加,MUC质量浓度极显著降低(P<0.01);与模型对照组相比,乳清蛋白组、奥美拉唑组和WOPs各剂量组PGI、PGII及GAS质量浓度均极显著降低,MUC质量浓度极显著增加(P<0.01);与乳清蛋白组相比,PGI质量浓度、PGR(PGI/PGII)在WOPs各剂量组,PGII质量浓度在WOPs低剂量组均极显著增加(P<0.01),PGII质量浓度在WOPs中、高剂量组及MUC质量浓度在WOPs高剂量组、WOPs+BCOPs配伍组显著降低(P<0.05,P<0.01);与奥美拉唑组相比,WOPs各剂量组的PGI、GAS质量浓度和PGR均极显著增加(P<0.01),PGII质量浓度在WOPs中、高剂量组,MUC质量浓度在WOPs中、高剂量组及WOPs+BCOPs配伍组均极显著降低(P<0.01)。
3 讨 论
动物实验是研究酒精性胃损伤的常用方法,用无水乙醇对大鼠进行灌胃,可导致大鼠腺胃部条状损伤。本实验通过建立无水乙醇诱导的胃黏膜损伤动物模型,来探讨WOPs对胃黏膜损伤性疾病的可能作用。结果发现,经过无水乙醇染毒的大鼠胃黏膜都出现不同程度的损伤,损伤发生率达到100%,其中模型对照组大鼠胃黏膜损伤最为严重,多见黏膜条索状及片状出血,表明乙醇具有强烈的胃黏膜损伤效应,这与Raish[22]和El-Maraghy[23]等的研究结果一致。WOPs干预后胃黏膜损伤情况随剂量的增加得到明显改善,表现在条索状出血较少,宽度缩窄,其中WOPs高剂量组主要以点状出血为主,损伤抑制率达到了57.39%,损伤积分指数极显著低于奥美拉唑组和乳清蛋白组(P<0.01),说明WOPs在一定程度上可以改善乙醇引起的胃黏膜充血、水肿、糜烂和腺体受损等病理损伤,对乙醇诱导的胃黏膜损伤具有较好的保护作用。此外,血清ALT、AST水平是评价早期肝功能损伤的最为敏感的指标,当肝细胞被破坏时,转氨酶便会进入血液,血清或血浆中转氨酶的活力可反映肝细胞受损情况[24]。本实验发现WOPs对酒精引起的ALT、AST水平上调有显著的抑制作用,提示WOPs对酒精诱导的大鼠肝细胞损伤有潜在的保护作用,值得进一步探索研究。
乙醇能上调胃壁细胞中H+-K+-ATP酶的表达,促进胃蛋白酶的分泌,这是胃黏膜损伤的关键因素之一[24]。PG由主细胞分泌,且是蛋白酶的无活性前体,可分为PGI和PGII两种类型,它们可在胃酸的作用下转变为具有活性的胃蛋白酶[25]。PGI、PGII质量浓度及它们的比值PGR(PGI/PGII)可以反映胃黏膜的形态和功能状态,当PGI、PGII质量浓度及PGR升高时,可认为患有胃黏膜损伤性疾病的概率较高,此外PGR还可以用来监测萎缩性胃炎的发生进展[26]。GAS可以通过刺激胃酸的分泌从而改变胃黏膜壁的通透性,加速损伤形成。MUC是胃黏膜表面形成保护性黏液层的关键性糖蛋白成分,由上皮细胞分泌的中性糖蛋白可以在上皮表面形成一层黏液层,可保护上皮细胞免受高浓度酸性胃液的侵蚀。乙醇可通过抑制MUC合成中的关键酶——半乳糖基转移酶的活性,从而减少乙醇脱氢酶和MUC的合成[27]。本实验结果显示,与正常对照组相比,模型对照组PGI、PGII和GAS质量浓度极显著升高,MUC质量浓度极显著降低(P<0.01)。而WOPs干预显著改善了这一变化,与模型对照组相比,WOPs干预减少了PGI、PGII及GAS的分泌,促进了MUC合成,表明WOPs能够对抗乙醇引起的MUC分泌的减少和胃蛋白酶及GAS的过度分泌,从而保护由酒精引起的胃黏膜屏障生理环境的失衡,减少胃酸及各种刺激因子对胃黏膜上皮细胞产生的损伤,从而减轻乙醇诱导的胃黏膜损伤。
综上,WOPs对乙醇诱导的胃黏膜损伤具有较好保护作用,其保护机制可能与增加胃组织MUC质量浓度,降低胃蛋白酶活性和减少GAS的合成有关,这为WOPs应用于胃黏膜损伤性疾病的预防和临床辅助治疗提供了依据。但现阶段关于WOPs的研究多停留在动物实验阶段,以后研究还需在现有基础上,继续优化剂量设置,并在体外研究和人群研究中进一步证实其作用机制及适宜剂量,以期为WOPs在人群中的应用提供更多的理论依据。

