饲养方式对苏尼特羊肌纤维组成和肉品质的影响及其调控机理
侯艳茹,苏 琳,侯普馨,白艳苹,孙 冰,赵丽华,黄凯飚,吕 科,靳 烨,
(1.内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018;2.乌拉特中旗农牧和科技局,内蒙古 乌拉特中旗 015300;3.内蒙古草原晶鑫食品有限责任公司,内蒙古 巴彦淖尔 015000)
苏尼特羊是内蒙古地区优良的肉羊品种,具有产肉量高、肉质细嫩、膻味小、易消化、营养价值高等特点,受到广大消费者的喜爱[1]。随着草场的严重退化,国家出台了很多禁牧、限牧的政策,饲养方式由传统放牧逐步转为舍饲模式。因此,放牧和舍饲这两种饲养方式下苏尼特羊肉品质的差异也成为广大消费者所关注的热点问题。肌纤维是肌肉组织的基本组成单位,其数目在动物出生时已基本固定,但其类型之间可以互相转化,遵循I型→IIA型→IIX型→IIB型的顺序,是决定肉品质的一个重要因素。饲养方式也会对动物肌肉中肌纤维的组成产生影响,研究表明,与舍内饲养猪相比,散养猪的肌肉组织中IIA型肌纤维含量较多,而IIB和IIX型肌纤维含量较少[2]。闫林祥等研究发现,与工厂集约化饲养相比,放养的多浪羊背最长肌的肌原纤维密度较小、直径较大[3]。可见,饲养方式对肌纤维类型的组成有重要影响,而肌纤维的组成会影响肉品品质,因此,研究肌纤维类型及其转化的调节机制是改善肉品品质的重要途径。肌纤维类型的转化受到多种功能基因或相关信号途径的影响,如Ca2+信号途径、一磷酸腺苷激活的蛋白激酶(AMP-activated protein kinase,AMPK)信号途径、miRNA/anti-senseRNA调控等[4]。其中AMPK是细胞能量调节器,可以磷酸化其下游靶分子受体共激活因子——过氧化物酶体增殖物激活受体γ辅助活化因子α(peroxisome proliferator-activated receptor γ co-activator-1 alpha,PGC-1α),促进线粒体生物合成、有氧代谢以及氧化型肌纤维的生成[5]。
因此,本实验以不同饲养方式下(放牧和舍饲)6 月龄苏尼特羊背最长肌为实验材料,分析其肉品质指标的差异性,并利用ATPase染色法和肌球蛋白重链(myosin heavy chain,MyHC)的mRNA表达量对肌纤维类型进行划分,同时对肌纤维转化相关调控基因AMPK、PGC-1α、细胞色素c氧化酶IV(cytochrome c oxidase IV,COX IV)的mRNA表达量以及相关代谢酶(苹果酸脱氢酶(malate dehydrogenase,MDH)、琥珀酸脱氢酶(succinate dehydrogenase,SDH)、乳酸脱氢酶(lactic dehydrogenase,LDH))活力进行分析,旨在为苏尼特羊肉肌纤维类型及其转化机制提供参考,为改善肉品品质提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
选取来自内蒙古巴彦淖尔市乌拉特中旗哈拉图嘎查顺遂农牧农业合作社的体况良好、平均体质量为(18.34±1.86)kg的3 月龄苏尼特羊24 只,随机分为两组(放牧组和舍饲组),每组12 只,公母各半。放牧组以采食沙生针茅、碱韭、矮锦鸡儿、芨芨草等新鲜牧草为主。舍饲组以饲喂玉米秸秆、葵花饼、发酵青贮以及育肥饲料为主。预实验期为7 d,正式实验期为90 d,实验期间羊自由饮水。羊屠宰后取背最长肌作为研究对象。
异戊烷(分析纯) 阿法埃莎(天津)化学有限公司;硫化铵(分析纯) 上海麦克林生化科技有限公司;腺苷-5’-三磷酸二钠盐(分析纯) 北京酷来搏科技有限公司;三氯甲烷(分析纯) 北京化工厂;异丙醇(分析纯) 上海振兴化工二厂有限公司;Tris-Base、醋酸钠、氯化钙、氯化钴 国药集团化学试剂有限公司;RNAiso Plus RNA提取裂解液、PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒、TB GreenTMPremix ExTaqTMII(Tli RNaseH Plus)实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒 大连宝生物工程有限公司;DNase/RNase-free无菌水 北京天根生物技术有限责任公司;MDH测定试剂盒、SDH测定试剂盒、LDH测定试剂盒、总蛋白定量测定试剂盒(BCA法) 南京建成生物工程研究所。
1.2 仪器与设备
MEV冰冻切片机 德国SLEE公司;5417R低温台式冷冻离心机 德国Eppendorf生物公司;LightCycler96实时荧光定量PCR仪 罗氏诊断产品(上海)有限公司;BG-power 3500型稳压稳流电泳仪、水平电泳槽 北京百晶生物技术有限公司;Biometra PCR扩增仪 北京北方华奥贸易有限责任公司;凝胶成像分析系统 美国Bio-Rad公司;pH-STAR型胴体pH值直测仪 德国Matthaus公司;TC-P2A全自动测色色差计上海生物生化实验仪器公司;CLM-3型嫩度仪 上海精密科学仪器有限公司。
1.3 方法
1.3.1 肉品质指标的测定
1.3.1.1 pH值的测定
屠宰后45 min时,使用pH-STAR型胴体pH值直测仪测量背最长肌初始pH值,记为pH0;静止排酸24 h后测背最长肌终pH值,记为pH24。
1.3.1.2 色泽的测定
使用TC-P2A全自动测色色差计对背最长肌色泽进行测定,L*值表示亮度,b*值表示黄蓝度,a*值表示红绿度。每个样品选取3 个位置,重复测定后取平均值。
1.3.1.3 嫩度的测定
将4 ℃保存的背最长肌样品密封后放在75 ℃的水浴中加热45 min,然后取出冷却,至室温后沿着肌纤维的方向将肉块切成3 cm×1 cm×1 cm的条状,使用CLM-3型嫩度仪对剪切力进行测定,每个肌肉样本重复测定6 次后取平均值。
1.3.1.4 蒸煮损失率的测定
实验羊屠宰静置排酸24 h后,称取约30~50 g的肉块,记为m1/g,利用密封袋密封后,以85 ℃的温度在水浴锅中煮40 min,取出。待肉块冷却后,滤纸吸干表面水分,再次称量并记为m2/g。蒸煮损失率按下式计算。

1.3.2 肌纤维组织特性测定
实验羊屠宰45 min内,将背最长肌沿着肌纤维的方向切成0.5 cm×0.5 cm×1 cm大小的肉块,放入经液氮预冷后的异戊烷中脱水干燥30 s,再放入液氮中速冻,用干冰保存并带回实验室后置于-80 ℃的冰箱中保存,用于肌纤维组织特性测定。
将肌纤维样品置于-25 ℃冰冻切片机中,将其横截面切成10 μm厚薄片。用ATPase(pH 4.60~4.65)染色法进行染色[6]。在10×10 倍的显微镜下进行观察,图像用Qwin V3彩图分析软件分析肌纤维特性的各项指标,肌纤维总数不少于1 000 根。
1.3.3 基因表达量的测定
1.3.3.1 样品的采集
实验羊屠宰后45 min内取背最长肌,剪成100 mg左右的小块装入无酶无菌的冻存管中,立即放入液氮中冷冻,带回后实验室保存于-80 ℃冰箱中,作为后续实验用材料。
1.3.3.2 总RNA的提取及测定
利用RNAiso Plus RNA提取裂解液对肌肉中的总RNA进行提取,使用核酸蛋白分析仪检测提取的总RNA浓度(Conc值)和质量(A260nm/A280nm),并用1%(质量分数,下同)的琼脂糖凝胶电泳检测提取的总RNA完整性。
1.3.3.3 反转录
依据反转录试剂盒说明书将总RNA先进行去基因组DNA处理,然后将其反转录为cDNA,并将合成的cDNA质量浓度稀释至10 ng/μL后置于-20 ℃冰箱中保存备用。
1.3.3.4 引物序列来源及合成
AMPKα1、AMPKα2以及GAPDH基因引物序列参照马晓冰[7]的方法设计,MyHC I、MyHC IIA、MyHC IIB和MyHC IIX基因引物序列参照尹丽卿[8]的方法设计,PGC-1α基因引物序列参照Khan等[9]的方法设计,COX IV基因引物序列利用NCBI网站和Primer premier 5.0软件设计,全部基因的引物序列均由上海生工生物工程有限公司合成。

表1 实时荧光定量PCR引物序列Table 1 Primer sequences used for real-time polymerase chain reaction
1.3.3.5 实时荧光定量PCR分析
本实验采用嵌合荧光法,以1.3.3.3节所合成的cDNA为模板,使用TB GreenTMPremix ExTaqTMII(Tli RNaseH Plus)实时荧光定量PCR试剂盒进行实时荧光定量PCR,管家基因和目的基因分别做3 个平行,两个阴性对照。反应体系为:TB GreenTMPremix ExTaqTMII 12.5 μL;dH2O 8.5 μL;上、下游引物(10 μmol/L)各1.0 μL;DNA模板(10 ng/μL)2.0 μL;共25.0 μL。实时荧光定量PCR条件为:95 ℃预变性30 s;95 ℃变性5 s,57 ℃退火30 s,72 ℃延伸30 s,共40 个循环;72 ℃延伸10 min。扩增产物保存于4 ℃冰箱[8]。
本实验采用2-ΔΔCt计算法对实时荧光定量PCR数据进行处理和分析,相对表达量=2-ΔΔCt;ΔΔCt=(Ct目的基因-Ct)-(Ct-Ct)[10]。
内参基因处理组目的基因内参基因未处理组
1.3.4 相关代谢酶活力的测定
MDH、SDH和LDH活力分别按照相应试剂盒说明书进行测定。
1.4 数据统计分析
利用SPSS 19.0数据分析软件进行统计分析,所有数据以平均值±标准差表示。采用单因素方差分析法进行差异显著性分析,P<0.05时表示差异显著;P<0.01时表示差异极显著。
2 结果与分析
2.1 饲养方式对肉品质指标的影响

表2 不同饲养方式下苏尼特羊的肉品质指标(n=12)Table 2 Meat traits of Sunit sheep under different feed regimens (n= 12)
由表2可知,两种饲养方式下苏尼特羊活体质量无显著性差异(P>0.05),而舍饲组的胴体质量显著高于放牧组(P<0.05)。Priolo等对法兰西岛羊进行研究发现,饲喂精饲料圈养组的胴体质量高于散养组[11]。这与本实验结果相一致,说明舍饲饲养对羊的生长性能能够起到提高作用。放牧组L*值显著小于舍饲组(P<0.05),a*值和b*值无显著性差异(P>0.05)。肉色是消费者判断肉新鲜程度的第一感官体验,L*值越大表示肉的亮度越高,肉色发白。放牧组pH0值为6.58,略高于舍饲组(6.45)(P>0.05),静置排酸24 h后,放牧组pH24值极显著低于舍饲组(P<0.01),说明放牧组较舍饲组而言成熟的速度更慢。剪切力可以反映肉的嫩度,剪切力越小,嫩度越好。本实验中放牧组剪切力显著低于舍饲组(P<0.05),说明放牧组的嫩度更好。Bueso等研究表明牧草组的牛肉嫩度更好[12],而Garmyn等却认为集约化养殖的牛肉嫩度更好[13],也有研究表明两种饲养方式养殖的牛肉之间嫩度没有显著差异[14]。这可能与两种饲养的营养水平、动物的品种以及月龄等因素有关。两种饲养方式下羊肉蒸煮损失率无显著性差异(P>0.05)。以上实验结果表明,虽然舍饲组的生长性能优于放牧组,但在肉色和嫩度等肉品质方面不及放牧组。
肌纤维是肌肉组织的基本组成单位,其直径的大小、数量的多少、类型的分布均与肉质性状密切相关[15-16]。因此,本实验又对肌纤维的组成进行了测定,以期从肌纤维角度探寻两种饲养方式下肉品质差异性的原因。
2.2 饲养方式对苏尼特羊肌纤维组成的影响
2.2.1 苏尼特羊背最长肌ATPaes染色结果

图1 放牧组和舍饲组苏尼特羊背最长肌ATPase染色结果Fig.1 ATPase staining of Longissimus doris muscle of Sunit sheep in the pasture and confinement groups
如图1所示,利用ATPase染色法可将肌纤维分为3 种不同的类型,其中I型(慢速氧化型)肌纤维颜色最深,呈黑色,IIA型(快速氧化-酵解型)肌纤维颜色最浅,呈白色,IIB型(快速酵解型)肌纤维介于二者之间,呈棕褐色。
2.2.2 饲养方式对肌纤维数量比例和面积比例的影响
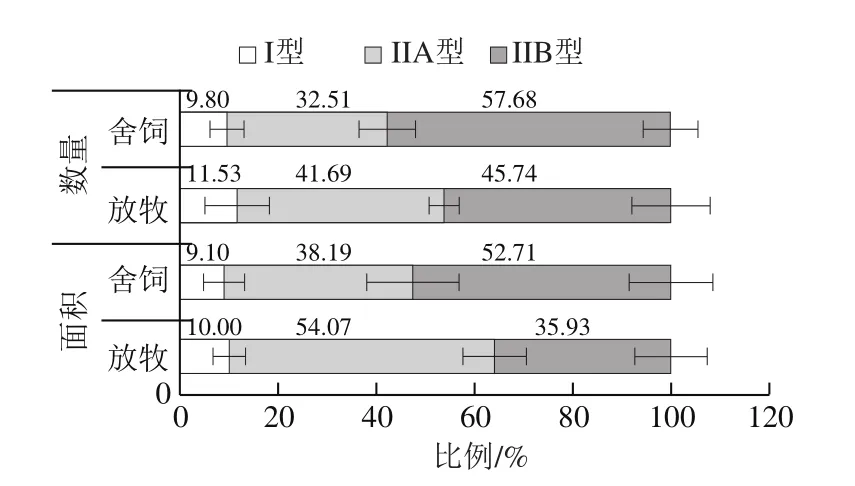
图2 饲养方式对苏尼特羊肌纤维数量比例、面积比例的影响Fig.2 Effect of feed regimens on number proportion and area proportion of muscle fiber in Sunit sheep
由图2可知,放牧组IIA型肌纤维的数量比例和面积比例明显高于舍饲组,而IIB型肌纤维数量比例和面积比例明显低于舍饲组。两种饲养方式下I型肌纤维数量比例和面积比例均无明显差异。放牧组氧化型(I型+IIA型)肌纤维的数量比例为53.22%,舍饲组氧化型肌纤维的数量比例为42.31%。以上结果说明,放牧饲养可以提高氧化型肌纤维的数量比例,降低酵解型肌纤维的数量比例。韩剑众等对不同饲养方式下肉鸡的肌纤维特性进行了分析,发现放养鸡的红肌(氧化型)纤维含量较圈养鸡有所提高[17],这与本实验研究结果一致。
2.2.3 饲养方式对肌纤维直径和横截面积的影响
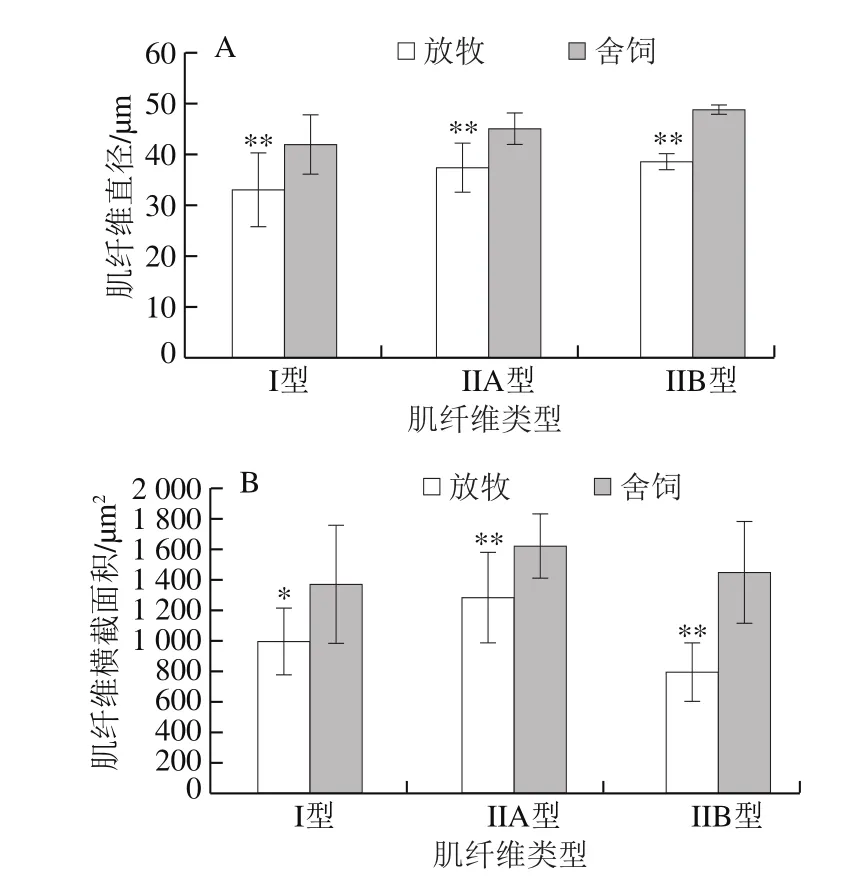
图3 饲养方式对苏尼特羊肌纤维直径和横截面积的影响Fig.3 Effect of feed regimens on diameter and cross-sectional area of muscle fiber in Sunit sheep
由图3可知,放牧组I型、IIA型、IIB型肌纤维直径均极显著小于舍饲组(P<0.01)。放牧组I型肌纤维横截面积显著小于舍饲组(P<0.05),IIA型和IIB型肌纤维横截面积均极显著小于舍饲组(P<0.01)。两种饲养方式下肌纤维直径和横截面积的变化规律一致。闫祥林等研究表明,与工厂集约化饲养相比,放养的多浪羊背最长肌的肌原纤维直径较大[3];朱梦婷等研究发现,笼养组黄羽肉鸡胸肌和腿肌的肌纤维直径均显著小于散养组[18],这与本研究结果相反,这可能是由于动物的年龄、品种、体质量、肌肉部位等因素均会对肌纤维的直径与横截面积有所影响。
2.3 饲养方式对苏尼特羊肌纤维MyHC mRNA表达量的影响

图4 饲养方式对苏尼特羊肌纤维MyHC mRNA表达量的影响Fig.4 Effect of feed regimens on MyHC mRNA expression of muscle fiber in Sunit sheep
依据MyHC的多态性可以将肌纤维分为MyHC I(慢速氧化型)、MyHC IIA(快速氧化型)、MyHC IIX(中间型)和MyHC IIB(快速酵解型)4 种类型[19]。由图4可知,放牧组MyHC I和MyHC IIXmRNA表达量均极显著高于舍饲组(P<0.01)。MyHC IIA和MyHC IIBmRNA表达量在两种饲养方式间无显著性差异(P>0.05)。
根据ATPase染色法对苏尼特羊背最长肌肌纤维类型进行分析得出,放牧饲养提高了肌肉中氧化型肌纤维的比例,降低了酵解型肌纤维的比例。MyHCmRNA表达量分析结果与ATPase染色法结果相一致,放牧饲养提高了氧化型肌纤维的比例。研究表明,酵解型肌纤维中肌红蛋白含量较少,所以酵解型肌纤维比例较高的肌肉中,肉色更加苍白[20]。王莉对牦牛肉肌纤维类型对宰后嫩度的影响进行了研究,结果表明,I型肌纤维比例与剪切力呈负相关关系,即I型肌纤维比例越高,剪切力越低,嫩度越好[21]。肌肉的嫩度还与肌纤维的直径有关,陈坤杰等研究分析了沃金黑牛的肌纤维特性以及肌纤维与嫩度之间的关系,结果表明嫩度随肌纤维直径的增大而下降[22],这与本实验的结果一致。本实验中放牧组背最长肌的pH24值极显著小于舍饲组,这可能是由于舍饲组的酵解型肌纤维比例较高,pH值下降速率和回升速率快,加快了肉的成熟速度[23]。
肌纤维的分析结果与肉品质分析结果相吻合,因此,两种饲养方式下肉品质的差异可能是肌肉中肌纤维类型组成不同而造成的。
2.4 饲养方式对苏尼特羊肌纤维MDH、SDH、LDH活力的影响
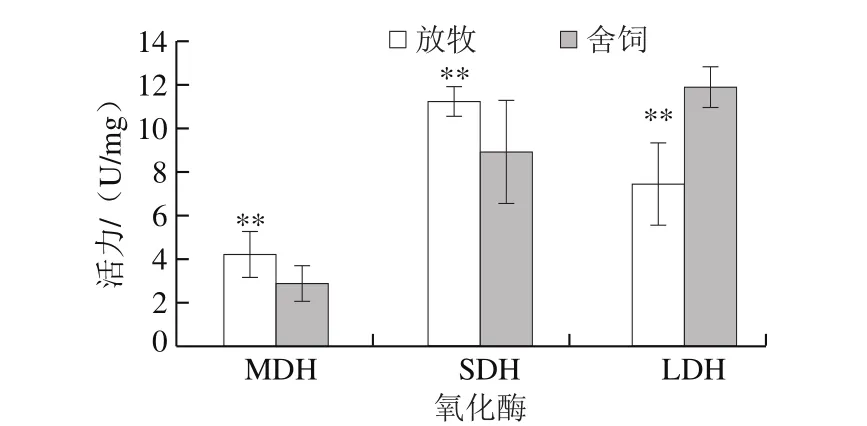
图5 饲养方式对苏尼特羊肌纤维MDH、SDH、LDH活力的影响Fig.5 Effect of feed regimens on MDH, SDH and LDH activity of muscle fiber in Sunit sheep
氧化型肌纤维中存在大量的线粒体,通过线粒体氧化代谢产生能量;酵解型肌纤维中线粒体含量较少,主要通过糖酵解产生能量。MDH是合成苹果酸的关键酶之一,广泛存在于线粒体上,是三羧酸循环中的一种酶,其活力可以表征线粒体有氧代谢的程度。在三羧酸循环中SDH是唯一可以渗入线粒体内膜的有氧代谢限速酶,其活力常用来评价肌肉氧化活性[24]。LDH是一种糖酵解酶,其活性能够反映细胞内无氧酵解的活跃程度[25]。由图5可知,放牧组MDH和SDH活力极显著高于舍饲组(P<0.01),LDH活力极显著低于舍饲组(P<0.01)。这说明放牧饲养能够提高肌肉的氧化酶活力,降低酵解酶活力,与放牧组中氧化型肌纤维比例高、酵解型肌纤维比例低这一结果相一致。
2.5 饲养方式对苏尼特羊肌纤维AMPK、PGC-1α、COX IV mRNA表达量的影响
AMPK信号通路在调节细胞能量代谢中起着核心作用,被称为细胞能量传感器,能够促进线粒体生物合成和氧化型肌肉表型的代谢变化[26]。PGC-1α是骨骼肌中线粒体生物合成的关键调节器,AMPK是其上游调控基因,活化的AMPK能够直接磷酸化PGC-1α促进线粒体生物合成和氧化代谢[27-28]。COX IV是一种氧化还原酶,位于线粒体内膜上,被认为是线粒体生物合成的标志,其活性高低决定了线粒体生物合成水平的高低。并且PGC-1α在富含I型肌纤维的骨骼肌中优先表达,被认为是氧化型肌纤维形成的关键调控因子。Zhang Lin等在对猪和小鼠的骨骼肌特异性过度表达PGC-1α后,发现骨骼肌的线粒体功能增强,同时促进了慢肌纤维也就是氧化型肌纤维的生成[29]。综上所述,AMPK能够直接磷酸化PGC-1α,进而提高骨骼肌线粒体生物合成水平和氧化代谢能力,促进氧化型肌纤维的形成。因此,本实验对AMPK、PGC-1α、COX IVmRNA表达量进行了测定,旨在探寻饲养方式对肌纤维组成的影响机制。

图6 饲养方式对苏尼特羊肌纤维AMPK、PGC-1α、COX IV mRNA表达量的影响Fig.6 Effect of feed regimens on the mRNA expression of AMPK,PGC-1α and COX IV of muscle fiber in Sunit sheep
由图6可知,放牧组AMPKα2和COX IVmRNA相对表达量极显著高于舍饲组(P<0.01),PGC-1αmRNA相对表达量在两种饲养方式间差异不显著(P>0.05),但放牧组较高。赵雅娟研究发现,持续4 周给小鼠皮下注射AMPK激活剂后,PGC-1α基因表达量显著升高,促使肌纤维类型由酵解型肌纤维向氧化型肌纤维转化[30]。Suwa等研究发现,AMPK活性升高可以促使PGC-1α蛋白表达水平和氧化酶活力增加,并且降低了IIB型肌纤维的比例[31]。在本实验中,与舍饲组相比,放牧组苏尼特羊背最长肌中氧化型肌纤维比例增加,酵解型肌纤维比例降低,同时AMPKα2和COX IVmRNA相对表达量极显著上调,这说明饲养方式对肌纤维组成的影响可能是由于放牧饲养增加了AMPKα2mRNA相对表达量,促进机体线粒体的生物合成,提高了肌肉的氧化代谢能力,但PGC-1αmRNA基因的表达水平并没有显著升高,这可能是基因表达时转录和翻译发生的时间和位点存在间隔所造成的。
3 讨 论
通过对放牧和舍饲两种饲养方式下苏尼特羊背最长肌肉品质指标以及肌纤维组成进行测定及分析,可以发现舍饲组的胴体质量显著高于放牧组,这说明舍饲饲养对改善苏尼特羊的生长性能有积极作用。并且放牧组L*值、剪切力和pH24值均显著低于舍饲组,说明放牧饲养降低了肉的亮度,提高了肉的嫩度,降低了pH值回升速度,延长了肉的成熟时间。同时本研究发现放牧组IIA型肌纤维的数量比例和面积比例显著提高,IIB型肌纤维数量比例和面积比例显著降低,I型、IIA型和IIB型肌纤维直径和横截面积显著减小,且放牧组MyHC I和MyHC IIXmRNA相对表达量显著增加。这说明,放牧饲养能够提高氧化型肌纤维的比例,降低酵解型肌纤维的比例,提示肌纤维类型由酵解型向氧化型转化,同时肌纤维直径和横截面积减小。本研究还发现放牧饲养增强了氧化代谢酶MDH和SDH活力,降低了酵解代谢酶LDH活力,这与放牧组中氧化型肌纤维比例高、酵解型肌纤维比例低这一结果相一致。AMPK信号通路在肌纤维类型的转化中起着重要作用,本实验中发现放牧组AMPKα2和COX IVmRNA相对表达量极显著升高,表明放牧饲养提高了AMPKα2的mRNA相对表达量,进而激活位于线粒体内膜上的氧化还原酶COXIV,增强肌肉的线粒体生物合成水平。综上所述,放牧饲养能够通过提高AMPKα2的mRNA相对表达量,增强机体线粒体生物合成水平和氧化代谢能力,促使肌纤维类型由酵解型向氧化型肌纤维转化,降低肉的亮度,提高肉的嫩度,延长肉的成熟时间。
本研究结果显示,虽然舍饲组的生长性能优于放牧组,但在肉色和嫩度等肉品质方面不及放牧组。并且与舍饲相比,放牧饲养提高了氧化型肌纤维的比例,同时提高了MDH和SDH活力以及AMPKα2和COX IVmRNA相对表达量,降低了酵解型肌纤维的比例和LDH活力。这说明放牧饲养能够提高肌肉的线粒体生物合成水平,同时增强肌肉的氧化代谢能力,使肌纤维类型由酵解型向氧化型转化,进而改善肉品品质。因此,未来可通过AMPK信号通路调控肌纤维类型的转化,从而使肉品品质得以提高。

