酶法制备瓜尔胶水解物的体外酵解特性分析
王金梦,孙春晓,吴勃,,王云龙,丁文涛,3,郭庆彬,3*,王昌禄,3*
(1.天津科技大学 食品科学与工程学院,天津 300457;2.杭州保安康生物技术有限公司,浙江 杭州 310014;3.天津科技大学 省部共建食品营养与安全国家重点实验室,天津 300457)
瓜尔胶(guar gum,GG),又名瓜尔豆胶,是一类天然的半乳甘露聚糖。瓜尔胶主链的甘露糖通过β-(1,4-)糖苷键连接,侧链的半乳糖通过α-(1,6-)糖苷键连接在主链上,甘露糖和半乳糖的摩尔比约为2∶1。瓜尔胶的平均分子量为250~5 000 kDa,可用作食品添加剂、药物载体、饲料黏合剂等。然而,将高分子量的天然瓜尔胶添加到动物饲料中,可引起某些单胃动物的不良反应,这与胃肠中食糜黏度增加有关,限制了其在饲料工业中的应用[1]。因此,需要对瓜尔胶进行降解改性,提高实用价值。
瓜尔胶的降解改性主要有物理法、化学法和酶法3 种。物理法主要有热处理[2]、微波[3]、辐照[4]和超声降解[5]等方法。物理法对降解产物的成分和性质的影响较小,但难以控制产物的聚合度,不能彻底降解,易造成原料浪费。化学法主要包括氧化降解法和酸降解法[6]。氧化降解法多采用氧化剂,如过氧化氢、过硫酸钾等进行氧化降解。酸降解法通常采用硫酸、盐酸等强酸进行降解。降解过程中加入的试剂可能在产物中残留,对产物的化学成分造成影响。酶法是指通过酶处理瓜尔胶,得到分子量较低的酶解产物,通常采用β-甘露聚糖酶对瓜尔胶进行降解,使主链的β-(1,4-)糖苷键断裂,得到瓜尔胶水解物(guar gum hydrolysate,GGH)。与天然GG 相比,GGH 的链长缩短,分子量和黏度大大降低,可以作为膳食纤维加以利用。与物理和化学方法相比,酶法反应条件温和、产物结构可控,且高效、特异性强,能耗低、无污染,是最常用的降解GG 的方法。
多糖的酵解特性与其分子量、溶解度和单糖组成等性质有关。目前,关于分子量和酵解特性的研究报道相对较多。魔芋甘露聚糖经β-甘露聚糖酶降解后,显著提高了小鼠结肠内的短链脂肪酸(short chain fatty acids,SCFAs)浓度,可能是较低分子量的魔芋甘露聚糖更易被结肠微生物酵解[7]。Ho 等[8]通过研究不同聚合度的低聚木糖和多聚木糖的体外酵解特性发现,低聚合度的低聚木糖/多聚木糖更能促进有机酸的产生和双歧杆菌的生长。
本研究以GG 为原料,通过酶解法制备3 种不同分子量的GGH,采用猪结肠消化物构建体外酵解模型,评价GG 和GGH 的酵解特性,探讨分子量对GGH体外酵解特性的影响。通过细菌16S rDNA 扩增子测序分析技术,评估GG 和不同分子量的GGH 在酵解过程中对肠道菌群组成和结构的影响,以期为GGH 的研究和应用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
瓜尔胶:北京瓜尔润科技有限公司;β-甘露聚糖酶(酶A,187.209 9 IU/g):杭州保安康生物技术有限公司;β-甘露聚糖酶(酶B,117.1032 IU/g):奕农生物科技有限公司;猪结肠消化物:天津农博养猪场。
1.1.2 试剂
乙醇、碳酸钠、氯化钠、硫酸铵、磷酸氢二钾、氯化钙、硫酸镁、硫酸亚铁、硫酸锰、硫酸锌:天津市江天化工试剂公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)试剂、氯化钴、VB1、VB2、VB6、烟酰胺、泛酸钙、对氨基苯甲酸、VH、VB12、叶酸、L-盐酸半胱氨酸、刃天青:北京索莱宝科技有限公司;硫酸、盐酸:天津市化学试剂一厂;硝酸钠:天津市大茂化学试剂厂;甘露糖、脂肪酸标品、2-乙基丁酸:美国Sigma 公司。除甘露糖纯度为优级纯外,其余试剂均为分析纯。
1.2 仪器与设备
磁力搅拌器(LP Vortex Mixer):美国赛默飞世尔科技有限公司;傅里叶红外光谱仪(IS50):广州尼高利科学仪器有限公司;示差高效液相色谱仪(LC-20A)、热脱附气相色谱仪(GC2010 Plus):日本岛津公司;摇床(ZWY-103B):上海智城分析仪器制造有限公司;快速冷冻干燥机(Alpha 2-4 LD plus):德国CHRIST 公司;冷冻离心机(Avanti J-26 XP):北京吉艾姆科技有限公司;高压灭菌锅(LDZH-200KBS):上海申安医疗器械厂;厌氧培养箱(YOX-II):上海新苗医疗器械制造有限公司;pH 计(PB-10):德国赛多利斯公司。
1.3 实验方法
1.3.1 GGH 制备
将10 g 瓜尔胶边搅拌边加入到100 mL 预热至50 ℃、含有40 IU/g 的β-甘露聚糖酶溶液中,持续搅拌反应3 h,沸水浴15 min,灭酶活,离心(4 000 r/min,20 min),分离沉淀和上清液,在上清液中加入3 倍体积的无水乙醇,4 ℃静置12 h,离心(4 000 r/min,20 min),分离沉淀和上清液,浓缩上清液,冻干,得到GGH。根据分子量大小将GGH 分别命名为GGH-1(32.41 kDa)、GGH-2(10.15 kDa)和GGH-3(5.89 kDa),其中GGH-1 为酶A 处理得到的样品,GGH-2 为酶A和酶B 按照3∶1 体积比混合处理得到的样品,GGH-3为酶B 处理得到的样品。
1.3.2 样品分子量测定
将GG 配制成3 mg/mL 的溶液,酶解得到的不同分子量的GGH 配制成10 mg/mL 的溶液,过0.22µm 滤膜,采用示差高效液相色谱仪进行分子量测定。以不同分子量的葡聚糖为标准品,绘制标准曲线。色谱条件:色谱柱为UltrahydrogelTMDP 120A column(分子量测定范围10~400 kDa)和UltrahydrogelTM500 column(分子量测定范围0.1~5 kDa)水溶性凝胶柱串联;保护柱为UltrahydrogelTMDP guard column;柱温40 ℃;流动相为0.1 mol/L 硝酸钠溶液;流速0.6 mL/min;进样量20µL。
1.3.3 猪结肠消化物的制备
新鲜的猪结肠消化物取自6 只健康大猪供体,大猪在近6 个月内未有抗生素治疗史。将收集到的猪结肠消化物等量混合,保存在-80 ℃冰箱待用。
1.3.4 厌氧培养基的配制
根据表1 制备厌氧培养基。
先将成分1 溶于995 mL 超纯水中,用5 mol/L 盐酸调节pH 值为6.8,将溶液转移至1 L 棕色瓶中,超声除气泡。超声结束后,充入氮气,121 ℃灭菌20 min。再将成分2 溶于5 mL 超纯水中,过0.22µm 无菌滤膜除菌,充入氮气。最后,在厌氧箱中将成分1 和成分2 溶液混合。
1.3.5 体外模拟肠道酵解
在体外酵解体系中,将GG 及不同分子量的GGH样品、猪结肠消化物与厌氧培养基混合。GG 及不同分子量的GGH 样品作为碳源,浓度为1%(g/mL),猪结肠消化物浓度为10%(g/mL)。参考Ding 等[9]的方法进行实验,具体如下:在离心管中分别称取GG 和不同分子量的GGH 样品各0.06 g,加入6 mL 厌氧培养基,溶解,获得样品溶液。在厌氧箱中,称取0.6 g 猪结肠消化物于离心管中,加入样品溶液,并充分混匀。空白组(negative control,NC)只添加0.6 g 猪结肠消化物和6 mL 厌氧培养基,无碳源。
采用封口膜将离心管封口,装入厌氧袋,在37 ℃、250 r/min 厌氧培养箱中发酵0、6、12、24、48 h,依次取样。发酵后的样品在11 000 r/min、4 ℃下离心20 min,分离沉淀和上清液。上清液过0.45µm 无菌滤膜,储存于-80 ℃冰箱,用于后续pH 值、总糖含量、还原糖含量、分子量、短链脂肪酸浓度等指标的测定,沉淀用于肠道菌群的测定。
1.3.6 酵解液分子量测定
酵解液过0.22µm 滤膜后,采用示差高效液相色谱仪进行分子量测定。色谱条件同1.3.2。
1.3.7 酵解液糖含量测定
参考Yin 等[7]的方法,采用苯酚-硫酸法测定酵解液总糖含量。采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)试剂盒测定酵解液还原糖含量。
1.3.8 酵解液pH 值测定
取1~2 mL 上清液于10 mL 离心管中,采用pH 计测定不同发酵时间酵解液的pH 值。
1.3.9 短链脂肪酸浓度测定
参考Wang 等[10]的方法对酵解液进行处理,利用热脱附气相色谱仪对短链脂肪酸浓度进行测定。色谱条件:色谱柱为NukolTMFused Silica Capillary Column(60 cm×0.25 mm×0.25µm);进样口温度200 ℃;火焰离子化检测器(flame ionization detector,FID)温度250 ℃;H2流速40 mL/min;空气流速400 mL/min;进样量1µL。
1.3.10 酵解物肠道菌群检测
将GG 和3 种不同分子量的GGH 的体外模拟肠道酵解液在11 000 r/min、4 ℃下离心20 min,得到菌体沉淀送检,进行16S rDNA 宏基因组测序,进行肠道菌群分析。
1.4 数据处理与统计分析
所有实验均重复进行3 次,数据以平均值±标准差表示。使用SPSS 和Duncan 方法,对数据进行方差分析和多重测试分析,P<0.05 时表示处理的结果存在显著性差异。
2 结果与分析
2.1 GG 和GGH 的分子量
根据1.3.2 的方法测定GGH 和GG 的分子量,结果如图1 所示。

图1 GG 和3 种GGH 的HPSEC 谱图Fig.1 HPSEC spectra of GG and three GGHs
由图1 可知,通过GG 和GGH 的保留时间,计算得到GG 的分子量为790.25 kDa,而GGH-1、GGH-2 和GGH-3 的分子量分别为32.41、10.15、5.89 kDa。与GG相比,GGH 的分子量大幅降低,这是由于β-甘露聚糖酶使瓜尔胶主链断裂,链长缩短,聚合度降低,与相关文献报道一致[11]。
2.2 酵解过程中分子量的变化
对GG 和3 种不同分子量的GGH 接种猪结肠消化物后的酵解特性进行了对比。酵解过程中样品的分子量变化如图2 所示。
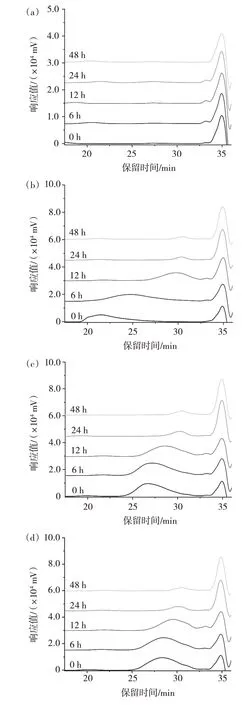
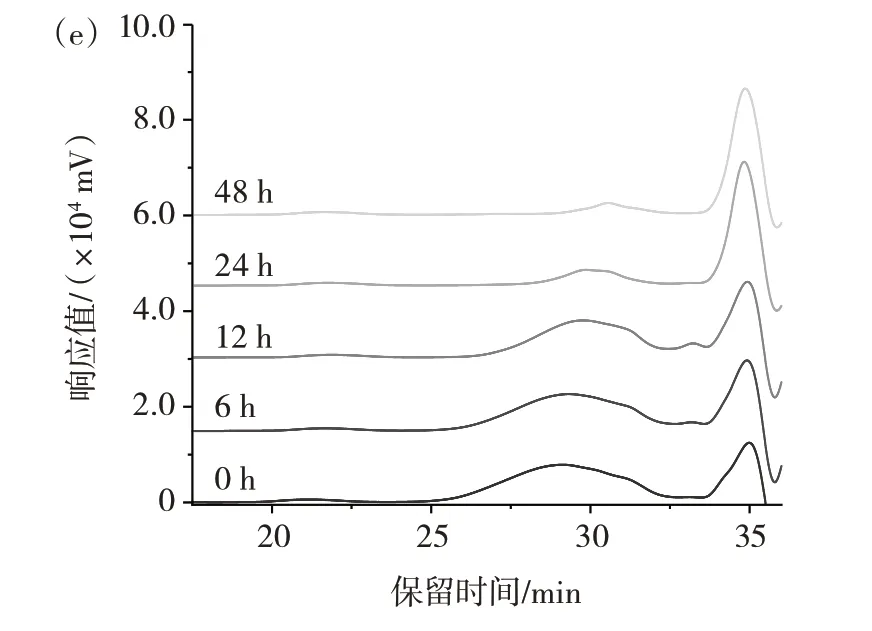
图2 酵解过程中分子量的变化Fig.2 Changes of molecular weight during fermentation in vitro
图2 中34.9 min 处的峰来自于猪结肠消化物和厌氧培养基中的物质,出峰时间晚于样品,因此,不影响酵解过程中样品分子量的检测。由图2(b)可知,酵解到6 h 时,GG 的分子量由最初的790.25 kDa 降至96.8 kDa。3 种GGH 也被快速发酵,到12 h 时,其分子量分别为8.5、4.7、4.2 kDa。酵解进行到24 h 时,样品分子量进一步降低,且样品峰的比例持续降低,表明在体外模拟酵解过程中,肠道微生物可以持续利用GG和不同分子量的GGH 作为碳源进行酵解。酵解48 h时,样品分子量变化很小,说明样品基本完成酵解。在体外酵解模型中,GG 和不同分子量的GGH 可以被肠道菌群酵解利用,生成小分子的代谢产物。其他的多糖,如阿拉伯木聚糖[12]、罗望子多糖[13]、雪菊多糖[14]等也表现出相同的趋势。多糖的酵解特性与溶解度、单糖组成等理化特性有关。溶解度高、聚合度低的多糖发酵速率高,主要在结肠近端发酵,而不溶性和高聚合度的多糖发酵速率较低,在结肠远端发酵[15]。因此,为了延长发酵时间,需要进一步研究多糖的酵解特性,以确定最有利的理化特性。
2.3 酵解过程中糖含量的变化
肠道微生物可以产生糖苷水解酶来破坏碳水化合物中相应的糖苷键,并逐渐利用产生的寡糖,从而导致酵解体系中总糖含量降低,因此,可以通过糖含量的变化来确定碳水化合物的发酵程度。体外酵解过程中总糖和还原糖含量的变化如图3 所示。
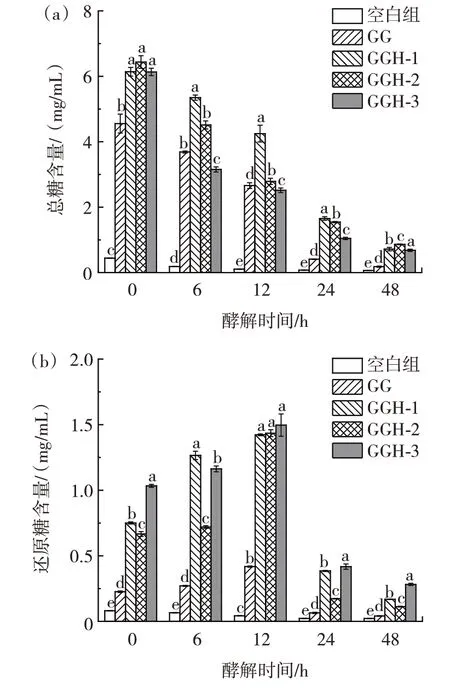
图3 酵解过程中糖含量的变化Fig.3 Changes of sugar content during fermentation in vitro
由图3(a)可知,在酵解过程中,空白组总糖含量几乎无变化,而实验组的总糖含量随酵解时间延长均呈快速下降趋势。到发酵结束时,GG 由最初的(4.55±0.29)mg/mL 降至(0.18±0.02)mg/mL;GGH-1、GGH-2和GGH-3 则分别由(6.14±0.13)、(6.44±0.19)和(6.13±0.11)mg/mL 降至(0.72±0.05)、(0.86±0.01)和(0.68±0.03)mg/mL。总糖含量降低,说明GG 和不同分子量的GGH 可以作为碳源供肠道微生物酵解利用。
从图3(b)可知,在整个酵解过程中,除空白组的还原糖含量几乎无变化外,实验组的还原糖含量均呈现出先增后减的趋势,均在酵解12 h 时达到峰值,说明微生物可以酵解利用GG 和不同分子量的GGH,导致其分子中的糖苷键断裂,生成小分子糖,并进一步利用小分子糖,产生代谢物质。其中GGH-3 在12 h 时还原糖含量达到最大值(1.50±0.08)mg/mL,与GGH-1、GGH-2 接近,显著高于GG 处理组(P<0.05)。12~48 h内,实验组还原糖含量迅速降低,可能是由于样品本身含有的还原糖以及酵解过程中产生的还原糖被微生物利用。铁皮石斛多糖在体外酵解过程中糖含量也表现出类似的变化趋势,多糖不断被结肠微生物酵解,总糖含量逐渐降低,还原糖含量先增后减,说明多糖可以作为碳源被肠道微生物利用[16]。
2.4 酵解过程中pH 值的变化
pH 值可以作为体外酵解实验中的重要指标,反映酵解体系中碳水化合物的利用和有机酸的产生情况。图4 展示了酵解过程中pH 值的变化。

图4 酵解过程中pH 值的变化Fig.4 Changes of pH during fermentation in vitro
由图4 可知,各组初始pH 值均在8.00 以上。随着酵解的进行,空白组pH 值略降低,从最初的8.13±0.03降至7.38±0.05。GG 和不同分子量的GGH 在0~24 h内,pH 值显著降低(P<0.05)。其中6~12 h 内,pH 值的降低速率最快,说明在6~12 h 内微生物酵解GG 和不同分子量的GGH,产生短链脂肪酸的代谢活动最为活跃。酵解到48 h 时,各实验组的pH 值变化趋于平稳,说明GG 和不同分子量的GGH 基本被微生物完全酵解利用,产生短链脂肪酸的速度减缓,因此,pH 值基本保持不变。同时,除发酵初始外,实验组pH 值均显著低于空白组(P<0.05),这与Paesani 等[12]研究结果一致。降低结肠和粪便的pH 值,可能对结肠环境有益。酸性环境可以抑制某些致病菌的增殖,从而刺激有益细菌,如双歧杆菌、丁酸和乳酸发酵细菌的增殖[15]。
2.5 酵解过程中SCFAs 浓度的变化
SCFAs 是微生物酵解多糖产生的主要产物,是重要的能量和信号分子[17],多糖的理化特性与肠道菌群的酵解代谢有关,从而影响SCFAs 的生成[18]。图5 展示了体外酵解过程中酵解液的总SCFAs、乙酸、丙酸和丁酸的浓度变化。
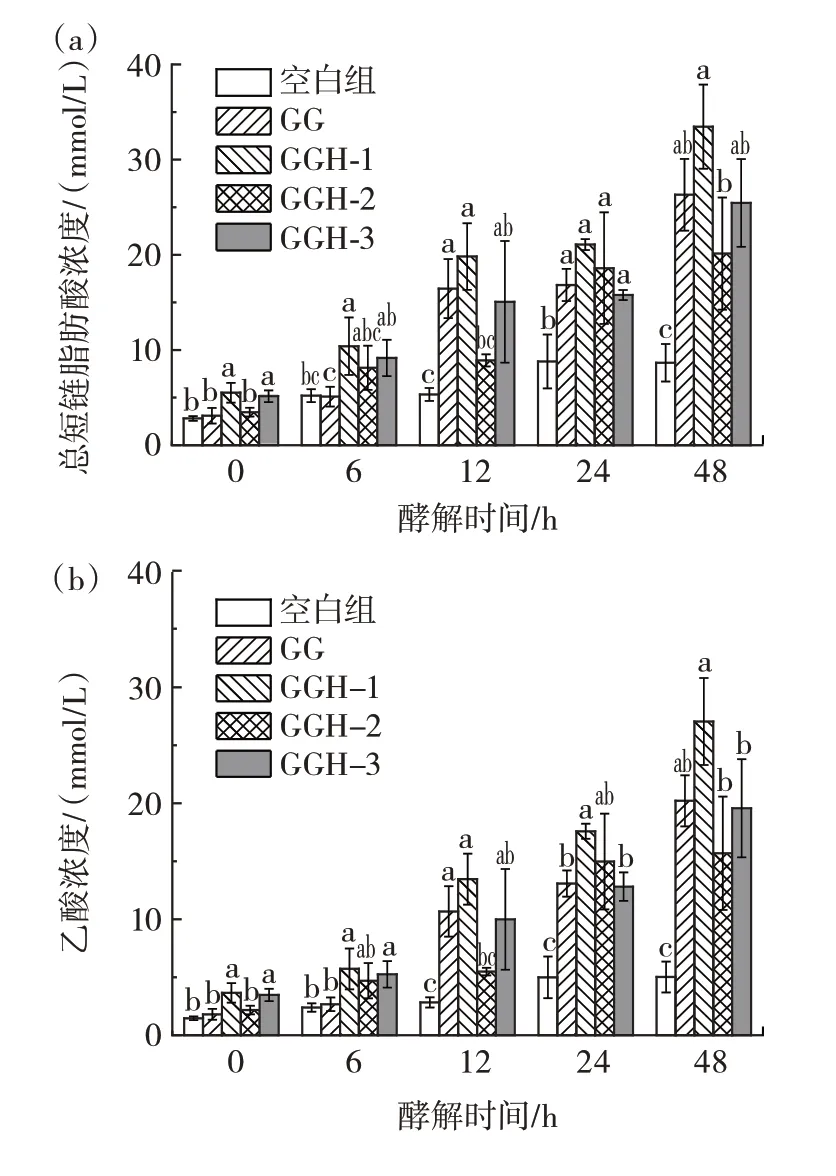
图5 酵解过程中SCFAs 含量的变化Fig.5 Changes of SCFAs content during fermentation in vitro
由图5 可知,随着酵解时间的延长,各处理组的总SCFAs 浓度均呈现出逐渐增长的趋势,说明微生物可以持续利用GG 和不同分子量的GGH,产生低分子量的寡糖或单糖,进而生成SCFAs。酵解6 h 时,GGH-1的总SCFAs 浓度最高,其次是GGH-3 和GGH-2。继续酵解至12 h,GG 的总SCFAs 浓度迅速升高,为(16.45±3.10)mmol/L,仅次于GGH-1。24 h 时,GGH-2的总SCFAs 浓度从12 h 的(8.91±0.64)mmol/L 增加至(18.60±5.86)mmol/L。酵解结束时,各处理组总SCFAs 浓度均达到峰值。其中,GGH-1 的浓度最高,为(33.46±4.42)mmol/L;随后依次是GG、GGH-3 和GGH-2,其总SCFAs 浓度分别是空白组的3.04、2.93 倍和2.32 倍。
在体外酵解过程中,乙酸是肠道微生物酵解利用碳水化合物产生的主要产物。GGH-1 的乙酸浓度最高,在48 h 时达到峰值。在酵解过程中,实验组的乙酸浓度变化趋势与总SCFAs 浓度变化趋势基本一致,Reichardt 等[19]研究也证实,半乳甘露聚糖在酵解过程中乙酸形成的动力学与总SCFAs 相似。丙酸浓度也在48 h 时达到最大值,其中,GG 和GGH-3 的丙酸浓度较高。酵解到12 h 时,GG、GGH-1 和GGH-3 的丁酸浓度达到最大值。其中,GGH-1 的产丁酸效果最好,丁酸浓度从发酵初始的(0.35±0.07)mmol/L 增加到(2.91±0.67)mmol/L。
肠道微生物酵解利用多糖产生的SCFAs 对宿主健康有益。在本研究中,产生的SCFAs 以乙酸为主,乙酸不仅可以为心脏、大脑和肌肉供能,而且在糖异生、脂肪生成和胆固醇合成中也起着重要作用[20]。丙酸可以增加葡萄糖摄取和脂肪生成,对脂肪组织有直接的有益作用[21]。丁酸是肠上皮细胞主要的能量来源,在调节肠上皮细胞、T 细胞增殖和肠道免疫应答中发挥重要作用[22]。
2.6 肠道微生物的测定
2.6.1 Alpha 多样性分析
由2.5 的结果可知,添加GG 和不同分子量的GGH 后,酵解体系中的乙酸、丙酸、丁酸等代谢产物浓度增加,由此推测,在GG 和不同分子量GGH 的酵解过程中,肠道菌群发生了明显变化,因此,对酵解物进行肠道菌群检测和对比分析。图6 为样品的稀释性曲线,表2 为各组样本的Shannon 指数。
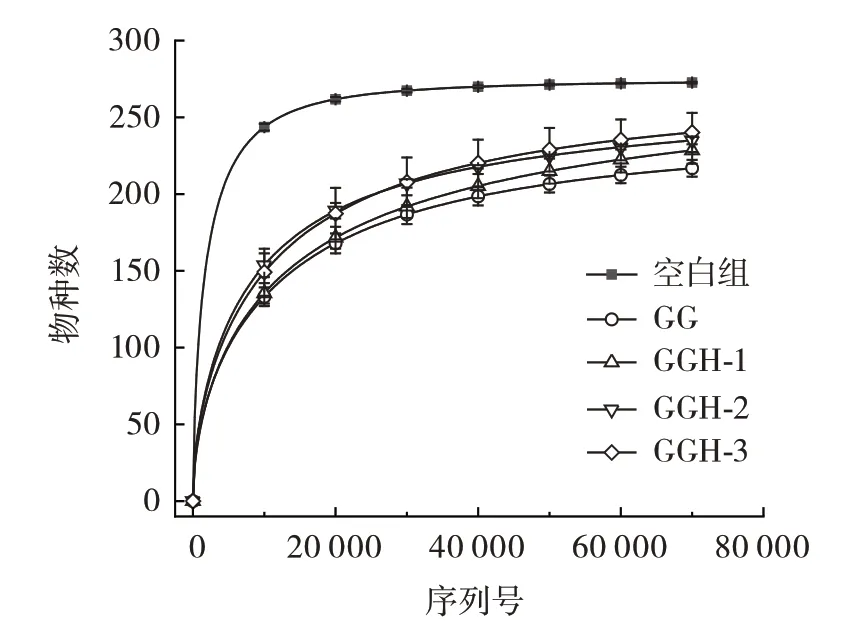
图6 各组样本的稀释性曲线Fig.6 Rarefaction curve in various groups
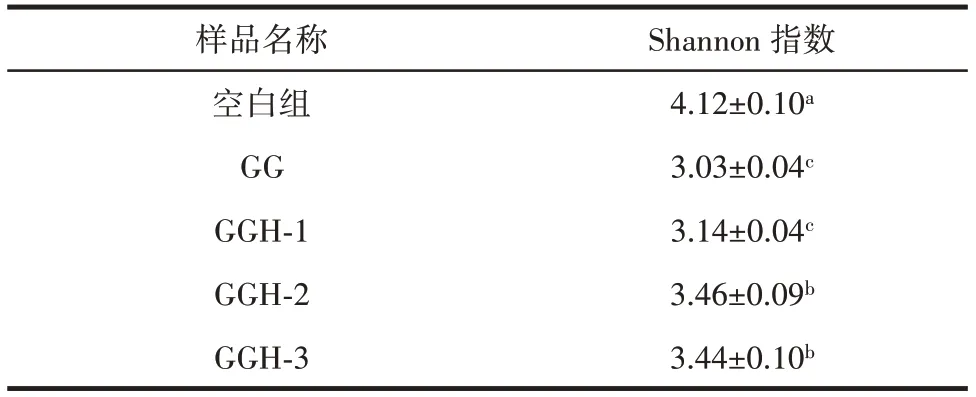
表2 各组样本的Shannon 指数统计Table 2 Shannon index statistics of intestinal microbiota
稀释性曲线可以反映数据的合理性和连续抽样条件下新特征出现的速率。从图6 中可以看出,随着测序条数的不断增加,发现的物种逐渐增多,稀释性曲线逐渐趋于平缓,说明样品序列充分,测序数据量合理,能够反映样本的肠道菌群分布状况,可以进行数据分析。此外,Shannon 指数与肠道菌群多样性呈正相关。在本研究中,空白组的Shannon 指数显著高于实验组,可能是由于体外酵解模型缺乏宿主对肠道菌群的调节以及对营养物质的吸收利用[23],某些菌种在相对匮乏的营养条件下,在对碳源的竞争中处于劣势,因此,这些菌种的增殖受到影响,导致肠道菌群多样性降低。
2.6.2 主坐标分析(principal coordinates analysis,PCoA)
PCoA 可以反映主成分对样本差异的贡献值,或对群落样本的解释度。酵解24 h 后的肠道菌群样本基于bray-curtis 算法的PCoA 如图7 所示。
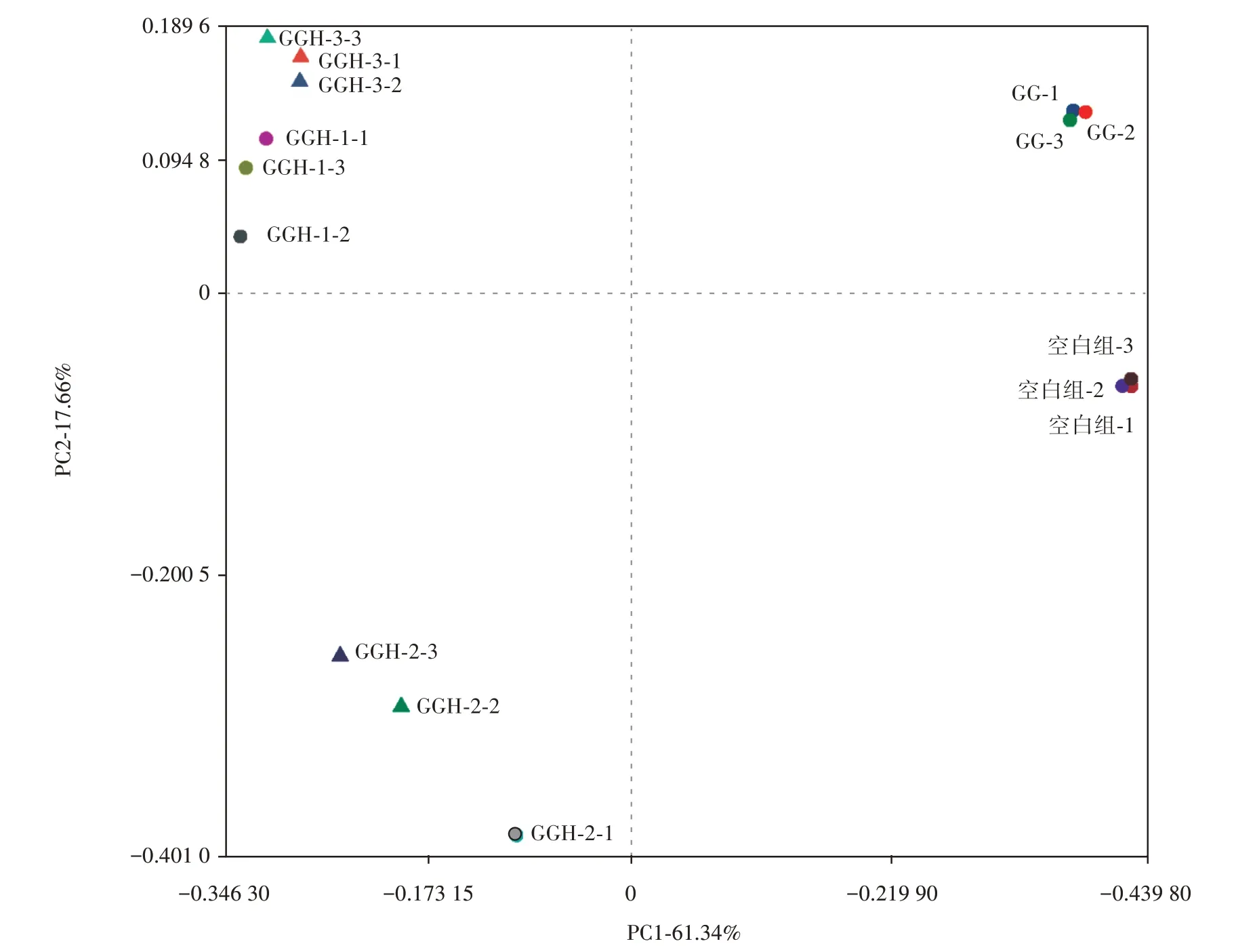
图7 各组样本基于bray-curtis 的主坐标分析Fig.7 Principal co-ordinates analysis(PCoA)based on bray-curtis distance in various groups
由图7 可知,各组内样本间距离较近,说明组内3 个平行间微生物群落结构相似,平行效果较好。酵解24 h后,实验组与空白组距离较远,说明实验组与空白组的物种组成存在差异。而且,GG 和不同分子量的GGH对于微生物群落结构造成的影响是不同的。与3 种GGH 相比,GG 与空白组之间的距离更近,说明添加瓜尔胶的结肠消化物的菌落结构与空白组更接近,3 种不同分子量的GGH 对菌落结构的影响更大。
2.6.3 门分类水平的物种分布
物种分布柱状图可以显示不同物种在肠道菌群中所占的比例,图8 为GG 和不同分子量的GGH 酵解24 h 时,对厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)的影响。
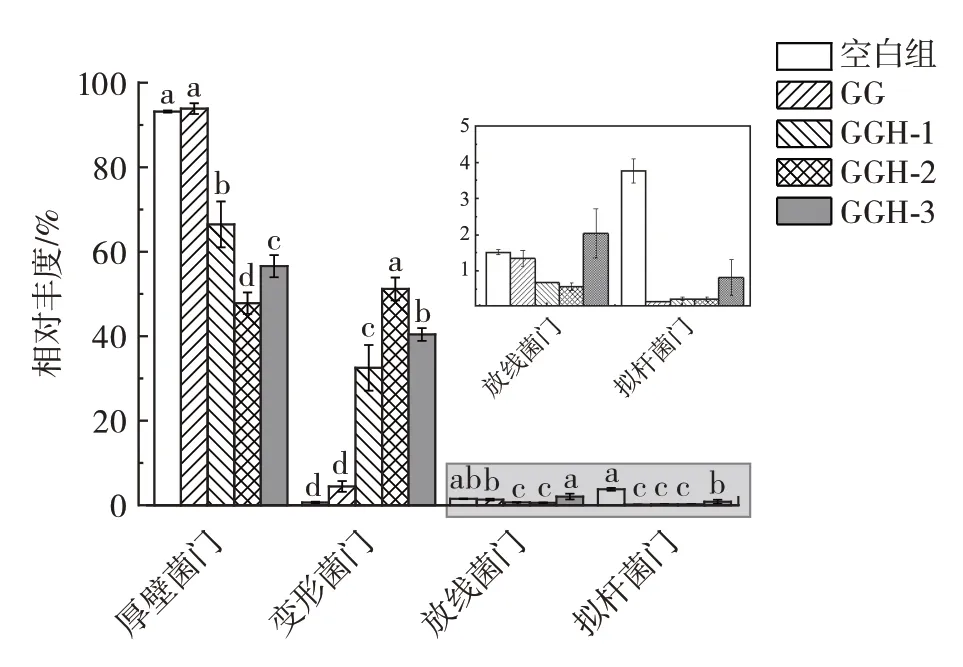
图8 GG 和GGH 酵解24 h 后门水平物种分布的变化Fig.8 Changes of flora on the phylum level after 24 h fermentation of GG and GGH
由图8 中可知,各组样品中厚壁菌门和变形菌门的数量占比较高,在90%以上,其中,厚壁菌门的相对丰度最高,均在40% 以上。与空白组相比,酵解24 h后,不同分子量GGH 处理组的厚壁菌门相对丰度减少(P<0.05),而变形菌门相对丰度大幅增加(P<0.05);GG 处理组厚壁菌门相对丰度与空白组相似,变形菌门的相对丰度略增加,但效果不显著(P>0.05)。此外,GG 与GGH 处理组的拟杆门丰度均显著低于空白组(P<0.05)。
2.6.4 属分类水平的物种分布
图9 为GG 和不同分子量的GGH 酵解24 h 时在属分类水平上对肠道菌群的影响,图中展示了相对丰度前10 的物种。
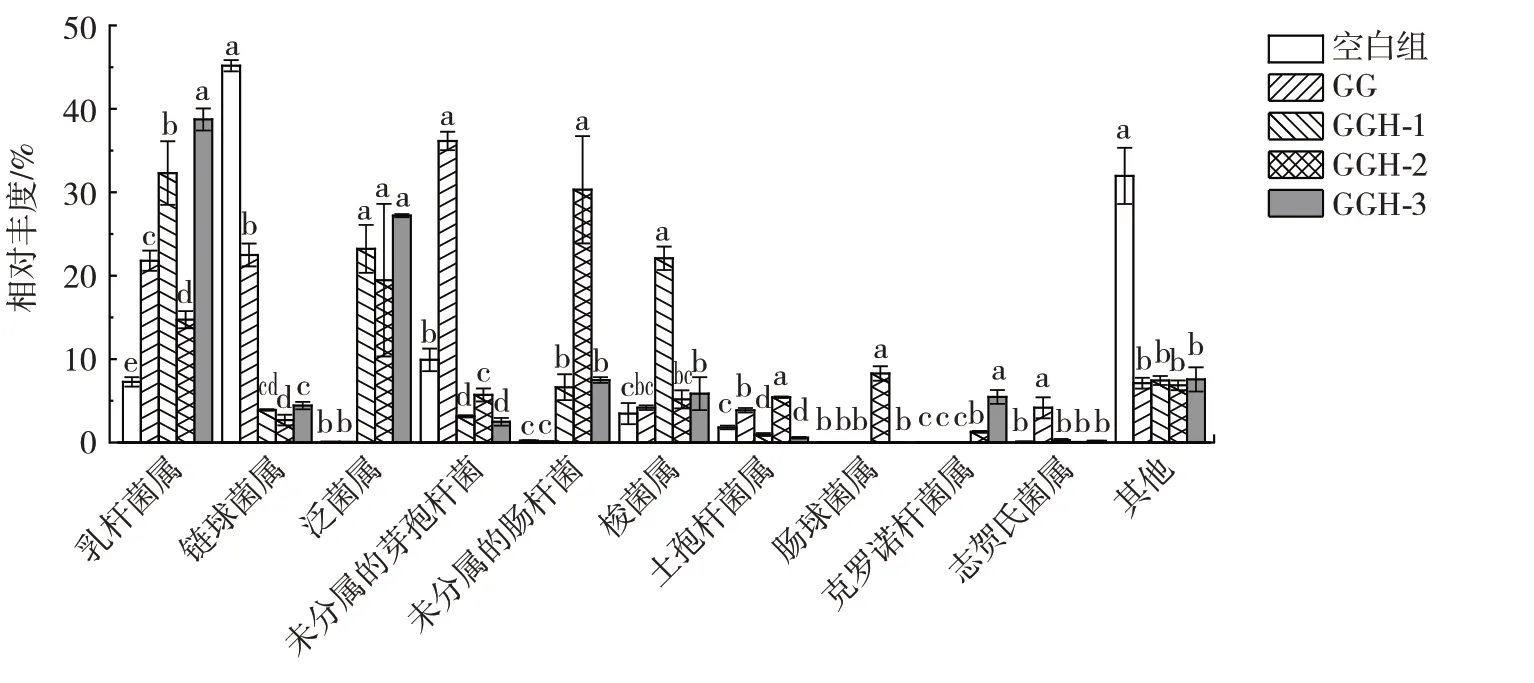
图9 GG 和GGH 酵解24 h 后属水平物种分布的变化Fig.9 Changes of flora on the genus level after 24 h fermentation of GG and GGH
由图9 可知,与空白组相比,实验组均显著提高了乳杆菌属(Lactobacillus)的丰度(P<0.05),GGH-2 和GGH-3 中乳杆菌属占总种群的比例最大。乳杆菌属是常见的益生菌,酵解后可产生乙酸、乳酸等酸类物质,在健康机体的肠道中大量存在,不仅可以维持肠道正常生理功能,抑制病原菌生长,而且具有降血压、降血脂、增强机体免疫等功能,有利于机体健康[24]。此外,实验组的梭菌属(Clostridiumsensustricto1)均有所增加,其中GGH-1 组与其他处理组相比差异显著,这与Fu 等[25]关于瓜尔胶及其不同分子量水解物体外酵解的研究结果一致。Clostridiumsensustricto1是厌氧菌,可以在厌氧条件下利用碳水化合物产生短链脂肪酸。同时,实验组的链球菌属(Streptococcus)均显著降低(P<0.05),这可能是导致厚壁菌门相对丰度降低的主要原因。链球菌属中某些菌种对人致病,可引发化脓性炎症,因此,链球菌属降低是有益的。GG 和GGH-2 处理组的土孢杆菌属(Terrisporobacter)显著增加(P<0.05),GGH-1 和GGH-3 处理组中的Terrisporobacter丰度较低。GG 酵解后肠杆菌属丰度略减少,但效果不显著,同时,志贺氏菌属增加。GGH-1 处理组的志贺氏菌属(EscherichiaShigella)相对降低,但肠杆菌属和肠球菌属显著增加(P<0.05)可能对机体产生不利影响。
总体来说,添加GG 和不同分子量的GGH 可以不同程度地改变肠道菌群的组成,增加肠道有益菌,如乳杆菌属和梭菌属的相对丰度,抑制链球菌属的增殖,其中,GGH-3 对肠道菌群组成的改善效果最好。添加不同分子量的GGH 均可促进酵解体系中乳杆菌属相对丰度的增加,其中,GGH-3 促进乳杆菌属增殖的效果最好,可能与其分子量较小有关。碳水化合物的分子量较大时,不易被肠道微生物利用,而当其分子量降低时,微生物利用率提高,使得某些可以利用碳水化合物的菌种,如乳杆菌属参与发酵,并产生SCFAs,降低酵解体系的pH 值,抑制某些对酸敏感的微生物的增殖,从而巩固乳杆菌属的优势地位,提高其相对丰度。李雄[26]通过研究不同分子量的脆江蓠低聚糖体外酵解特性发现,与分子量>10 kDa 和介于5~10 kDa 的脆江蓠低聚糖相比,分子量<5 kDa 的脆江蓠低聚糖更能促进肠道有益菌相对丰度的增加。李煜[23]关于不同分子量魔芋甘露聚糖益生效果的研究结果表明,不同分子量的魔芋甘露聚糖可以调节肠道菌群组成,在添加不同分子量魔芋甘露聚糖的酵解体系内,乳杆菌属相对丰度显著增加,而且魔芋甘露聚糖的分子量越低,促进乳杆菌属增殖的效果越好。
3 结论
以瓜尔胶为原料,通过酶解法得到了3 种不同分子量的GGH(GGH-1、GGH-2、GGH-3),采用猪结肠消化物构建体外酵解模型,对GG 和3 种不同分子量GGH 的体外酵解特性进行了研究,评估了其在体外酵解过程中对肠道菌群组成和比例的影响。结果表明:在酵解过程中,GG 和3 种GGH 的分子量逐渐降低,总糖含量随酵解时间的延长呈快速下降趋势,还原糖含量先增加后减少。酵解体系的pH 值均显著降低(P<0.05),GGH-1 显著促进了总SCFAs、乙酸、丁酸的生成,GGH-3 显著促进了丙酸的生成。GG 和不同分子量的GGH 均提高了乳杆菌属和梭菌属的相对丰度,抑制链球菌属的增长,其中,GGH-3 对肠道菌群的影响最为显著。后续可以进行体内实验,进一步验证其作为益生元进行开发利用的潜力。

