下调JMJD2B表达对卵巢癌细胞增殖的影响
张敏,刘晓莉,张妮,雷蕾,孙超
(1 济南市人民医院检验科,山东 莱芜 271199; 2 青岛市市立医院检验科;3 青岛市海慈医疗集团检验科; 4 上海市东方医院妇产科; 5 青岛市市立医院高压氧科)
JMJD2B是新近研究发现的一种组蛋白去甲基化酶,可调节染色质结构或基因表达[1]。多项研究发现,JMJD2B在多种肿瘤如乳癌、胃癌、结肠癌的发生发展过程中发挥重要作用[2-5]。前期研究发现,JMJID2B在卵巢癌组织中高表达,提示JMJD2B与卵巢癌的发生发展密切相关。然而,JMJD2B介导卵巢癌细胞恶性转化的相关分子机制研究甚少。环氧化酶2(COX2)是一种促进细胞增殖和侵袭转移及抑制细胞凋亡的炎性细胞因子[6-9]。已有研究结果发现,COX2的表达受表观遗传学修饰的调控,例如组蛋白修饰、DNA甲基化等[10-13]。还有研究发现,COX2的DNA甲基化与胃癌、非小细胞肺癌、膀胱异型细胞癌等恶性肿瘤的发生发展以及预后密切相关,特别是COX2的高度甲基化预示肿瘤的不良预后[10,14-17]。本研究观察抑制人卵巢癌细胞JMJD2B表达后COX2水平的变化,以及靶向抑制JMJD2B 表达对卵巢癌细胞增殖的影响,探讨JMJD2B促进卵巢癌细胞恶性转化的作用及其相关机制。现将结果报告如下。
1 材料与方法
1.1 实验材料
人卵巢癌细胞株SKOV3(购自济南市人民医院),人正常卵巢上皮细胞株IOSE80(购于中国上海慧颖生物科技有限公司);胎牛血清、DMEM和DMEM/F12培养基(Gibco公司,美国);JMJD2BsiRNA和control siRNA(Invitrogen公司,美国),JMJD2BsiRNA序列为5′-UCUCCAUCACCUG-CCUCAAGCACAA-3′,control siRNA为5′-CCU-ACAUCCCGAUCGAUGAUGUUGA-3′;转染试剂脂质体Lipofectamine 2000(Invitrogen公司,美国);反转录试剂盒(Thermo Scientific公司,美国),实时荧光定量PCR试剂盒(Takara公司,日本);BCA蛋白定量试剂盒(碧云天生物技术公司,中国);JMJD2B抗体(Bethyl Laboratories公司,美国),COX2抗体(Cayman chemical公司,美国),β-actin抗体(Santa Cruz Biotechnology公司,美国);辣根过氧化物酶标记的抗兔、抗鼠二抗(Jackson ImmunoResearch公司,美国);ECL化学发光检测试剂盒(Millipore公司,美国),COX2高表达质粒和COX2启动子质粒(上海浩然生物技术有限公司)。卵巢癌病人手术切除的癌组织及癌旁正常组织标本各20例(济南市人民医院)。
1.2 实验方法
1.2.1细胞培养 SKOV3细胞和IOSE80细胞分别在含有体积分数0.10胎牛血清的DMEM培养基和DMEM/F12培养基中,于37 ℃、体积分数0.05 CO2条件下传代培养。
1.2.2转染 将对数生长期SKOV3细胞以每孔2×105个接种至6孔板中培养,待细胞达60%~80%融合时进行转染。参照转染试剂说明,分别将JMJD2BsiRNA、control siRNA或COX2高表达质粒转染入细胞内,培养48 h后收集细胞。
1.2.3RNA的提取、反转录及实时荧光定量PCR检测 应用RNA提取试剂盒提取细胞或者组织总RNA,逆转录生成cDNA,将所得cDNA保存于-20 ℃冰箱备用。以cDNA为模板,在TaqDNA聚合酶作用下行PCR扩增反应。所用引物及其序列见表1。PCR反应体系10 μL,内含2×SYBR Green Mixture 5.0 μL,2.5 μmol/L正反向引物各1.0 μL,cDNA 1.0 μL,加ddH2O补足体积至10.0 μL。PCR条件:95 ℃、15 s,60 ℃、30 s,74 ℃、30 s,在Bio-Rad CFX96荧光定量PCR仪上扩增40个循环后收集荧光数据。
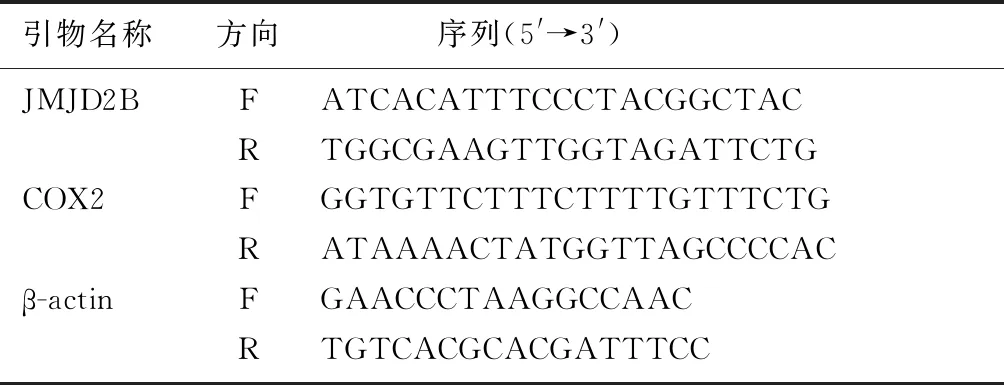
表1 PCR引物及其序列
1.2.4蛋白印迹法检测 应用RIPA裂解细胞,在冰上静置30 min,以12 000 r/min离心10 min,取蛋白上清检测质量浓度后,取40 μg上样,在体积分数0.10的SDS-PAGE中电泳分离(电压50 V,时间250 min),电转至PVDF膜(电流250 mA,时间190 min),以50 g/L的脱脂奶粉室温封闭60 min,加一抗(JMJD2B,1∶1 000稀释;COX2,1∶100稀释;β-actin,1∶1 000稀释)4 ℃过夜孵育,PBST漂洗3次,每次5 min,再加入HRP标记的二抗室温孵育60 min,PBST漂洗3次,每次5 min,加入ECL化学发光工作液室温孵育2~3 min,暗室中曝光、显影、定影,扫描拍照后保存数据。
1.2.5细胞克隆形成实验 SKOV3细胞接种至细胞板,将JMJD2BsiRNA转染至细胞,24 h后行COX2启动子载体转染,同时转染pRL-TK作为内参。转染48 h后,弃去培养液,PBS洗涤3次,Passive Lysis Buffer裂解细胞。最后用荧光素酶报告基因分析仪检测荧光素酶的活力。
1.3 统计学方法

2 结 果
2.1 IOSE80细胞和SKOV3细胞中JMJD2B和COX2表达比较
SKOV3细胞中JMJD2B、COX2的mRNA和蛋白表达均明显高于IOSE80细胞,差异有统计学意义(t=13.74~19.34,P<0.05)。见图1。

A:JMJD2B mRNA表达;B:COX2 mRNA表达;C:JMJD2B、COX2蛋白表达。与IOSE80细胞比较,***P<0.05。
2.2 转染JMJD2B siRNA对COX2表达的影响
实时荧光定量PCR检测和蛋白印迹法的检测结果显示,SKOV3细胞转染JMJD2BsiRNA后,JMJD2B和COX2的mRNA和蛋白表达均降低,差异有显著性(t=4.97~7.56,P<0.05)。见图2。
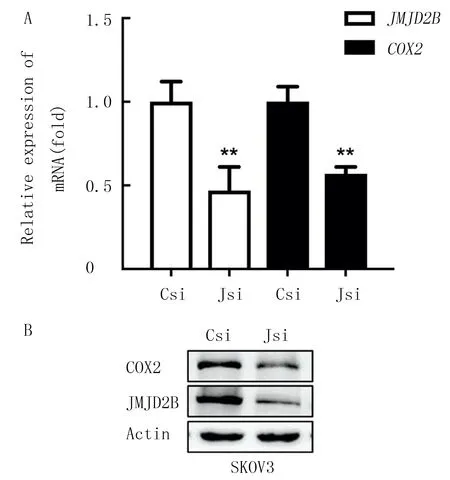
A:JMJD2B、COX2 mRNA相对表达水平;B:JMJD2B、COX2蛋白表达水平。Csi:阴性对照siRNA;Jsi:JMJD2B siRNA。与Csi相比,**P<0.01。
2.3 抑制JMJD2B的表达对COX2启动子表达的影响
双荧光素酶实验结果显示,抑制JMJD2B的表达可以明显降低COX2的表达,差异有显著性(t=35.48,P<0.01)。见图3。
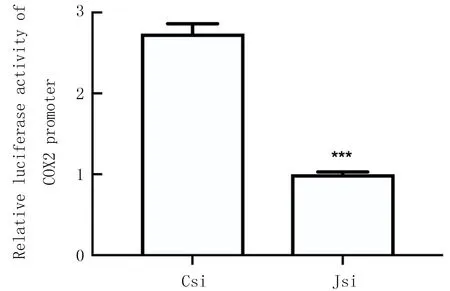
Csi:阴性对照siRNA;Jsi:JMJD2B siRNA。与Csi相比,***P<0.01。
2.4 JMJD2B和COX2表达对SKOV3细胞克隆形成能力的影响
细胞克隆形成实验结果显示,SKOV3细胞转染JMJD2BsiRNA后细胞的克隆形成能力明显减弱,而高表达COX2可以部分恢复细胞的克隆形成能力(F=58.23,P<0.01)。见图4。
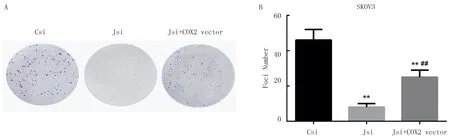
A:细胞克隆形成结果;B:细胞克隆数。Csi:阴性对照siRNA;Jsi:JMJD2B siRNA。与Csi相比,**P<0.01;与Jsi相比,##P<0.01。
2.5 人卵巢癌组织及其癌旁组织中JMJD2B和COX2 mRNA表达关系
与癌旁组织相比,卵巢癌组织中JMJD2B和COX2的mRNA表达均显著升高(t=85.42,P<0.05),且两者表达水平呈正相关关系(R2=0.983,95%CI=0.984~0.995,P<0.01)。见图5。
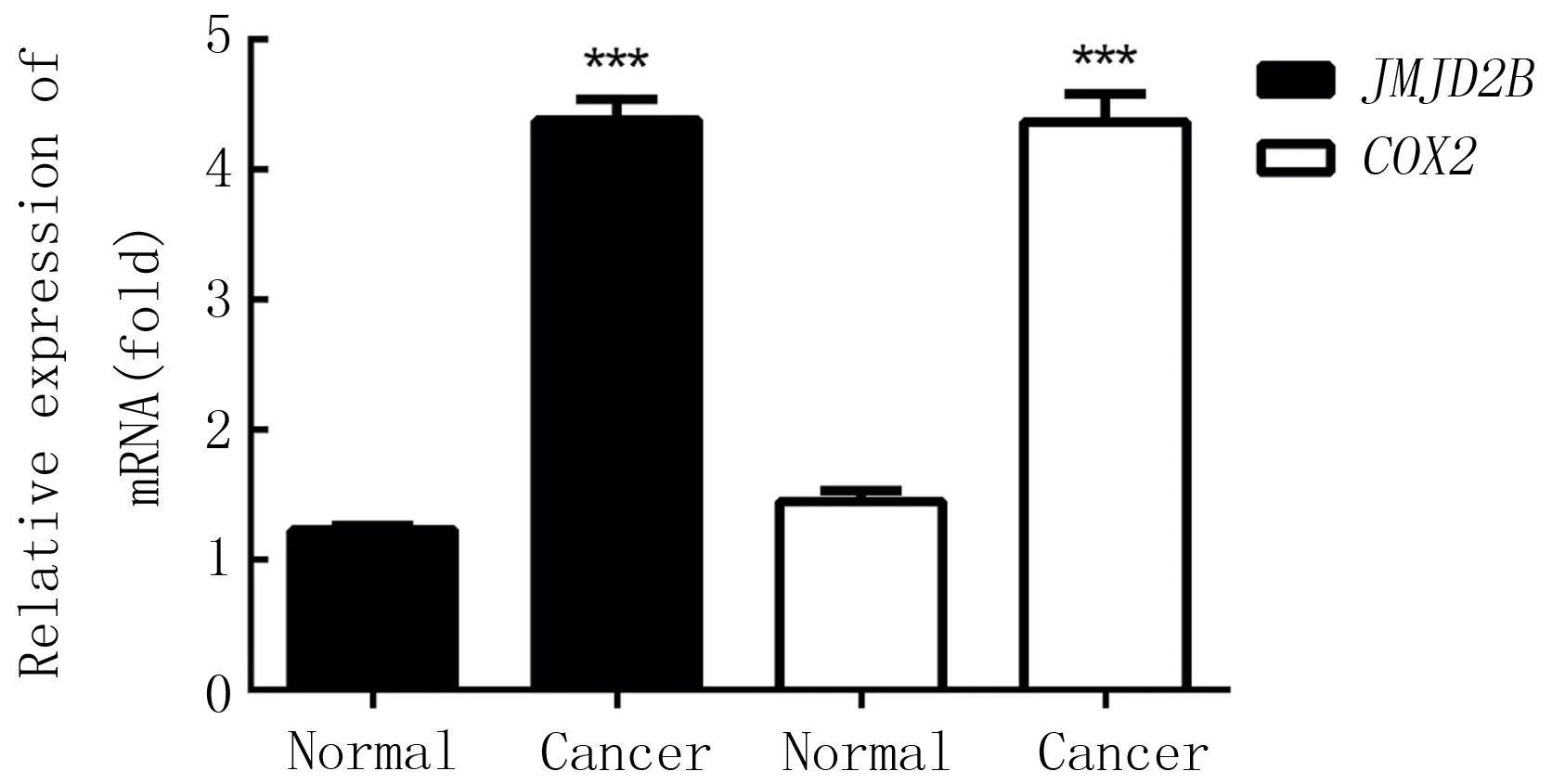
与癌旁组织相比,***P<0.01。
3 讨 论
肿瘤的发生、发展是一个多因素参与、多步骤演进的复杂病理过程,涉及信号通路转导异常和基因表达调控异常,其中表观遗传学调控机制在肿瘤发生发展中的作用越来越受到关注。表观遗传学调控主要包括组蛋白修饰、DNA甲基化、染色体重塑和非编码RNAs等,其中组蛋白修饰是表观遗传学的重要调控机制[18-19]。组蛋白修饰主要有磷酸化/去磷酸化、甲基化/去甲基化、乙酰化/去乙酰化等多种共价修饰作用[20]。组蛋白修饰的异常调节,改变了基因表达的特性,为肿瘤的发生和发展提供了基础[21-22]。组蛋白去甲基化酶JMJD2B是新近研究发现的JMJD2家族中的一员,主要靶向组蛋白H3第9位赖氨酸的三甲基(H3K9me3)使其发生去甲基化,在干细胞分化、炎症和多种恶性肿瘤的发生发展中发挥重要的表观遗传学作用[2,23]。近期研究发现,JMJD2B主要定位于卵巢癌细胞株的细胞核内,这可能与其调控细胞内的信号通路基因的表达有关[15],但JMJD2B在促进卵巢癌发生、发展中的作用及分子机制则尚未完全阐明。近期研究发现,COX2的表达受到表观遗传学修饰的调控,如DNA甲基化、组蛋白的修饰等[12-13,24]。COX2的DNA甲基化水平与胃癌的发生发展及预后密切相关,尤其是COX2的高度甲基化预示着胃癌的不良预后[25]。有研究显示,JMJD2B通过不同调控机制参与多种肿瘤的发生和发展[1,4]。
本实验探讨JMJD2B是否通过调控COX2表达介导人卵巢癌细胞的恶性转化。研究结果显示,JMJD2B和COX2在人卵巢癌细胞SKOV3中表达均明显高于人正常卵巢上皮细胞IOSE80,JMJD2B和COX2在卵巢癌组织中的表达均显著升高并呈正相关;以RNA干扰技术靶向抑制人卵巢癌细胞JMJD2B表达后,COX2的转录表达明显下调。提示COX2信号通路在人卵巢癌细胞发生发展中的作用受组蛋白去甲基化酶JMJD2B调控。为进一步研究JMJD2B在促进人卵巢癌细胞恶性转化中的分子机制,本文应用克隆形成实验探讨JMJD2B表达对人卵巢癌细胞增殖的影响。结果显示,靶向抑制JMJD2B的表达,肿瘤细胞的增殖明显受到抑制,表明JMJD2B通过调控COX2表达促进细胞的增殖,进而介导卵巢癌细胞的恶性转化。但是,本研究存在着局限性,即仅采用细胞克隆形成实验来评价抑制JMJD2B对卵巢癌细胞增殖能力的影响。今后需要进一步对卵巢癌细胞侵袭、迁移能力和细胞分裂周期等进行研究,以探讨卵巢癌细胞恶性转化机制。此外,本文研究还显示,降低JMJD2B表达水平可抑制卵巢癌细胞克隆形成能力。
综上所述,抑制JMJD2B表达可能通过阻断COX2信号通路下调肿瘤相关基因表达,从而抑制人卵巢癌细胞的恶性转化。进一步分析组蛋白去甲基化酶JMJD2B、COX2信号通路和肿瘤相关基因表达间的相互作用,将有助于深入了解信号转导和组蛋白修饰在卵巢癌发生、发展中的相互作用,为进一步探讨JMJD2B在卵巢肿瘤中的作用机制提供理论基础。

