血小板相关参数和凝血指标在肺癌治疗中的变化及意义
常瑞霞,可春梅
(郑州市第六人民医院,河南 郑州 450000)
肺癌是一种发病率、病死率均较高的肺原发性恶性肿瘤,大部分起源于支气管黏膜上皮,5年生存率仅20%左右[1-2]。受肿瘤发生部位、病理类型等因素影响,肺癌临床表现较复杂,早期临床缺乏高效的筛查手段,56%~70%患者确诊时已处于局部晚期或转移[3]。目前,临床针对肺癌的治疗以化疗为主,虽可在一定程度上抑制病情进展,但在化疗期间易造成肝脏、血管内皮细胞受损,加之大部分化疗药物可对骨髓造血功能产生抑制作用,进而导致凝血及抗凝血之间动态平衡造成破坏,加剧凝血功能紊乱程度,影响预后[4]。基于此,本研究就我院75例肺癌患者及75例健康体检者的血小板相关参数及凝血指标进行全面系统检测,旨在为肺癌的病情监测、治疗及预后判断提供指导,现报告如下。
1 资料与方法
1.1 一般资料 选择2019年6月至2020年5月就诊于河南省郑州市第六人民医院的75例肺癌患者作为观察组,其中男性44例,女性31例;年龄45~66岁,平均(53.54±5.12)岁;非小细胞肺癌46例(腺癌25例,鳞癌19例,大细胞肺癌2例),小细胞肺癌29例;TNM分期Ⅰ期4例,Ⅱ期17例,Ⅲ期19例,Ⅳ期35例。病例纳入标准:①年龄40~70岁者;②经胸部X线、CT及腹部B超等影像学检查、纤维支气管镜及手术病理诊断为肺癌,且符合《中国常见恶性肿瘤诊治规范》[5]中肺癌诊断标准者;③经全身骨扫描未见转移、预计生存时间>6个月者;④自愿签署治疗知情同意书者。排除标准:①存在严重重要脏器(心、肝、肾等)功能障碍者;②合并风湿性关节炎、糖尿病、血栓性疾病、感染性疾病、慢性阻塞性肺疾病、贫血等疾病患者;③存在胸水、弥漫性肝侵犯、肺癌性淋巴管炎、腹水等病变者;④有出血倾向、精神异常者;⑤入组1个月前存在手术史及外伤史者;⑥服用影响凝血功能的激素或药物治疗者;⑦妊娠期或哺乳期者。选取同期于我院接受健康体检的75例健康者作为对照组,其中男性46例,女性29例;年龄42~65岁,平均(52.26±5.63)岁。两组患者一般资料相比差异均无统计学意义(均P>0.05),具有可比性。
1.2 治疗方法 观察组患者入院后接受GP方案(吉西他滨+顺铂)化疗:第1、8天,注射用盐酸吉西他滨(规格200 mg/支,国药准字H20123345)800~1000 mg/(m2·d)静脉滴注;第2、3天,顺铂(规格6 ml∶30 mg,国药准字H20040813)60~75 mg/(m2·d)静脉滴注。
1.3 检测方法 采集对照组体检日、观察组入院后及第1次化疗周期结束后的清晨空腹外周静脉血5 ml,通过3.8%枸缘酸钠抗凝,全血∶抗凝剂=9∶1,3000 r/min离心15 min,取上层血浆放置于低温冰箱内-80 ℃保存待测。通过SYS mex公司生产的血细胞分析仪XN 9000对血小板压积(PCT)、平均血小板体积(MPV)、血小板分布宽度(PDW)、血小板计数(PLT)进行测定,试剂盒(批号:S20060059)由上海血液生物医药有限责任公司生产。通过凝固法检测凝血酶时间(TT)、活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、纤维蛋白原(FIB),采用免疫比浊法检测D-二聚体(D-D),仪器选用SYS mex cs 510全自动凝血分析仪及配套试剂盒(批号:2401390)。所有操作均严格按照说明书执行。对观察组治疗前后及对照组血小板相关指标、凝血指标进行观察。正常参考值范围:PCT 0.108%~0.282%;PLT (100~300)×109/L;MPV 7.6~13.2 fl;PDW 9~17 fl;TT 12~14 s;PT 12~14 s;APTT 32~43 s;FIB 2~4.5 g/L;D-D 0~252.00 μg/L。
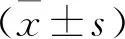
2 结 果
2.1 两组患者血小板相关参数比较 见表1。观察组治疗前后PDW与对照组相比,差异无统计学意义(P>0.05)。观察组治疗前PCT、PLT、MPV比对照组高,治疗后比治疗前降低(均P<0.05)。
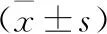
表1 两组患者血小板相关参数比较
2.2 两组患者凝血指标比较 见表2。观察组治疗前TT、PT、APTT与对照组相比,差异无统计学意义(均P>0.05)。观察组治疗前FIB、D-D比对照组高(均P<0.05)。观察组治疗后TT、PT、APTT、FIB、D-D均比治疗前低(均P<0.05)。
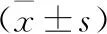
表2 两组患者凝血指标比较
2.3 观察组患者治疗前后不同TNM分期凝血指标和血小板相关参数比较 见表3、4。治疗前,Ⅲ-Ⅳ期患者PT、TT显著高于Ⅰ-Ⅱ期,而APTT、PLT、PCT、PDW、MPV和D-D则显著低于Ⅰ-Ⅱ期(均P<0.05)。治疗后,TNM各分期患者凝血指标、血小板相关参数均较治疗前同TNM分期患者下降显著,且Ⅲ-Ⅳ期D-D、PDW低于Ⅰ-Ⅱ期,TT、PCT、PLT高于Ⅰ-Ⅱ期(均P<0.05)。
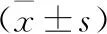
表3 观察组患者治疗前后不同TNM分期凝血指标比较
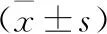
表4 观察组患者治疗前后不同TNM分期血小板相关参数比较
3 讨 论
正常机体内凝血因子、血管内皮细胞、血小板等共同维持凝血及抗凝间的动态平衡,可稳定血液环境,但当机体发生紊乱时可造成机体受损及血液循环异常[6]。在诸多复杂机制及因素影响下,肺癌患者机体凝血与抗凝的动态平衡常遭到破坏,引发机体凝血功能异常,不仅增加血栓性疾病发生率,而且会导致肺癌病情加重或转移[7]。化疗药物可杀伤肿瘤细胞并将其清除,但化疗过程中易损伤红细胞、白细胞等正常细胞,影响患者治疗效果及预后。
临床研究[8-9]发现,30%~60%肿瘤患者会伴有血小板增多现象,血小板不仅参与血栓形成过程,而且可促使肿瘤生长、浸润、转移等,此外血小板质量及数量可反映凝血功能与骨髓造血功能状态。本研究中,观察组治疗前PDW与对照组相比未见统计学差异,可见血小板呈均一性改变。观察组治疗前PCT、PLT、MPV比对照组高,这与骨髓巨核细胞反应性增加促使体积较大的血小板产生有关。本研究结果发现,观察组治疗后PCT、PLT、MPV比治疗前降低,提示化疗可进一步破坏肺癌患者的凝血-抗凝平衡,加剧血小板活化。分析其原因,大部分化疗药物直接入血不仅会引起骨髓造血抑制,而且会导致血小板破坏及生成障碍,增多活化型血小板[10]。
凝血功能异常主要以血小板活化、途径激活等为临床表现。FIB属于一种凝血因子,在凝血酶作用下可形成纤维蛋白,与肿瘤细胞、血小板等共同形成微血栓[11]。血浆FIB异常升高表示肿瘤易形成癌栓并转移,机体处于高凝状态且有血栓形成的风险。D-D是一种特异性降解产物,主要由纤维蛋白单体经活化因子交联后再经纤溶酶水解所形成,其水平异常升高表明体内可能伴有继发性纤溶活性增强及血液高凝状态[12-13]。本研究结果发现,观察组治疗前FIB、D-D比对照组高,表明在化疗前肺癌患者体内已处于血液高凝状态,主要表现在FIB、D-D水平的异常升高。分析肺癌凝血功能异常的具体机制体现在以下几点:①肿瘤细胞周围微环境内的基质金属蛋白酶、生长因子等可导致血液呈高凝状态[14-17];②通过某些途径,肿瘤细胞可对T淋巴细胞及巨噬细胞进行激活,进而促使大量炎症递质及细胞因子的产生,进一步使血管内皮细胞受损,激活体内凝血系统,导致血液呈高凝状态;③肿瘤细胞可产生凝血因子Ⅳ及癌促凝素组成复合物,进而对下游的凝血因子Ⅹ、Ⅺ产生激活作用,提高血液中纤维蛋白原及其降解物含量[18-21]。观察组治疗后TT、PT、APTT、FIB、D-D均比治疗前低,可见化疗可进一步影响凝血机制指标,加剧凝血功能减退;而且,机体内外源凝血系统均处于激活状态,激活相关凝血因子并形成复合物可导致纤维蛋白原降解为单体,增加血栓形成的风险。因此,在使用化疗治疗时应密切监测上述参数的动态变化,保持血液循环的稳定。
本研究发现Ⅲ-Ⅳ期患者PT、TT高于Ⅰ-Ⅱ期,而PLT、APTT低于Ⅰ-Ⅱ期,提示晚期患者凝血功能障碍异常严重。另外,Ⅲ-Ⅳ期患者治疗前D-D高,治疗后下降明显,提示治疗后患者凝血功能恢复。治疗前各期患者PLT、PCT均高于对照组,治疗后Ⅲ-Ⅳ期患者PLT、PCT也高于Ⅰ-Ⅱ期,但MPV在Ⅲ-Ⅳ期与Ⅰ-Ⅱ期间比较无统计学差异,提示肿瘤患者血小板改变显著。
综上所述,肺癌患者处于血液高凝、血小板活化等病理状态,化疗会进一步加剧凝血功能紊乱,故化疗期间密切监测上述指标变化具有重要意义。

