大豆GmWIN1-6转录因子的鉴定、表达分析及盐胁迫响应
蔡桂萍,刘宝玲,周雅莉,邓咪咪,高慧玲,李 腾,张 莉,李润植
(山西农业大学农学院,太谷 030801)
大豆(Glycine max)是我国甚至全球重要的油料作物,可食用和作为饲料[1]。大豆油是全世界食用油的主要来源之一,约占总植物油产量的28%[2]。其主要由5 种脂肪酸组成,包括2 种饱和脂肪酸[棕榈酸(C16:0,约11.38%)、硬脂酸(C18:0,约4.29%)]和3 种不饱和脂肪酸[油酸(C18:1Δ9,约15.66%)、亚油酸(C18:2Δ9,12,约47.33%)和亚麻酸(C18:3Δ9,12,15,约15.40%)][3-4]。其中高含量的亚油酸可以降低血液中的胆固醇,预防心脑血管疾病。作为一种优异的食用植物油,大豆油在全球的需求量日益增加。提高大豆油的产量始终是遗传育种及大豆生产的一个主攻领域[5]。深入研究大豆种子油脂的生物合成及积累机制可为大豆遗传改良提供理论基础。
AP2/ERF(APETALA2/ethylene-responsive factor)蛋白家族包含220 多个成员,被认为是植物界最重要的转录因子超家族,其典型特征是含有60~70 个氨基酸组成的高度保守的DNA 结合结构域,即AP2结构域。该结构域由3 个β-转角(beta turn)和1 个α-螺旋(alpha helix)构成。基于AP2 结构域的拷贝数,AP2/ERF 家族可简单分为4 个亚家族:AP2 亚家族、ERF亚家族、DREB亚家族、RAV 亚家族[6]。
WIN1(WAX INDUCER1/SHINE1)具有1个AP2结构域,又名SHN1,属于ERF-B6 亚家族。此亚家族还具有其他2 个成员,即SHN2、SHN3,且功能与WIN1 相似[7-9],主要参与植物蜡质和角质的生物合成过程,可提高植物的抗逆性。WIN1也参与植物非生物胁迫反应,激活植物激素等信号通路,进而调控下游功能基因的表达[10]。蜡质和三酰甘油(triacylglycerol,TAG)都属于酯类化合物,因此,WIN1 在调控蜡质时也能同时调控若干个油脂基因,显著影响植物的油脂积累。近年来,人们已经从甘蓝型油菜(Brassica napus)、拟南芥(Arabidopsis thaliana)、大麦(Hordeum vulgare)等植物中分离得到了WIN1基因,并验证了该蛋白的活性。例如:过表达甘蓝型油菜BnWIN1基因后,其蜡质含量增加了20%~22%,种子的含油量亦增加了8%[11]。在酵母中过表达拟南芥WIN1基因,使得酵母棕榈油酸(C16:1)含量下降10%,然而C16:0、C18:1、C18:0、C20均有上升,且C20 含量增加了20%左右[7]。在转基因拟南芥植物中组成型表达WIN1,与对照植物相比,其叶片表皮蜡质累积提高4.5 倍,茎表皮蜡质也有明显的增加[12]。已有研究显示,植物WIN1基因的表达模式具有时空特异性。如其在拟南芥花序、根中高表达,而在茎、长角果、莲座叶中低表达[8,13];其在甘蓝型油菜花蕾的表达量最高,在叶、根、发育中的种子、角果壁中的表达高于茎和第10 天的角果[11]。进一步深入研究不同植物中这些差异表达WIN1基因的具体生物学功能,有助于全面解析植物WIN1转录因子介导的调控网络及作用机制。
为解析大豆WIN1 转录因子是否参与大豆油脂生物合成以及胁迫响应等生物学过程的调控,鉴定可用于大豆遗传改良的优异基因源,本文通过同源比对分析,从大豆基因组中鉴定获得一个Gm-WIN1-6 转录因子,并克隆到该基因的开放阅读框(open reading frame,ORF),应用生物信息学工具系统分析其蛋白结构及理化性质等。采用半定量反转录PCR(semi-quantitative reverse transcription polymerase chain reaction,sqRT-PCR)和实时荧光定量反转录PCR(quantitative real-time reverse transcription polymerase chain reaction,qRT-PCR)技术分析Gm-WIN1-6 转录因子在大豆不同组织和不同发育种子中的时空表达模式以及对盐胁迫的响应。研究结果预示着GmWIN1-6 可作为一个遗传修饰靶标,进一步应用于提高大豆种子油脂富集和大豆抗胁迫的育种实践中[14]。
1 材料与方法
1.1 材料
本试验所用的大豆品种Jack,种植于山西农业大学试验田。试验取材为:两周龄的幼苗、根、茎、幼叶、盛花期的花、幼嫩的豆荚以及开花后25 d(种子1)、35 d(种子2)、45 d(种子3)的大豆种子;盐胁迫处理0、2、6、9、12 h 的大豆幼苗叶片。所有样品经液氮速冻后储存于-80℃备用。
1.2 方法
1.2.1 大豆GmWIN1-6转录因子的鉴定及结构分析
选用模式生物拟南芥AtWIN1(At1g15360)的蛋白序列作为检索序列blastp 大豆基因组数据库soybase(https://soybase.org/),以此获得GmWIN1-6转录因子的基因组序列、编码序列(coding sequence,CDS)、氨基酸序列及染色体的位置信息。将检索到的GmWIN1-6 转录因子的CDS 用NCBI-ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)数据库检测是否具有完整的ORF。将检索到的GmWIN1-6 转录因子氨基酸序列用SMART(http://smart.embl-heidelberg.de/)和CDD(https://www.ncbi.nlm.nih.gov/cdd)数据库进行分析,鉴定GmWIN1-6 转录因子蛋白序列的保守结构域。利用网站Gene Structure Display Server(http://gsds.gao-lab.org/index.php)对GmWIN1-6转录因子进行基因结构分析。
1.2.2 大豆GmWIN1-6蛋白的理化性质及结构分析
用ExPASy 数据库(https://www.expasy.org/)中的ProtParam 预测GmWIN1-6 转录因子的分子量、等电点、氨基酸数目等理化性质[15],同时采用Ex-PASy 数据库中的ProtScale 预测GmWIN1-6 转录因子的疏水性。通过在线工具TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测大豆GmWIN1-6 转录因子的跨膜结构区域,利用SOPMA 网站(https://npsaprabi.ibcp.fr/cgibin/npsa_automat.pl?page=/NPSA/npsa_sopma.htmL)预测GmWIN1-6转录因子的二级结构。用在线网站SWISS-MODEL(https://swissmodel.expasy.org/interactive)对Gm-WIN1-6转录因子进行三级结构预测分析并建模。
1.2.3 大豆GmWIN1-6 蛋白保守域鉴定及系统进化分析
从NCBI 数据库中调取水稻(Oryza sativa)、紫花苜蓿(Medicago truncatula)、大麦和拟南芥的WIN1 蛋白序列,利用软件GeneDoc 进行多序列比对(各物种的WIN1 信息见表1)。运用MEGA7.0软件对拟南芥AtWIN1、AtSHN3、AtSHN2、水稻Os-SHN1、紫花苜蓿MtWIN1、大麦HvWIN1和大豆Gm-WIN1-6 转录因子的蛋白序列进行建树,采用邻接法(neighbor-joining)构建无根系统发育树,自举检验值设置为1 000个循环[16]。

表1 各物种WIN1信息Tab. 1 Information of WIN1 in different species
1.2.4 大豆RNA的提取、cDNA 的合成及基因克隆
根据北京全式金生物技术有限公司的Trizol 法提取大豆各组织的总RNA。利用江苏省爱必梦生物科技有限公司的5×All-In-One RTMasterMix 反转录试剂盒合成cDNA。以cDNA 为模板,使用基因特异引物及2×GPV8 HF Polymerase Master(安徽通用生物有限公司)高保真酶扩增目的基因的ORF,目的片段经凝胶回收和纯化后连入pMD18-T 载体,并转入大肠杆菌中。选取阳性菌,并在通用生物公司测序验证。
1.2.5 大豆GmWIN1-6 转录因子的表达分析
使用Primer6.0 软件,依据GmWIN1-6 转录因子编码序列设计特异性引物(表2),采用NCBI 中的Primer-BLAST对引物进行鉴定。以上述大豆各组织的cDNA 为模板,利用GmWIN1-6 的特异性引物进行sqRT-PCR 和qRT-PCR 分析。选用大豆Actin作为内参基因。依照TRAN 2×Easy Taq PCR Super Mix说明书提供的方法进行sqRT-PCR 分析。反应体系为:cDNA 模板0.5 μL,2×Easy Taq PCR Super Mix 5.0 μL,正向引物0.2 μL,反向引物0.2 μL,Nucleasefree Water 2.0 μL。反应程序为:94℃预变性5 min;变性94℃ 30 s,退火30 s,延伸72℃ 30 s,30~35 个循环;终延伸72℃ 10 min。
依照TB Green™ Premix Ex Taq™ II(Tli RNaseH Plus,TaKaRa公司)说明书提供的方法进行qRT-PCR分析。反应体系为:cDNA 模板1.0 μL,TB Green-Premix Ex Taq 5.0 μL,正向引物0.4 μL,反向引物0.4 μL,ROX Reference Dye Ⅱ (50×) 0.2 μL,ddH2O 3.0 μL。反应程序为:95℃预变性30 s;95℃ 3 s,退火58℃ 30 s,40 个循环。反应在Bio-RadCFX96 TM荧光定量PCR 仪上进行。用公式2-ΔΔCq计算基因表达量,利用IBM SPSS Statistics 19 进行差异显著性分析。
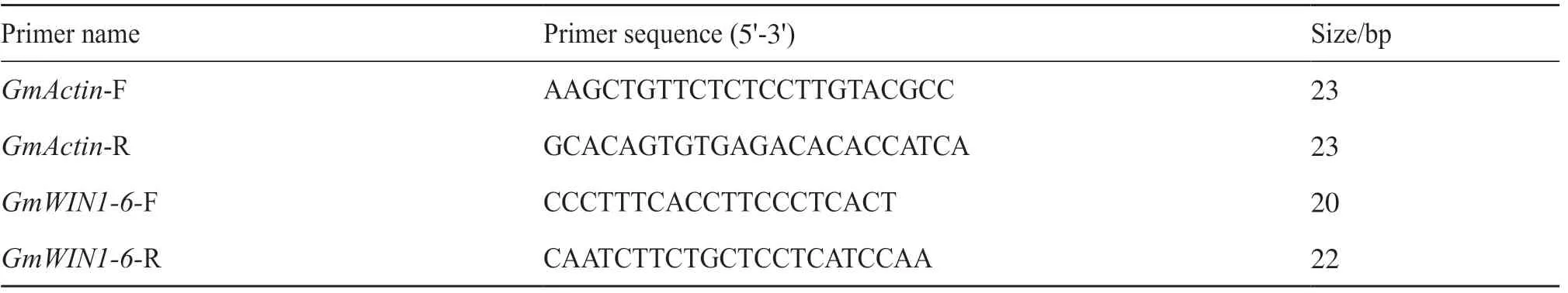
表2 检测GmWIN1-6 转录因子表达的特异性引物Tab. 2 Specific primers for detecting the expression of GmWIN1-6 transcription factors
1.2.6 大豆幼苗的盐胁迫处理
取大豆品种Jack 的种子,在黑暗条件下进行萌发。将种子种在营养土中,在光照培养箱中生长。设置培养箱条件为温度25℃,相对湿度60%,光照/黑暗为14 h/10 h。播种14 d 后,筛选并保留长势良好、状态一致的幼苗,将幼苗移入200 mmol/L NaCl溶液中处理0、2、6、9、12 h 作为盐胁迫[17]。液氮速冻后-80℃备用。参照1.2.4、1.2.5 中的方法分别提取不同时间的盐胁迫幼苗的总RNA,反转录后进行GmWIN1-6的qRT-PCR 分析。
2 结果与分析
2.1 大豆GmWIN1-6 转录因子的鉴定及基因结构分析
利用AtWIN1 蛋白序列在大豆基因组数据库中搜索,鉴定同源WIN1 蛋白。根据与AtWINI 的蛋白序列的相似性评分,将获得的GmWIN1 转录因子命名为GmWIN1-6。通过SMART 和CDD 数据库对获得的GmWIN1-6 蛋白序列进行结构鉴定分析,发现GmWIN1-6 转录因子中含有1 个典型的AP2 保守结构域。利用在线Gene Structure Display Server 网站工具对GmWIN1-6 转录因子基因组DNA 进行内含子、外显子分析,发现该基因具5'和3'非翻译区,含2 个外显子和1 个内含子(图1)。这与拟南芥AtWIN1 结构相似,应行使相同的功能。
2.2 大豆GmWIN1-6 转录因子CDS 的克隆
已知GmWIN1-6 转录因子在花中高表达,故以花的cDNA 为模板,通过高保真酶扩增目的序列,并将其与载体连接后转入大肠杆菌中,涂筛选板挑取单克隆进行PCR 和测序验证。单克隆菌液PCR 产物的电泳结果显示(图2),以空载为对照,GmWIN1-6 转录因子的3 个单克隆大肠杆菌PCR 产物条带清晰,大小为529 bp。测序结果显示,氨基酸没有变化,只有部分碱基发生了变化,说明Gm-WIN1-6克隆成功。
2.3 大豆GmWIN1-6 转录因子的理化性质及蛋白结构分析
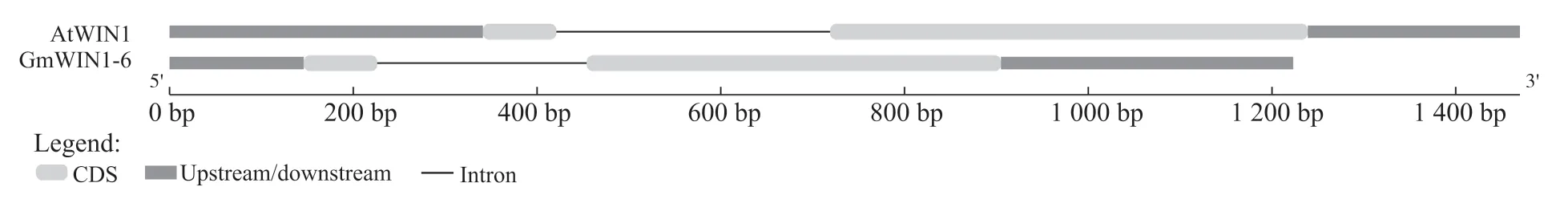
图1 GmWIN1-6转录因子的基因结构Fig. 1 Gene structure of GmWIN1-6 transcription factor

表3 GmWIN1-6 蛋白的理化性质Tab. 3 Physicochemical properties of GmWIN1-6 protein

图2 单克隆大肠杆菌PCR验证Fig. 2 PCR verification of monoclonal Escherichia coli
用ExPASy 数据库中的工具ProtParam 对Gm-WIN1-6 转录因子蛋白序列进行理化性质分析。该蛋白长度为176 个氨基酸,相对分子质量为19.81 kD,等电点为9.54,属于不稳定蛋白(表3)。用ProtScale 软件预测GmWIN1-6 转录因子的疏水性,发现其亲水性氨基酸多于疏水性氨基酸,属于亲水性蛋白(图3)。用TMHMM 软件预测Gm-WIN1-6 转录因子蛋白的跨膜结构域,结果发现其没有明显的跨膜结构域,说明GmWIN1-6 转录因子蛋白不是一个膜蛋白[18]。
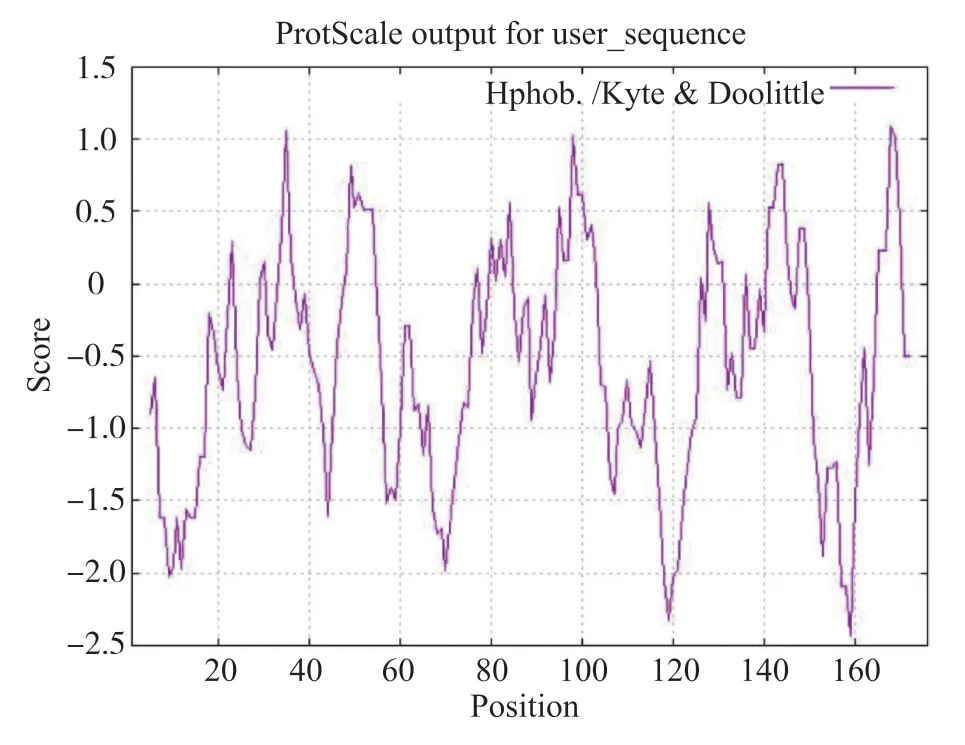
图3 GmWIN1-6 转录因子蛋白的疏水性Fig. 3 Hydrophobicity of GmWIN1-6 transcription factor protein
二级结构预测结果显示(表4),GmWIN1-6 转录因子的氨基酸序列中α-螺旋、延伸链(extended strand)、β-转角、无规则卷曲(random coil)分别占二级结构的31.82%、13.64%、6.25%、48.30%,无规则卷曲所占比例最高,推测其作用主要为连接其他二级结构元件[19]。用SWISS-MODEL 软件分析GmWIN1-6 转录因子蛋白的三级结构(图4),发现GmWIN1-6 蛋白与AtERF96 蛋白结构相似性为56.06%,推测其具有相似的功能。

表4 GmWIN1-6 蛋白的二级结构Tab. 4 The secondary structure of GmWIN1-6 protein
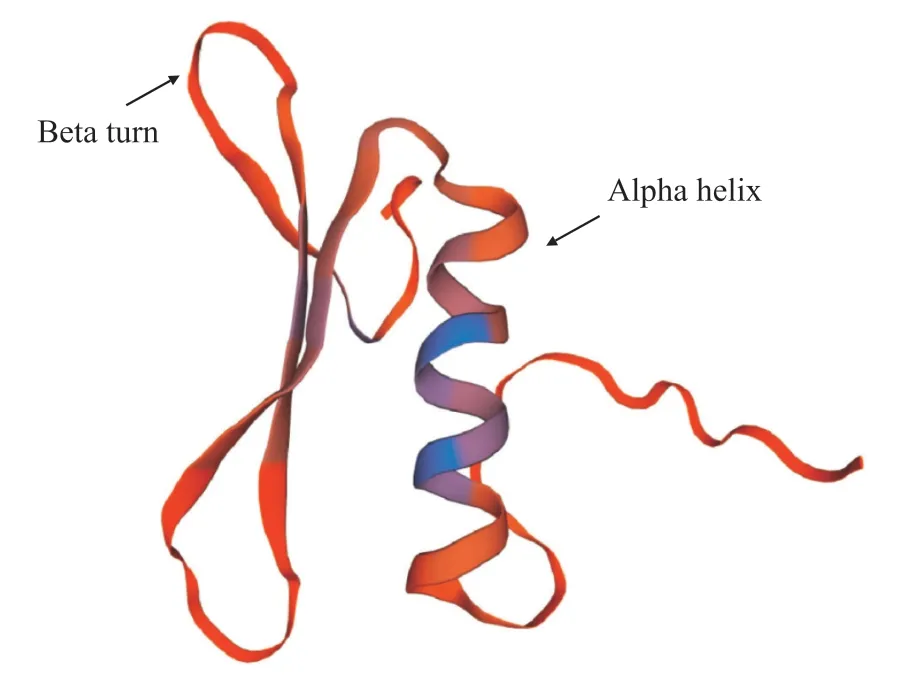
图4 GmWIN1-6 蛋白的三级结构Fig. 4 Tertiary structure of GmWIN1-6 protein
2.4 大豆GmWIN1-6 转录因子的保守结构域及系统进化分析

图5 大豆GmWIN1-6 转录因子的多序列比对和系统发育树Fig. 5 Multiple sequence alignment and phylogenetic analysis of GmWIN1-6 transcription factor
利用DNAMAN 软件将GmWIN1-6 转录因子的氨基酸序列与4 个不同物种(拟南芥、水稻、紫花苜蓿、大麦)的6 个WIN1 蛋白氨基酸序列进行同源性比对。比对结果(图5a)显示,7 个WIN1 转录因子在N 端均有一段约63 个氨基酸的保守序列,即AP2 结构域,为主要功能结构域。GmWIN1-6 转录因子包含了AP2 结构域的所有特征。GmWIN1-6还存在其他2 个结构域,分别是中间基序(middle motif,mm)和C端基序(C-terminus motif,cm)。Gm-WIN1-6 转录因子的中间基序与AtWIN1 的中间基序的关键氨基酸最为相似,C 端基序与其他4 个物种几乎一致,预测其具有相同的功能。利用MEGA 7.0 软件将GmWIN1-6 转录因子与其他4 个物种的WIN1 转录因子构建系统进化树,结果表明(图5b),GmWIN1-6 转录因子与拟南芥AtWIN1 的亲缘关系较近。
2.5 大豆GmWIN1-6 转录因子在不同组织中的表达模式
用超微量核酸分析仪测定提取到的大豆各组织RNA 的浓度及纯度,A260/A280的值均在2.0 左右,说明所提RNA 的纯度较高。凝胶成像仪观察分离的RNA 的电泳结果显示,所提取大豆各组织的RNA 条带清晰,质量好,可用于后续试验。

图6 GmWIN1-6 转录因子的表达分析Fig. 6 Expression analysis of GmWIN1-6 transcription factor
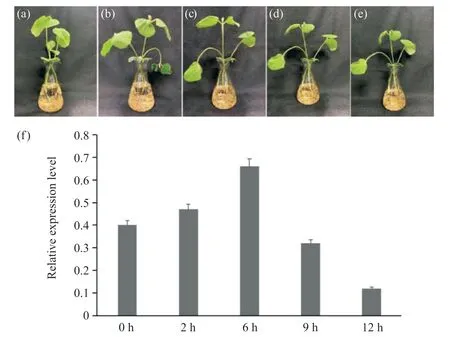
图7 大豆幼苗盐处理的不同阶段及GmWIN1-6转录因子表达分析Fig. 7 Different stages of soybean seedlings under salt treatment and GmWIN1-6 expression analysis
为鉴定GmWIN1-6 转录因子的生物学功能,本文以大豆根、茎、叶、花、荚、种子1、种子2、种子3的cDNA 为模板,采用基因特异性引物进行sqRTPCR 和qRT-PCR。sqRT-PCR 结果显示(图6a),Gm-WIN1-6 转录因子在根、茎、叶中几乎不表达,在花中表达最高。随着种子的发育,该基因表达逐渐上调,在种子发育中后期表达量较高,且与种子油脂积累时期相吻合。qRT-PCR 结果进一步表明(图6b),该基因在花中的表达量最高,其次是种子发育中后期。这与sqRT-PCR 结果几乎一致,说明Gm-WIN1-6 转录因子可能在花的发育和种子油脂积累的过程中行使功能。
2.6 大豆幼苗盐胁迫下GmWIN1-6 转录因子的表达谱
盐胁迫条件下,GmWIN1-6 转录因子在大豆幼苗的定量分析结果显示(图7),其在2、6、9、12 h与0 h 处理相比有明显的变化,是先下降再上升,而后再下降的一个过程,在6 h 达到极值。说明Gm-WIN1-6 转录因子可能参与大豆幼苗盐胁迫响应相应机制的调控。
3 讨论
近年来,植物油在生物柴油、食品保健、化工制药等方面的应用越来越广泛,需求大于供给的市场极大地促进了油脂合成相关基因的研究[20]。WIN1作为蜡质、油脂合成的关键转录因子,已成为人们研究的重点。现今,WIN1 转录因子在拟南芥、甘蓝型油菜等植物中均有所报道,而大豆的WIN1 研究还未深入,因此有必要在大豆中进行更深入的研究。大豆作为重要的油料作物,对其研究可以为提高大豆油脂含量提供理论依据。
本文根据拟南芥AtWIN1 序列,在大豆数据库中获得GmWIN1-6 成员,并对其进行了生物信息学分析。该蛋白由176 个氨基酸组成,属于亲水性蛋白。蛋白二级结构的无规则卷曲较多,预测其主要用于连接其他二级结构元件。蛋白三级结构与AtERF96 相似性很高。多序列比对分析发现,Gm-WIN1-6 在N 端有一段约63 个氨基酸的保守序列,与其他物种的WIN1 转录因子相似性很高,中间基序和C端基序与其他物种也很相似。进化树分析发现GmWIN1-6 转录因子与拟南芥AtWIN1 的亲缘关系很近。综上可推测,GmWIN1-6蛋白也具有WIN1的活性。
本研究证实,GmWIN1-6 转录因子在大豆不同组织中均有表达,在根、茎、叶、荚中表达较低,在花中的表达量最高。已有研究发现,大多数高等植物均是在花蕾中具有较高的表达[11],推测Gm-WIN1-6 可能与TAG 参与有性生殖相关。TAG 占据了花粉块质量的30%~40%,但其在花粉中的具体作用还不清楚,可能是为花粉管生长所需膜脂的快速合成提供脂肪酸原料[21]。同时在整个种子发育阶段,尤其是中后期,GmWIN1-6 也具有较高的表达量,与种子油脂积累时期吻合,推测其参与了种子形成过程中油脂的积累。进而本文又对Gm-WIN1-6 转录因子进行了盐胁迫研究,发现在高盐胁迫下,GmWIN1-6 转录因子具有响应盐胁迫的机制,可能激活了植物激素信号通路,进而促进下游功能基因的表达[22-23]。总体而言,GmWIN1-6 转录因子不仅在蜡质、脂质合成方面起到关键作用,还在胁迫响应机制中起调控作用。
转录因子在植物发育过程中有重要作用。大部分转录因子都有转录调控区和DNA 结合区,其中转录调控区决定转录因子对基因的表达起激活作用还是抑制作用。一个转录因子可以参与调控多个相关基因,从而达到改变植物性状的目的[24]。本文主要针对GmWIN1-6 转录因子进行了分析,对其下游功能基因的研究仍需进一步的试验验证。本研究结果为了解油脂积累过程中的机制和抗盐性以及后期转基因功能分析奠定了基础。

