大鼠和小鼠术后疲劳综合征模型的建立与评价
张雯雯,尹雪蕾,王洛萱,李劲草,李 硕,张 杨,李 迎,张有志,王恒林,薛 瑞
(1.河北北方学院研究生院,河北 张家口 075000;2.解放军总医院第八医学中心麻醉科,北京 100091;3.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
术后疲劳综合征(postoperative fatigue syn⁃drome,POFS)由 Merton[1]首次提出,是指外科手术尤其是腹部大手术后,患者在康复过程中出现的以疲倦、肌无力、嗜睡、注意力和活动力下降为主的一系列临床症状[2-4]。非复杂大手术即可导致65%患者在术后首月出现POFS,复杂大手术患者POFS的发生率更高,持续时间长达3个月[5-6]。POFS的发生率和持续时间甚至超过术后疼痛[7],延长了患者恢复时间并降低患者生活质量,造成严重的经济和社会负担。国内外对POFS的研究起步较晚,POFS的发病机制和治疗靶标尚不明确,目前以对症治疗为主,治疗方法有限。
POFS病理机制研究和新药评价依赖于理想的动物模型和可靠的评价指标,但目前POFS模型研究同样严重滞后,进一步制约了POFS病理机制和新药研究。目前,POFS模型构建主要以大鼠为研究对象,造模方式上主要以70%小肠切除为主要手段,但小肠切除-吻合术需要在体视显微镜下完成,手术时间长,操作难度大,且术后有出现肠漏和短肠综合征的风险。70%肝切除术最早为研究肝细胞再生和肝移植而建立,手术方法成熟且具有手术时间短、动物成活率高的特点,可满足新药评价需求。我们在PubMed上以“postoperative fatigue AND hepatectomy(术后疲劳和肝切除术)”为关键词进行文献检索(检索时间2021-02-10),仅有21篇文献报道,而在动物水平进行肝切术致POFS研究的仅2篇,分别采用活动性和悬尾实验进行疲劳表型的检测。鉴于以肝切除术进行POFS造模仅有少量报道,缺乏明确的客观检测指标和敏感种属研究,本研究以SD大鼠和C57BL/6J小鼠(简称C57小鼠)为实验对象,采用70%肝切除术构建POFS动物模型,并采用活动性测试、抓力测试、跑台实验、负重游泳实验和生理信号遥测技术对模型动物疲劳状态、肌肉力量、运动耐力和睡眠结构进行多指标综合评价。确定敏感种属和评价指标后,评价经典抗疲劳药物咖啡因的治疗作用,并通过检测血糖、肌糖原和肝糖原水平评价POFS病理生理机制和咖啡因抗疲劳作用机制。
1 材料与方法
1.1 实验动物
24只SPF级SD大鼠,雄性,体重220~240 g;47只SPF级C57小鼠,雄性,体重20~22 g;均购自斯贝福(北京)生物技术有限公司,动物合格证号:SCXK(京)2019-0010。饲养环境温度21~24℃,湿度40%~70%,12 h昼夜明暗交替(8∶00-20∶00),自由进食饮水,适应性饲养7 d,每天抓取抚摸,而后进行手术及行为学测试。
1.2 药品、试剂和主要仪器
氯化钠注射液,石家庄四药有限公司;75%乙醇,山东利尔康医疗科技股份有限公司;碘伏,山东利尔康医疗科技股份有限公司;青霉素,重庆新吉亨药业有限公司;水合氯醛和浓硫酸,国药集团化学试剂有限公司;盐酸罗哌卡因,河北一品制药股份有限公司;咖啡因(批号:1011809066),石药集团新诺威制药股份有限公司;糖原检测试剂盒,南京建成生物工程研究所。
通用活动箱及行为学分析软件,上海吉量软件技术有限公司;大鼠抓力测试仪,济南益延科技发展有限公司;小鼠抓力测定仪,上海欣软信息科技有限公司;小动物跑台,江苏赛昂斯生物技术有限公司;脑立体定位仪和颅骨钻,瑞沃德生命科技有限公司;F50-EEE无线遥感植入子、RPC-1信号接收板和NeuroScore 3.1.1脑电分析软件,美国DSI公司;血糖仪及试纸片,上海罗氏ACCU-CHEK公司。
1.3 POFS模型的建立
经适应性饲养后,大、小鼠分别按体重均衡随机分为正常对照组(n=10)和POFS模型组(大鼠n=10,小鼠n=10)。POFS模型组采用70%肝切除术构建POFS模型,大鼠手术方法按照Madrahimov等[8]和Sumer等[9]的报道,小鼠手术方法参照Palmes等[10]的报道。大、小鼠禁食不禁水12 h,5%水合氯醛麻醉结合罗哌卡因局部镇痛。大鼠切除肝左叶和肝中叶、小鼠切除肝中央小叶和肝左小叶制备POFS模型。术后单独饲养,连续3 d im给予青霉素(100 kU·d-1)防止感染。于术后不同时间进行行为学检测,实验流程见图1。
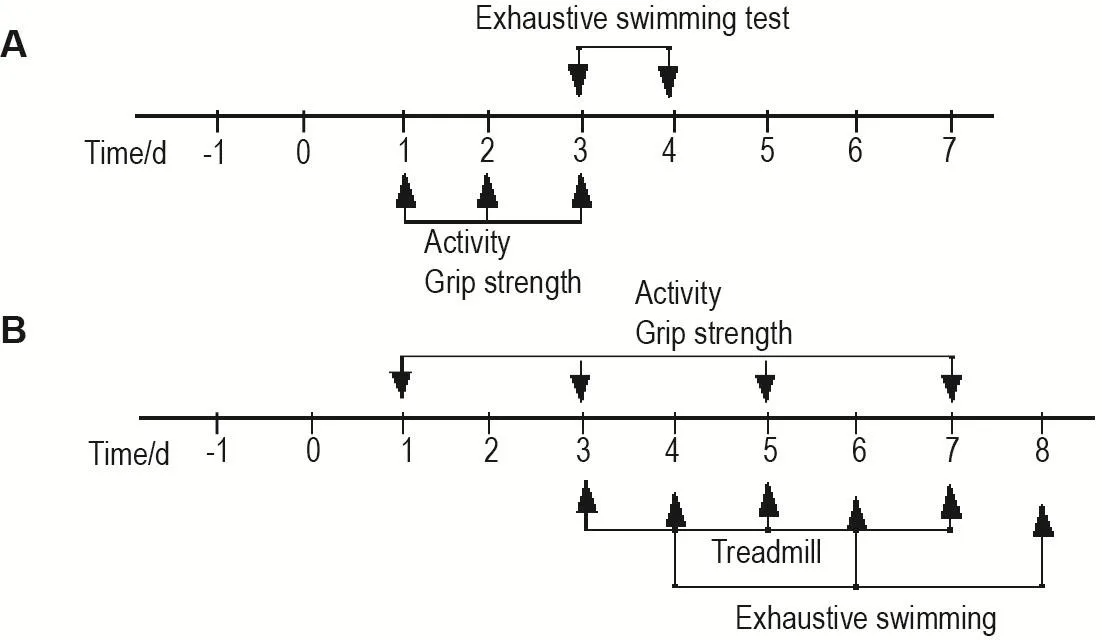
Fig.1 Test procedure of postoperative fatigue syndrome(POFS)model in rats(A)and mice(B).Rats or mice were divided into normal control group and POFS model group according to their body mass.The normal control group was not treated,and of the POFS group was established by 70% hepatectomy.
1.4 大鼠和小鼠一般状态和体重观测
从术前1 d开始,每天观察大鼠或小鼠的自我清洁能力、排便情况和毛发色泽,并进行眯眼评分(眯眼评分标准:全睁记为0分,睁3/4记为1分,睁1/2记为2分,睁1/3记为3分,全闭记为4分)。分别记录正常和模型组手术前1 d、手术当天和术后第1,3,5和7天大鼠或小鼠的体重,绘制体重增长曲线。
1.5 大鼠和小鼠活动性测试
分别于术后第1,2和3天进行大鼠活动性测试,于术后第1,3,5和7天进行小鼠活动性测试。大鼠或小鼠在安静的实验室适应60 min后,头朝向左上角放入自发活动测试箱〔大鼠为黑色正方形(50 cm×50 cm×50 cm),小鼠为白色正方形(25 cm×25 cm×25 cm)〕中,适应5 min后,记录10 min内的运动距离。
1.6 大鼠和小鼠抓力测试
采用大鼠或小鼠抓力测试仪进行抓力测试,以反映动物的肌肉力量。于术后第1,2和3天测试大鼠抓力[11],术后第1,3,5和7 天测试小鼠抓力。适应性抓取训练后,将大鼠或小鼠轻轻放于抓力板上,抓住鼠尾后1/3向后平行于抓力板均匀牵拉,直至其松爪,记录抓力,重复测量3次,取平均值。
1.7 大鼠和小鼠力竭游泳实验
采用力竭游泳实验反映动物的运动耐力。术后第3和4天,实验大鼠尾部负其体重8%的铅块后放入自制大鼠游泳缸〔直径50 cm×高70 cm,水深50 cm,水温(28±1)℃〕,记录游泳力竭潜伏期。力竭标准为头部没入水中>8 s且不再浮出水面。
术后第4,6和8天,实验小鼠尾部负其体重10%的铅块后放入自制小鼠游泳缸〔直径18 cm×高50 cm,水深30 cm,水温(21±1)℃〕,记录力竭潜伏期。力竭标准为头部没入水中>10 s且不再浮出水面。
1.8 大鼠睡眠监测实验
POFS建模前,参照Petrovic等[12]的方法手术安放植入子。5%水合氯醛麻醉,头颈部手术区域备皮、消毒后,大鼠固定在脑立体定位仪手术台上,纵向切开皮肤,暴露颅骨,找到bregma点(位于冠状缝和矢状缝的交接处),在其左右各2 mm处划定标记,颅骨钻钻孔后将植入子导线置于颅骨下,但不穿破硬脑膜,植入子主体部分置于大鼠背部皮下(n=4)。术后单笼饲养5 d后,采集24 h内大鼠基础脑电特征,以观察其睡眠情况。然后同1.3方法建立POFS模型,手术苏醒后立即置于信号接收板上监测24 h脑电特征,采用NeuroScore软件根据δ波和θ波等特征自动进行睡眠时相分类,分别为清醒(awake)、活动清醒(active awake)、异相睡眠(paradoxical sleep,PS)和慢波睡眠(slow wave sleep,SWS)时相,计算24 h周期内时相累计持续时间百分比。各时相累计持续时间百分比(%)=各时相累计持续时间(min)×100/24×60(min)。
1.9 小鼠跑台运动实验
术后第3,5和7天进行小鼠跑台运动实验,以反映小鼠的运动耐力。参照Dougherty等[13]的方法稍做修改。实验分跑台训练和测试2步进行。训练过程中设置跑台倾斜角为0°,电击强度为2.5 mA,共分3次进行。第1次训练速度从2 m·min-1开始,到10 m·min-1结束,历时10 min;第2次训练速度从 4 m·min-1开始,到 12 m·min-1结束,历时13 min;第3次训练速度从8 m·min-1开始,到14 m·min-1结束,历时15 min;加速度均为100 m·min-2,待小鼠学会跑步后可进行跑台测试。测试过程中跑台倾斜角为0o,电击强度为1.5 mA,加速度仍为100 m·min-2,流程为14 m·min-1持续2 min,16 m·min-1持续 3 min,18 m·min-1持续25 min,20 m·min-1持续15 min,22 m·min-1持续15 min,24 m·min-1持续15 min,26 m·min-1持续30 min。测试时记录从开始运动到疲劳的运动距离。疲劳标准为小鼠始终在跑道后1/3段,跑步姿势由正常变为伏地式,呼吸急促。
1.10 在小鼠POFS模型上评价咖啡因抗疲劳作用
27只C57小鼠按体重均衡随机分为正常对照组、模型组和模型+咖啡因组(n=7~9),模型组和模型+咖啡因组按照1.3方法构建小鼠POFS模型,正常对照组不做处理。于术后第1,3和5天行为学实验和尾静脉取血前30 min分别给药1次,术后第1天进行活动性测试,术后第3天进行活动性和跑台测试(实验方法同1.5和1.9),术后第5天各组尾静脉采血测血糖,并将小鼠处死,取肝和肌肉组织,参照试剂盒方法测定肝糖原和肌糖原含量。正常对照组和模型组ip给予生理盐水(10 mL·kg-1),模型+咖啡因组ip给予咖啡因3 mg·kg-(110 mL·kg-1)。
1.11 统计学分析
2 结果
2.1 POFS模型大鼠一般状态、活动性、肌肉力量和运动耐力
与正常对照组相比,模型组大鼠在术后第1和2天出现松毛、竖毛、毛发枯槁、眼周鼻周污秽附着和粪便黄软等现象,手术当天眯眼评分显著增加(P<0.01,图2A);术后第1,3,5和7 天体重显著下降(P<0.05,P<0.01,图2B);术后第1天活动性显著下降(P<0.01,图2C);2组大鼠在术后第1和3天抓力稍有降低,但无显著性差异(图2D);术后第3和4天力竭游泳时间有升高趋势,但无显著性差异(图2E)。

Fig.2 Behavioral phenotype of POFS model in SD rats.POFS in rats was induced by 70% hepatectomy,and squint score(A),body mass(B),travel distance(C),grip strength(D)and exhaustive swimming time(E)were recorded according to the test procedure as shown in Fig.1A.±s,n=10.*P<0.05,**P<0.01,compared with normal control group.
2.2 POFS模型大鼠睡眠结构
如图3所示,与术前1 d相比,POFS模型组大鼠术后当天及术后第1天总清醒时间百分比显著减少(P<0.01,P<0.05,图3A),总睡眠时间百分比显著增加(P<0.01,P<0.05,图3B),活动清醒时间百分比显著减少(P<0.01,P<0.05,图3D),慢波睡眠时间百分比显著增加(P<0.01,P<0.05,图3F)。
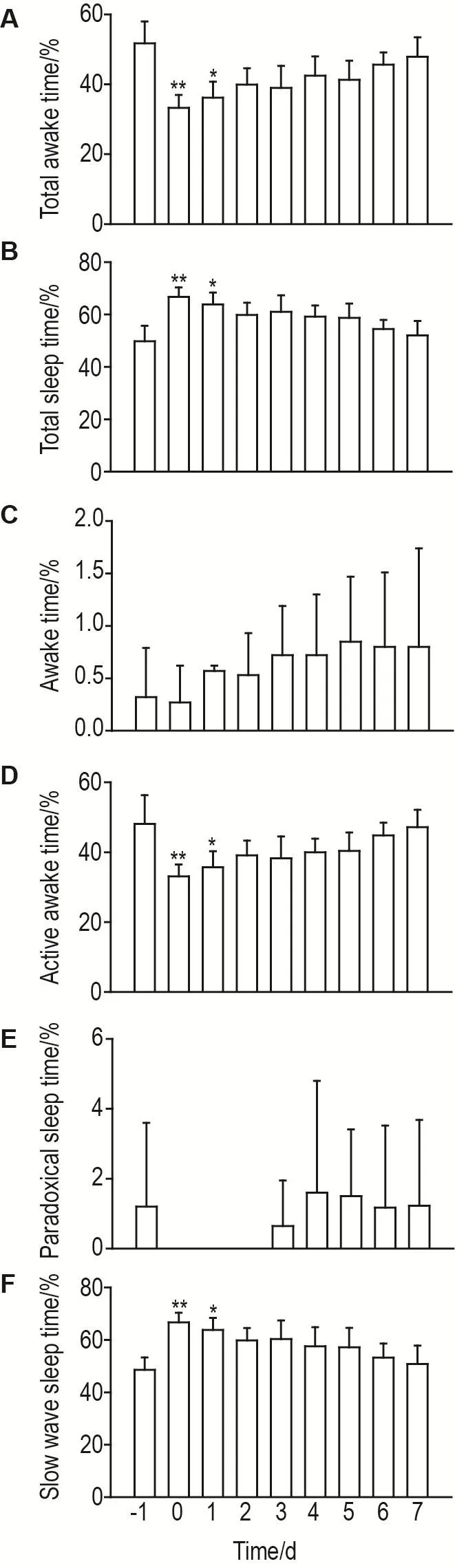
Fig.3 Sleep structure of POFS model in SD rats.Elec⁃trodes were surgically implanted in rats,and 5 d later basic sleep was monitored before 70% liver resection was used to estab⁃lish the POFS model.After waking up,the sleep structure of 24 h were monitored.The time percentages of total awake(A),total sleep(B),awake(C),active awake(D),paradoxical sleep(E)and slow wave sleep(F)were recorded.±s,n=4.*P<0.05,**P<0.01,compared with baseline data recorded on the day before hepatectomy.
2.3 POFS模型小鼠一般状态、活动性、肌肉力量和运动耐力
结果如图4所示,与正常对照组相比,模型组小鼠术后第1,2和3天出现松毛、竖毛、毛发枯槁、眼周鼻周污秽附着、粪便黄软等现象,手术当天及术后第1 天眯眼评分显著增加(P<0.01,P<0.05,图4A);术后第1,3,5和7 天体重显著下降(P<0.05,P<0.01,图4B);术后第1和3天活动性显著下降(P<0.01,图4C);术后第1,3和5天抓力显著降低(P<0.01,图4D);术后第3和5天跑台运动距离显著减少(P<0.01,图4E),术后第4和6天力竭游泳时间无显著性差异(图4F)。

Fig.4 Behavioral phenotype of POFS model in C57 mice.POFS in mice was induced by 70% hepatectomy,and squint score(A),body weight(B),travel distance(C),grip strength(D),treadmill distance(E)and exhaustive swimming time(F)were recorded according to the test procedure as shown in Fig.1B.x± s,n=10. *P<0.05,**P<0.01,compared with normal control group.
2.4 咖啡因对POFS模型小鼠活动性和跑台运动距离的影响
与正常对照组相比,模型组小鼠术后第1和3天自发活动距离显著减少(P<0.01,图5A),术后第3天跑台运动距离显著减少(P<0.01,图5B);与模型对照组相比,模型+咖啡因组小鼠术后第1和3天自发活动距离显著增加(P<0.05,P<0.01,图5A),术后第3天跑台运动距离显著增加(P<0.05,图5B)。

Fig.5 Effect of caffeine on travel distance(A)and treadmill distance(B)in POFS model in mice.Mice in the POFS group and POFS+caffeine group were treated with 70% hepatectomy,and caffeine(3 mg·kg-1)was ip given 30 min before each behavioral test.±s,n=7-9.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with POFS group.
2.5 咖啡因对POFS模型小鼠血糖、肝糖原和肌糖原水平的影响
如图6所示,与正常对照组相比,模型组小鼠在术后第5天血糖(P<0.01)、肝糖原(P<0.01)和肌糖原(P<0.05)水平均显著降低(P<0.05,P<0.01),模型+咖啡因组较模型组肝糖原和肌糖原水平较模型组显著升高(P<0.05),血糖变化无显著性差异。
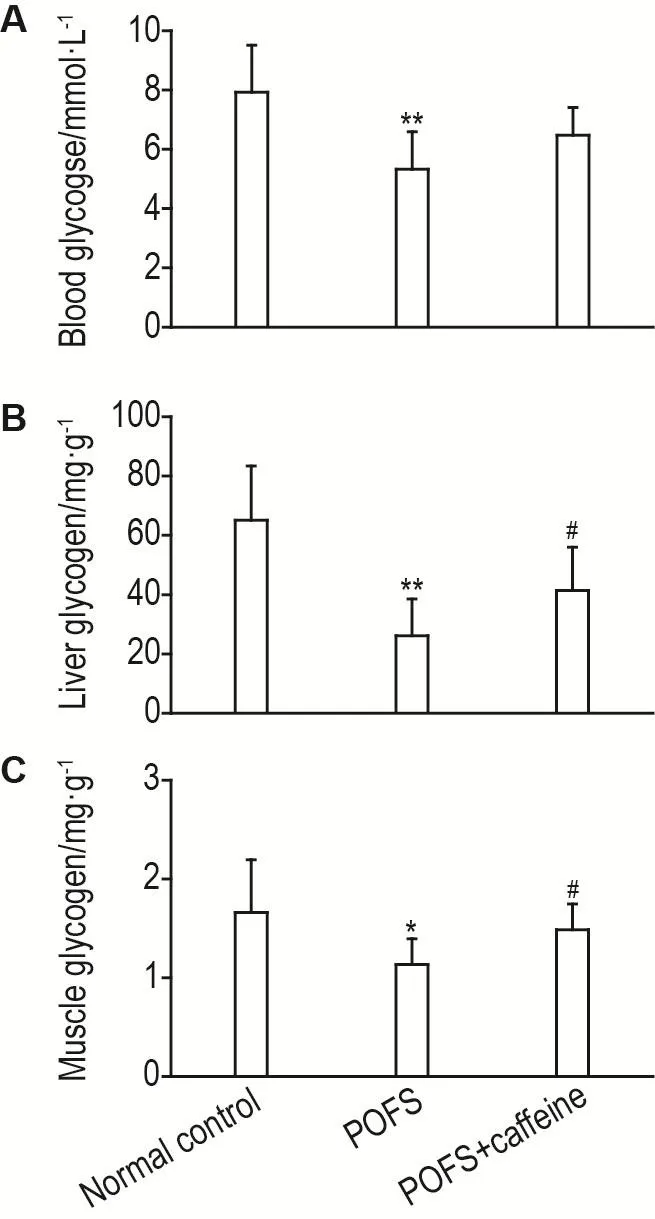
Fig.6 Effect of caffeine on blood glucose(A),liver glycogen(B)and muscle glycogen(C)in POFS model in mice.Mice in POFS group and POFS+caffeine group were treated with 70% hepatectomy,and caffeine(3 mg·kg-1)was ip given on the 5thday after operation,then blood was collected from the tail vein for blood glucose measurement,and liver and muscle tissues were collected for liver glycogen and muscle glycogen test.x± s,n=7-9. *P<0.05,**P<0.01,compared with normal control group;#P<0.05,compared with POFS group.
3 讨论
理想动物模型应满足表观有效性、预测有效性和结构有效性3个基本要求[14]。表观有效性指动物模型应尽可能复制人类疾病的行为学表现;预测有效性指药物或治疗手段在模型动物和临床患者有效性应具有一致性;结构有效性是指模型动物与临床患者具有相似的病因、病程发展和病理生理机制。自1954年POFS概念被首次提出后,关于术后疲劳病因的文献研究[15-17]不断出现。现有研究证据表明,POFS是由生理、心理和社会因素共同作用的结果,其病理生理机制可能与应激-内分泌紊乱引起的能量代谢障碍有关[18]。
鉴于肝切除术具有手术时间短、动物成活率高的特点,因此本研究采用70%肝切除术构建了大鼠POFS模型,发现大鼠术后出现了活动性下降、眯眼、自我清洁能力下降、排稀便和毛发枯槁等疲劳样表现,但疲劳表型仅可持续1 d。Lu等[19]以70%肝切除术制备大鼠POFS模型,分别检测了术后第1天和第7天大鼠的活动性,发现术后疲劳表型可持续7 d,但其采用的是单因素方差分析,我们采用的是两因素重复测量方差分析,持续时间的不一致可能与统计方法有关。为了进一步明确POFS的发病机制,为POFS模型提供合适的客观指标,本研究采用生理遥测技术对术后大鼠进行了睡眠监测,旨在评价POFS对睡眠时间和结构的影响。结果显示,70%肝切除术后大鼠出现睡眠异常,表现为总清醒时间百分比减少和总睡眠时间百分比增加,提示POFS大鼠术后可能具有嗜睡样表现。进一步睡眠结构分析表明,POFS大鼠出现的睡眠异常以慢波睡眠百分比增加和活动清醒时间百分比减少为特征,且与疲劳表征持续和恢复时间相一致。鉴于慢波睡眠的增加有利于促进体力的恢复[21],本研究认为大鼠术后虽出现嗜睡样表现,但慢波睡眠的增加可能是术后大鼠迅速恢复的原因,该发现为深入研究POFS提出了线索,也为大鼠POFS模型维持时间较短提供了实验依据。需要指出的是,由于生理遥测技术平台的植入子数量有限,本研究每组仅监测了4只大鼠的睡眠结构,虽然组内大鼠具有良好的一致性,但后续仍有待增加动物例数进行更为深入的研究。综上,本研究实验结果表明,大鼠POFS可能只适用于术后急性疲劳评价,可综合采用活动性和睡眠监测为客观指标进行评价。
如前所述,目前POFS模型构建主要以大鼠为研究对象,未见小鼠POFS模型的报道。鉴于大鼠POFS模型表型持续时间仅1 d,且客观检测指标有限,而小鼠部分肝切除术亦可成功实现,因此本研究以C57小鼠为研究对象又构建了小鼠POFS模型,并采用多种指标综合评价了模型小鼠的疲劳状态、肌肉力量、有氧和无氧运动耐力。本研究发现,70%肝切除同样可引起小鼠活动性下降、眯眼、自我清洁能力下降、排稀便和毛发枯槁等术后疲劳样表现,疲劳表型可持续5 d,且POFS小鼠出现了跑台有氧运动耐力和肌肉力量的下降。因此,小鼠POFS模型可综合采用活动性、运动耐力和肌肉力量为客观指标进行评价。
由上述研究结果可知,大鼠POFS模型和小鼠POFS模型维持时间有较大差异,且2个种属动物疲劳表型的持续时间与临床特征相差较远,这可能有3个方面的原因:第一,不同种属动物造模敏感性可能不同,即使同一种属不同品系动物敏感性亦可能不同;第二,不同种属动物的肝再生速度和机制不同,根据文献报道,肝再生速度大鼠>小鼠>人[22-25];第三,临床疾病发生的影响因素较之实验动物更为复杂,这也是动物模型普遍的局限之处。综上,小鼠POFS模型可模拟临床术后患者出现的多种疲劳样表现,具有良好的表观效度。
需要指出的是,本研究在大、小鼠模型构建上选择了不同的检测方法和流程,这主要是由于大、小鼠模型的维持时间不同。由于大鼠POFS模型持续时间短,小鼠持续时间长,所以大鼠活动性和抓力检测选择了在术后第1,2和3天进行,小鼠选择在术后第1,3,5和7天,目的是确定出现表型的时间和表型消失的时间,为后续药物评价提供依据。此外,由于小鼠同时进行了跑台和负重游泳实验,所以二者交替进行检测,跑台分别在第3,5和7天检测,负重游泳分别在术后第4,6和8天检测。而大鼠表型消失快,跑台实验又需要在术后伤口恢复3 d才能进行,此时表型已经消失,故未进行跑台实验。对于生理信号监测,大鼠和小鼠都可以作为研究对象;但是相对而言,小鼠由于体型更小,植入子植入后对其自身正常活动的影响较大鼠大,稳定性也不如大鼠,因此本研究只对大鼠进行了睡眠监测。
在确定小鼠是POFS造模的敏感种属后,本研究以经典抗疲劳药物咖啡因为阳性对照药,对模型的预测效度和结构效度进行了评价。结果表明,咖啡因可显著改善70%肝切除所致小鼠活动性和跑台运动耐力下降,提示其在小鼠POFS模型中具有治疗作用。血糖是正常生理活动和耐力运动的最重要的供能物质,疲劳与体内肌糖原和肝糖原分解速度过快、无法维持血糖正常水平有关[26-27]。再加上手术创伤会引起机体应激,进而引起内分泌和代谢紊乱,在胰岛素抵抗及儿茶酚胺类物质分泌共同作用下加速分解代谢,尤其是血糖的利用度会大幅提升,而术前禁食会进一步降低血糖,因此以血糖和糖原为代表的供能物质不足可能是POFS发生的重要病理生理机制。本研究在小鼠POFS模型中发现,模型小鼠在术后第5天仍表现为血糖、肌糖原和肝糖原含量显著下降,而咖啡因可以显著提高POFS小鼠肌糖原和肝糖原水平以维持血糖稳定,咖啡因影响糖原含量的确切机制有待进一步研究。可见小鼠POFS模型具有良好的预测效度和结构效度。
综上,本研究成功建立了大鼠和小鼠POFS模型,其中大鼠POFS模型仅能用于术后急性疲劳评价,小鼠POFS模型可作为POFS病生机制研究和新药评价的合适动物模型。

