VX染毒小鼠乙酰胆碱酯酶活性和含量与作用时间的相互关系
黄静宜,章子男,2,李 尧,3,邢欢纯,王 琦,王永安,杨 军
(1.军事科学院军事医学研究院毒物药物研究所,高毒物质对抗药物研究国家重点实验室,北京 100850;2.中国人民解放军95865部队,北京 102200;3.中国人民解放军32292部队,黑龙江牡丹江 157000;4.中国人民解放军32265部队,广东 广州 510000)
神经性毒剂(nerve agent)是20世纪30年代研制杀虫剂时发展起来的,属于有机磷酸酯类化合物,迄今为止这类毒剂在外军装备的化学战剂中毒性最大,主要分为G类和V类。G类有塔崩(tabun,GA)、沙林(sarin,GB)和梭曼(soman,GD),V类主要有VX,VM和VE。VX为S-(2-二异丙基氨乙基)-甲基硫代磷酸乙酯,由瑞典籍化学家拉斯·埃里克·塔梅林于1957年发明,在美国和前苏联等军事大国的化学武器库中有大量贮存,是目前毒性最强的神经性毒剂[1-2]。由于VX具有物理性质稳定、挥发度小、使用量低、持续沾染时间长、脂溶性强和极易透皮吸收等特性,极少量接触后即可造成严重中毒。2017年吉隆坡机场暗杀事件中使用的就是这种毒剂[3]。
神经性毒剂的主要作用机制是毒剂分子与乙酰胆碱酯酶(acetylcholinesterase,AChE)底部的活性丝氨酸基团共价结合,从而抑制其水解神经递质乙酰胆碱(acetylcholine,ACh)的生理作用,造成ACh在突触间隙蓄积,进一步引发胆碱能系统功能紊乱[4]。而对染毒后中枢和外周AChE与VX间的量效关系、AChE含量和活性在体内随时间的变化以及毒剂分子的实际起效量与总染毒量之间的关系鲜有报道。本研究选择昆明种小鼠为研究对象,评价不同剂量VX对小鼠脑和外周血AChE活性及含量随时间变化的影响,探索相关规律。
1 材料与方法
1.1 药品、试剂和仪器
VX,纯度≥95%,陆军防化学院合成,实验前用蒸馏水溶解。NaCl,MgCl2·6H2O,NaH2PO4·2H2O和Na2HPO4·12H2O,国药集团化学试剂有限公司;硫代乙酰胆碱(acetylthiocholine,ATCH)、Tris碱、二硫基双硝基苯甲酸(dithiobisnitrobenzoate,DTNB)和Triton X-100,美国Sigma公司;小鼠AChE含量测定ELISA试剂盒,江苏酶标生物科技有限公司;所有化学试剂均为分析纯。
高速低温组织研磨仪(KZ-III-F),武汉塞维尔生物科技有限公司;高速低温离心机(3-18K),美国Sigma公司;隔水式恒温培养箱(GHP-9080),上海一恒科技有限公司;酶标仪(VERSA max),美国MD公司;涡旋仪(Ql-901),海门市其林贝尔仪器制造有限公司。
1.2 实验动物、分组和染毒处理
昆明种小鼠,雄性,体重18~22 g,购自北京市维通利华实验动物技术有限公司,动物合格证号:SCXK(京)2016-0011。小鼠按体重随机分组,颈部sc给予VX 0(正常对照组,n=10),5,10和16 μg·kg-1,分别于染毒后10 min,1 h,4 h,24 h,48 h和72 h(每剂量每时间点n=10)摘除眼球收集外周血,并将小鼠处死后取全脑,记录脑重,计算脑系数。脑系数=脑重(g)/体重(g)×100。
1.3 Ellman法测定小鼠脑和外周血AChE活性
将1.2中收集的外周血按照1∶100加入去离子水,涡旋混匀;将1.2中收集的全脑组织在滤纸上去除所沾血液后称重,加入1.3 mL胆碱酯酶提取液(含NaCl 58.44 g·L-1,MgCl2·6H2O 10.165 g·L-1,Tris碱1.2114 g·L-1和Triton X-100 10 mL·L-1的水溶液),匀浆后离心10 min(4℃,13 000×g),吸取上清液按1∶25加入PBS,涡旋混匀。处理后的外周血和脑组织样品加入96孔酶标板,每样品设6复孔,前3孔加入80 μL PBS,后3孔加入50 μL PBS和30 μL ATCH溶液(含0.086% ATCH的PBS),离心1 min(4℃,1000×g)去除孔内气泡,37℃恒温箱孵育30 min,各孔加入20 μL含0.03% DTNB的PBS,在酶标仪415 nm下测定各孔吸光度(A415nm)值,计算脑和外周血AChE活性抑制率。抑制率(%)=1-染毒组A415nm/正常对照组A415nm。
1.4 ELISA测定小鼠脑和外周血AChE含量
将1.2中收集的外周血离心15 min(4℃,3000×g)取上清(即血清);脑组织处理方法同1.3。按ELISA试剂盒说明书操作,每样品设3复孔,反应结束后用酶标仪测定各孔A450nm值,以标准孔浓度为横坐标,A450nm值为纵坐标,做标准曲线并得出回归方程。血清和脑组织样品加样及检测步骤同标准品,将样品A450nm值带入回归方程,计算样品AChE含量。
1.5 小鼠脑和外周血中被VX抑制的AChE量和VX实际消耗量计算
有研究表明,在分子层面上抑制1个酶仅需消耗1个毒剂分子[5]。根据Ellman法和ELISA所得数据,计算脑和外周血中被不同剂量VX抑制的AChE量、毒剂的理论消耗量及其占实际染毒总剂量的百分比。具体计算公式如下:

其中,P为脑或外周血中被VX抑制的AChE量,N为VX实际消耗百分比(即脑或外周血内与AChE结合的VX占染毒总剂量的百分比),c为ELISA测得的脑或外周血中AChE含量(μmol·L-1),I为Ellman法测得的脑或外周血中AChE抑制率(%),S为小鼠脑系数,D为VX剂量(μg·kg-1),Mr为VX的相对分子质量,n为染毒总剂量(nmol),m为小鼠体重(g),式①中1.3为实验中制备脑样品时加入的液体体积(mL),式②中5.83/100为每100 g体重小鼠含5.83 mL血液的理论值。
1.6 统计学分析
2 结果
2.1 小鼠VX中毒症状
小鼠VX染毒后24 h内,参照文献[6]神经毒剂中毒程度的判断标准,VX 5 μg·kg-1组小鼠出现轻度流涎症状,属于轻度中毒;10 μg·kg-1组70%小鼠在染毒15 min后出现多汗和支气管黏液分泌增多的症状,30%的小鼠出现轻度抽搐,属于中度中毒;16 μg·kg-1组全部出现多汗和支气管黏液分泌增多的症状,70%的小鼠出现中重度抽搐,20%死亡,属于重度中毒。
2.2 VX对小鼠体重、脑重和脑系数的影响
如图1所示,不同剂量VX染毒后,在72 h内各染毒组小鼠体重、脑重和脑系数与正常对照组比较均未见明显差异,各组体重均呈增长趋势。
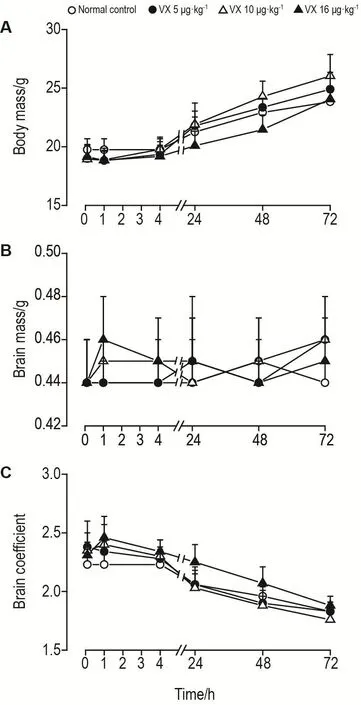
Fig.1 Effect of VX exposure on body mass(A),brain mass(B)and brain coefficient(C)in mice.Mice were subcutaneously injected with VX 0(normal control group),5,10 and 16 μg·kg-1,the body mass and brain mass were recorded at 10 min,1 h,4 h,24 h,48 h and 72 h to calculate the brain coeffi⁃cient.Brain coefficient=brain mass(g)/body mass(g)×100.x±s,n=10.
2.3 VX对小鼠脑和外周血AChE活性的影响
与同剂量组10 min时的结果比较,VX 5和10 μg·kg-1组外周血AChE活性抑制率在染毒4 h显著下降(P<0.01);16 μg·kg-1组在染毒24 h显著下降(P<0.01)。各组外周血AChE活性抑制率均在染毒48 h达到最低,且数值接近;72 h均略微回升(图2A)。
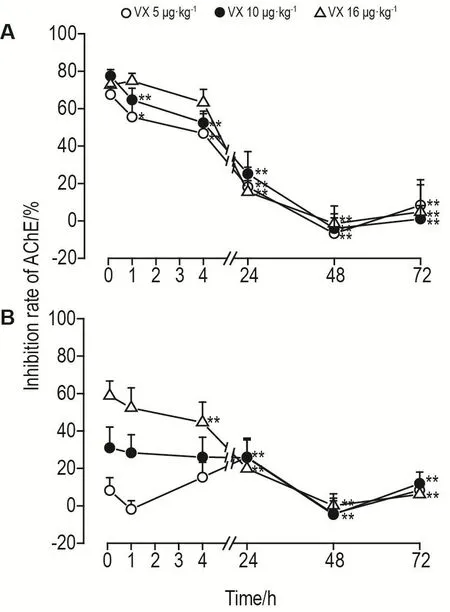
Fig.2 Inhibition of VX on acetylcholinesterase(AChE)activity in peripheral blood(A)and brain(B)of mice by Ellman assay.See Fig.1 for the mouse treatment.Inhibi⁃tory rate of AChE(%)=1-A415 nmof experiment group/A415 nmof normal control group.x±s,n=10.*P<0.05,**P<0.01,compared with corresponding VX group 10 min after exposure.
与同剂量组10 min时的结果比较,5 μg·kg-1组脑AChE活性抑制率在24 h时显著上升(P<0.01),而在其他时间点均无明显变化;10 μg·kg-1组在染毒48和72 h显著下降(P<0.01);16 μg·kg-1组在48 h内随染毒时间的延长而逐渐下降,在4~72 h下降幅度具有统计学差异(P<0.01)。各组脑AChE活性抑制率均在染毒48 h达最低,且数值接近;72 h均略微回升(图2B)。
总体而言,不同剂量VX染毒组小鼠脑和外周血中AChE活性抑制率在24 h后变化趋势基本一致,且抑制率接近,均在48 h时达最低值,72 h出现一定程度地回升。
2.4 VX对小鼠脑和外周血AChE含量的影响
通过ELISA测得AChE浓度的标准曲线为c(nmol· L-1)=133.74A450nm-1.8325,r2=0.9968。利用该标准曲线计算小鼠外周血AChE的含量,结果见表1。与正常对照组相比,VX 5 μg·kg-1组外周血AChE含量在1 h明显降低(P<0.01),24 h明显升高(P<0.05);16 μg·kg-1组在10 min和4 h均显著降低(P<0.01);而10 μg·kg-1组各时间点未见明显变化。
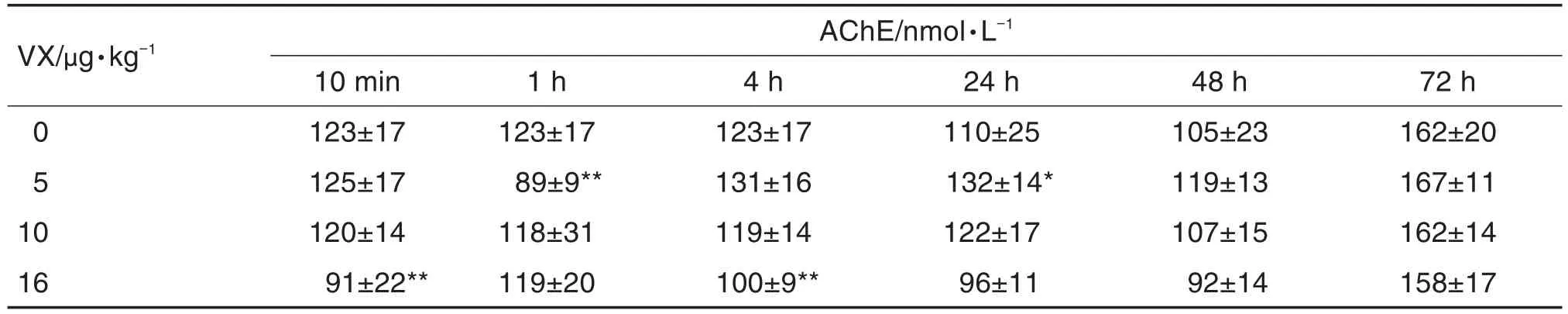
Tab.1 Effect of VX on AChE content in peripheral blood of mice by ELISA
利用标准曲线计算小鼠脑AChE含量结果见表2。与正常对照组相比,5 μg·kg-1组脑AChE含量在4 和 72 h显著下降(P<0.01);10 μg·kg-1组在1,24和72 h均显著下降(P<0.05,P<0.01);而16 μg·kg-1组仅在1 h时显著下降(P<0.05),其余时间点均与正常对照组无明显差异。

Tab.2 Effect of VX on AChE content in brain tissue of mice by ELISA
2.5 小鼠脑和外周血被VX抑制的AChE量
在外周血中被VX抑制的AChE量如表3所示。与同剂量组10 min时相比,5 μg·kg-1组小鼠外周血与VX结合的AChE量在染毒后1,24,48和72 h显著下降(P<0.01);10 μg·kg-1组在染毒后1~72 h持续显著下降(P<0.05,P<0.01);16 μg·kg-1组在染毒后24~72 h显著下降(P<0.01)。
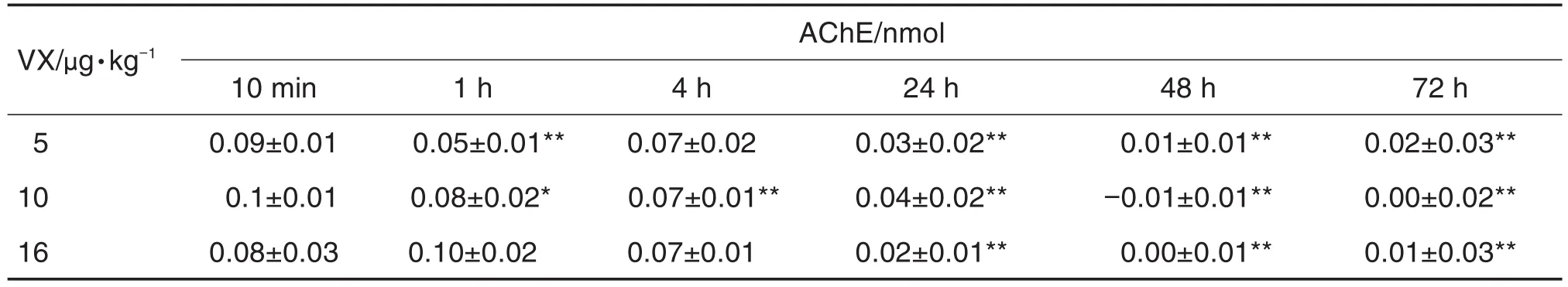
Tab.3 Content of AChE inhibited by VX in peripheral blood of mice
脑内被VX抑制的AChE量如表4所示。与同剂量组10 min时相比,5 μg·kg-1组小鼠脑内被VX抑制的AChE量在染毒后1和48 h时显著下降(P<0.01),在其他时间点的变化无统计学意义;10和16 μg·kg-1组在染毒后 24~72 h 均持续显著下降(P<0.05,P<0.01)。
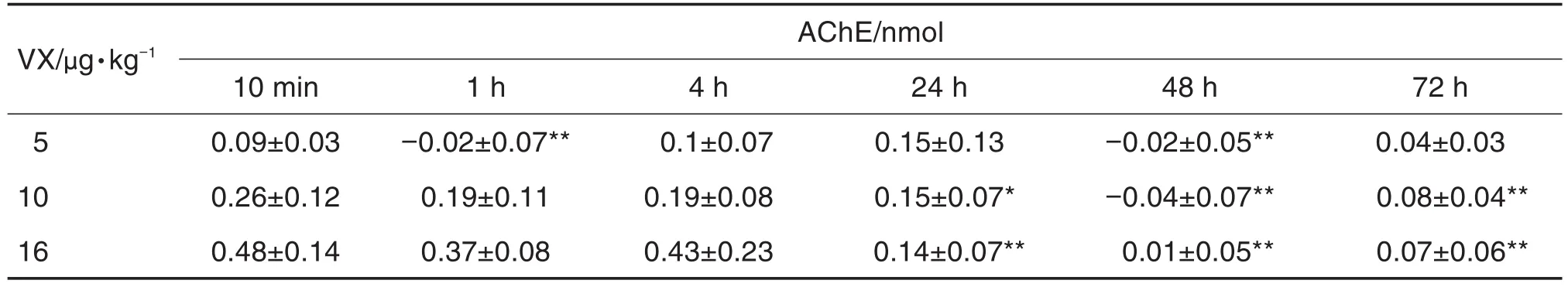
Tab.4 Content of AChE inhibited by VX in brain tissue of mice
2.6 小鼠脑和外周血VX消耗量
理论上,在分子层面上抑制1个酶仅需消耗1个毒剂分子[5]。由公式⑤推算得出,本研究中最大染毒剂量(16 μg·kg-1)的毒剂总剂量约为2 nmol。在各剂量和各时间点中,VX 16 μg·kg-1在染毒10 min时VX总消耗量最高,外周血和脑中VX消耗量分别为0.08 nmo(l表3)和0.48 nmo(l表4),总消耗量为0.56 nmol,占染毒总剂量的28%。提示有大量毒剂残余体内,尚未参与反应。
染毒后72 h内VX的实际消耗量占染毒总剂量的百分比如图3所示,与同剂量组10 min时相比,10和16 μg·kg-1组在24,48和72 h时外周血和脑内VX消耗量均同时明显下降(P<0.01),5 μg·kg-1组在1,48和72 h时外周血和脑内VX消耗量均同时明显下降(P<0.01)。
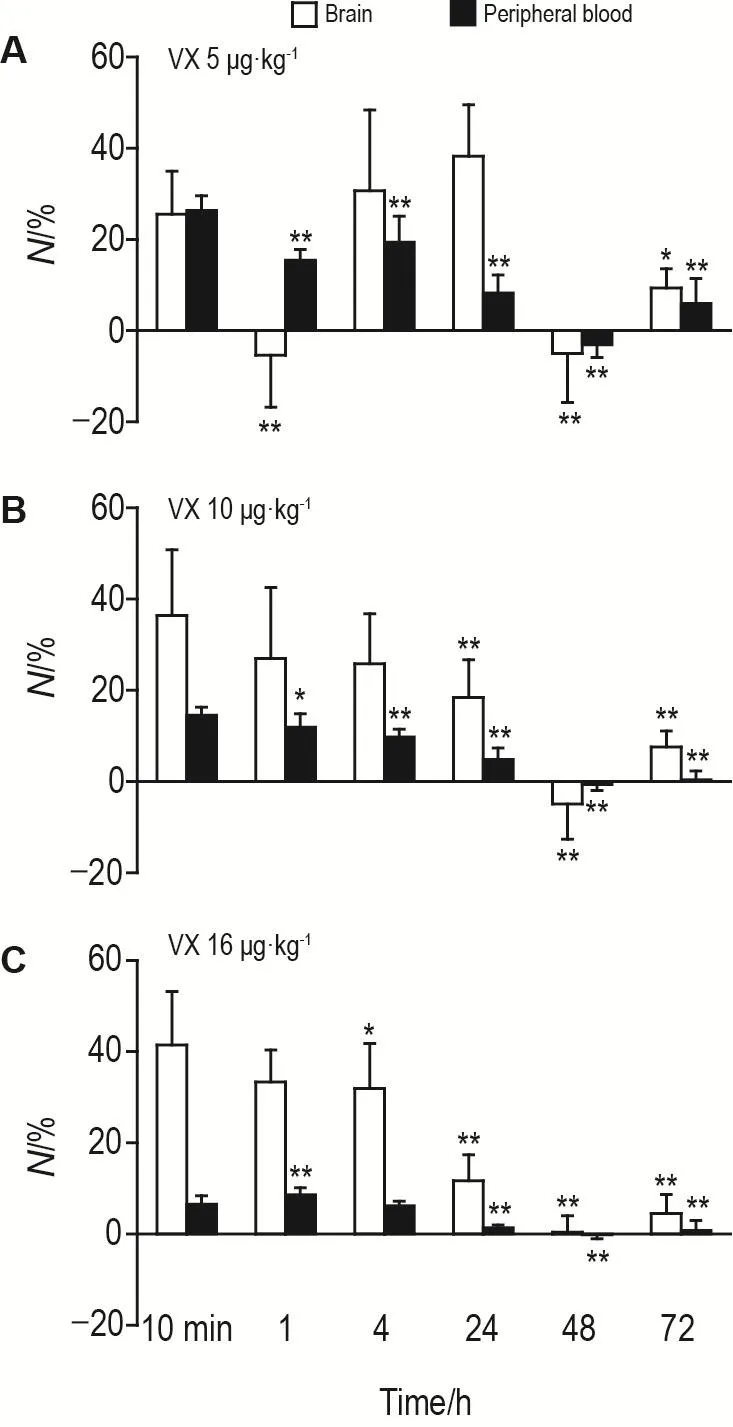
Fig.3 Consumption of VX in brain and peripheral blood of mice at different VX doses.See Fig.1 for the mouse treatment.N(%)=P/(D/Mr)×100%.N:effective consumption of VX(%)in the brain and peripheral blood;D:the total dose of VX;Mr:relative molecular mass of VX.±s,n=10. *P<0.05,**P<0.01,compared with 10 min exposure in corresponding dose group.
3 讨论
与G类毒剂相比,VX具有以下几个特点:物理性质更稳定,挥发度小,可造成环境长时间染毒[7];水解速度慢,与羧酯酶和磷酸化磷酸酶的反应更温和[8],在体内稳定存在可达12 h[9-12];体内氧化酶含量少,活性低,中毒后自发解毒能力有限;致死剂量低,无论何种中毒途径VX的毒性均居于首位[13-14]。本研究采用经典的Ellman法和ELISA评价了不同剂量VX下小鼠脑和外周AChE活性和含量随时间的变化,探索相关规律。
VX染毒后动物出现中毒症状和死亡比G类毒剂迟,中重度毒剂量染毒后15 min出现症状,20 min出现死亡,而沙林中重度剂量染毒8 min出现症状,10 min出现死亡[15]。虽然对这种延迟的生物学基础还未完全阐明,但目前研究认为,导致VX比G类毒剂更慢地通过组织和细胞膜扩散到目标组织的主要原因是较大的相对分子质量和低溶解度[16-17]。
从酶的抑制率和时间的关系看,在VX中毒后24 h内,毒剂与酶处于不断结合的阶段,外周血和脑中AChE抑制率的变化与毒剂使用量、中枢的生理性屏障有关;而经24 h充分地循环代谢后,毒剂与酶的结合达到饱和,毒剂对酶的抑制在血脑屏障内外达到一个动态的平衡。同时,在重度染毒剂量下,毒剂消耗量占毒剂总剂量的28%,表明还有大量的毒剂并未参与反应。本研究结果显示,不同剂量下VX对中枢AChE活性的抑制率在染毒后48 h达最低值,在72 h均出现回升,这可能与染毒后毒剂在体内某些组织中形成的神经性毒剂“储存库”有关,随着时间的延长,毒剂再次释放进入中枢[18]。
综上所述,①VX染毒后中毒症状出现较慢;②从AChE活性抑制率时效关系分析得出,中枢和外周血AChE活性抑制率在染毒后48 h达最低值,在72 h均出现回升;③从被毒剂抑制的AChE量推算得知,VX的理论消耗量极低,最大消耗量约为0.5 nmol,即使在中毒症状达到重度的染毒剂量下,毒剂消耗量也仅占总染毒剂量的28%,而近72%的毒剂依然残留在体内,持续进入中枢,并持续抑制AChE活性。结合上述规律,建议在VX中毒救治前期给予大量的重活化剂后,48 h内再次给予抗神经性毒剂药物,用以清除体内尚未与AChE结合的毒剂。

