粪便标本溶组织内阿米巴原虫Real-Time PCR检测方法的建立及初步评价*
张春莹 庞华胜 匡紫微 孟妍明 刘成桂 马 莹**
(1.四川大学华西医院实验医学科,四川成都 610041; 2.成都市妇女儿童中心医院,四川成都 610091)
溶组织内阿米巴原虫Entamoebahistolytica(E.histolytica)为内阿米巴科的内阿米巴属原虫,是目前国际公认的具有致病性的内阿米巴原虫,对动物和人具有侵袭性。近年来溶组织内阿米巴原虫在HIV/AIDS人群中的感染率呈上升趋势,是HIV/AIDS人群中感染率最高的致病性肠道原虫之一(Loetal.,2014;管悦等,2015),也是导致患者长期性腹泻的主要病原体。由溶组织内阿米巴原虫引起的侵袭性阿米巴病是全球寄生虫感染相关死亡的主要来源,每年造成40 600~73 800人死亡(Lozanoetal.,2012),在我国溶组织内阿米巴原虫感染仍是重要的公共卫生问题。目前,溶组织内阿米巴病的诊断在国内外均主要依靠涂片镜检法(Stanleyetal., 2003;邓爽等,2018),但形态学镜检依赖检验者的丰富经验,且形态学无法区分致病性溶组织内阿米巴原虫E.histolytica和非致病性迪斯帕内阿米巴原虫Entamoebadispar(E.dispar)(Fotedaretal., 2007; McHardyetal., 2014);免疫学ELISA方法简单快速,但有些检测试剂不能准确区分E.histolytica和E.dispar,且目前国内尚无商品化ELISA试剂盒,只能从国外购买、价格昂贵;PCR方法简单快速,敏感性和特异性高,能够区分E.histolytica和E.dispar,可有效对感染虫体量较少的腹泻患者进行辅助诊断,国内外学者评估报道了普通PCR法(庞华胜等,2019)和巢式PCR法(Shahrametal.,2006; 卢艳等,2016)在检测溶组织内阿米巴原虫感染中的应用,但使用Real-Time PCR方法的研究较少。本研究建立了可特异扩增溶组织内阿米巴原虫小亚基核糖体RNA(small subunit ribosome RNA,SSU rRNA)基因的Real-Time PCR方法,同时评价该方法在临床粪便标本中检测溶组织内阿米巴原虫的应用价值。
1 材料与方法
1.1 材料
标本:收集腹泻患者的稀便或水样便标本共221例,其中华西医院收集成人标本112例(女58例,男54例,年龄18~57岁),成都市妇女儿童医院收集儿童标本109例(女50例,男59例,年龄3月~5岁)。每份标本均及时进行生理盐水涂片镜检(碘染法)、ELISA法抗原检测和粪便DNA提取。试剂: ELISA法检测使用TECHLAB第2代溶组织内阿米巴原虫特异性抗原检测试剂盒(Alere公司),检测粪便样本中E.histolytica的半乳糖/N2乙酰氨基半乳糖胺(Gal/GalNAc)粘附凝集素抗原;粪便DNA提取使用Feces Fast DNA Spin Kit试剂盒(MP Biomedicals公司)。溶组织内阿米巴原虫DNA:标准株(HM-1:IMSS)基因组DNA(ATCC30459D),质量浓度为50 ng/μL。
1.2 溶组织内阿米巴原虫的扩增引物
在NCBI网站(https://www.ncbi.nlm.nih.gov/)查找溶组织内阿米巴原虫基因组DNA,欲扩增的目的片段为溶组织内阿米巴原虫小亚基核糖体RNA(small subunit ribosome RNA,SSU rRNA)基因(GenBank登录号X64142.1),根据课题组前期的普通PCR结果(庞华胜等,2019),选出表现较好且能特异性区分E.histolytica和E.dispar的两对引物(Eh-239f/Eh-88 r和Eh-60f/Eh-60 r),进行Real-Time(SYBR)PCR扩增;设计taqman探针,用于Real-Time(taqman)PCR扩增。引物、SYBR和Taqman探针均由成都擎科梓熙(TSINGKE)生物技术有限公司合成。引物序列详见表1,其中1对引物为自行设计,1对引物来自参考文献。
1.3 溶组织内阿米巴原虫标准株DNA的Real-Time PCR扩增
课题组前期的普通PCR扩增中,使用上述两对引物(Eh-239f/Eh-88 r,Eh-60f/Eh-60 r)时模板DNA的最低检测限分别为5 fg/uL和0.5 fg/μL,理论上Real-Time PCR的检测灵敏度高于普通PCR,因此Real-Time PCR扩增时将DNA模板从5 fg/μL浓度开始继续进行稀释(表2)。Real-Time(SYBR)PCR扩增:以原始模板DNA浓度即50 ng/μL及稀释后不同浓度的溶组织内阿米巴原虫标准株DNA为模板(表2),采用表1中的2对引物进行Real-Time(SYBR)PCR扩增。反应体系为20 μL,反应条件为95 ℃预变性1 min,然后95 ℃变性10 s,T℃退火15 s (T退火温度见表1),共40个循环,每个循环于退火温度处采集荧光信号。Real-Time(Taqman)PCR扩增:以原始模板DNA浓度即50 ng/uL及稀释后不同浓度的溶组织内阿米巴原虫标准株DNA为模板(表2),采用表1中的2对引物,同时设计并合成相应的Taqman探针,进行Real-Time(Taqman)PCR扩增。反应体系和反应条件同Real-Time(SYBR)PCR扩增方法。

表1 两对溶组织内阿米巴原虫特异性引物序列Tab.1 Specific primers for Entamoeba histolytica

表2 溶组织内阿米巴原虫标准株DNA的稀释倍数及浓度Tab.2 The series of diluted concentration of E. histolytica for PCR
1.4 不同方法检测临床粪便标本(以临床诊断为判断阳性的依据)
生理盐水涂片镜检(碘染法):严格按《全国临床检验操作规程》(第4版)的相关要求进行操作,显微镜下查找有无阿米巴原虫包囊或滋养体。ELISA抗原检测:操作步骤按照试剂盒说明书进行。实验有效性判定:阴性对照A值<0.15,阳性对照A值-阴性对照A值≥0.5证明实验结果有效。阳性样本判定:测试样本A值-阴性对照A值≥0.5时判定为阳性,否则为阴性。DNA提取:操作方法按照试剂盒说明书进行,提取后的DNA置-20 ℃保存备用。Real-Time PCR扩增:以提取的样本DNA为模板,分别进行Real-Time(SYBR)PCR和Real-Time(Taqman)PCR。PCR反应体系和扩增条件同1.3。
1.5 统计学方法
采用SPSS 18.0软件进行统计分析,对3种检测方法的检测结果一致性进行Kappa检验,并用McNemar检验观察3种方法检测结果有无差异,P<0.05为差异有统计学意义。
2 结果
2.1 溶组织内阿米巴原虫标准株DNA的Real-Time PCR扩增
Real-Time (SYBR) PCR扩增:以原始DNA浓度为模板,使用表1中的引物(Eh-239f/Eh-88r,Eh-60f/Eh-60r)进行Real-Time (SYBR) PCR扩增,均得到阳性结果。以不同稀释倍数的DNA为模板(表2)进行Real-Time (SYBR) PCR扩增,结果见图1。使用两对引物扩增时,模板DNA的最低检测限均为0.5 fg/μL。
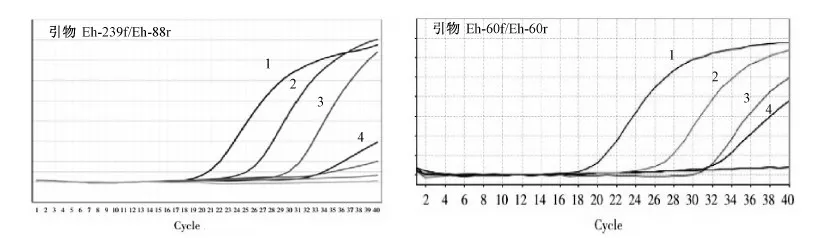
图1 引物Eh-239f/Eh-88r和引物Eh-60f/Eh-60r的Real-Time (SYBR) PCRFig.1 Real-Time (SYBR) PCR with primer Eh-239f/Eh-88 r and Eh-60f/Eh-60 r1-4: 溶组织内阿米巴原虫标准株DNA模板稀释后的浓度50, 5, 1, 0.5 fg/μL。下同。1-4: DNA concentration of Entamoeba histolytica DNA after series of dilution with 50, 5, 1, 0.5 fg/μL, and the same below.
Real-Time (taqman) PCR扩增:以原始DNA浓度为模板,使用表1中的引物(Eh-239f/Eh-88r,Eh-60f/Eh-60r)进行Real-Time (taqman) PCR扩增,均得到阳性结果。以不同稀释倍数的DNA为模板(表2)进行Real-Time (taqman) PCR扩增,结果见图2。使用两对引物扩增时,模板DNA的最低检测限均为0.5 fg/μL。
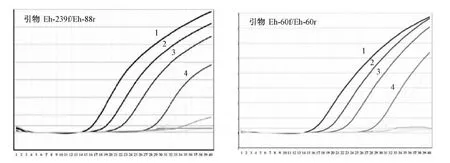
图2 引物Eh-239f/Eh-88r和引物Eh-60f/Eh-60r的Real-Time (taqman) PCR方法Fig.2 Real-Time (Taqman) PCR with primer Eh-239f/Eh-88 r and Eh-60f/Eh-60 r
2.2 不同方法检测临床粪便标本的结果比较
本研究共221例粪便标本中,湿片生理盐水涂片镜检法(碘染法)检出2例阿米巴原虫包囊(2/221),均为成年患者,检出率0.90%;ELISA法检测溶组织内阿米巴原虫抗原,检出21例阳性(21/221),其中12例成人标本,9例儿童标本,阳性检出率9.50%;两种Real-Time PCR方法均检出5例阳性(5/221),阳性检出率2.26%(表3)。
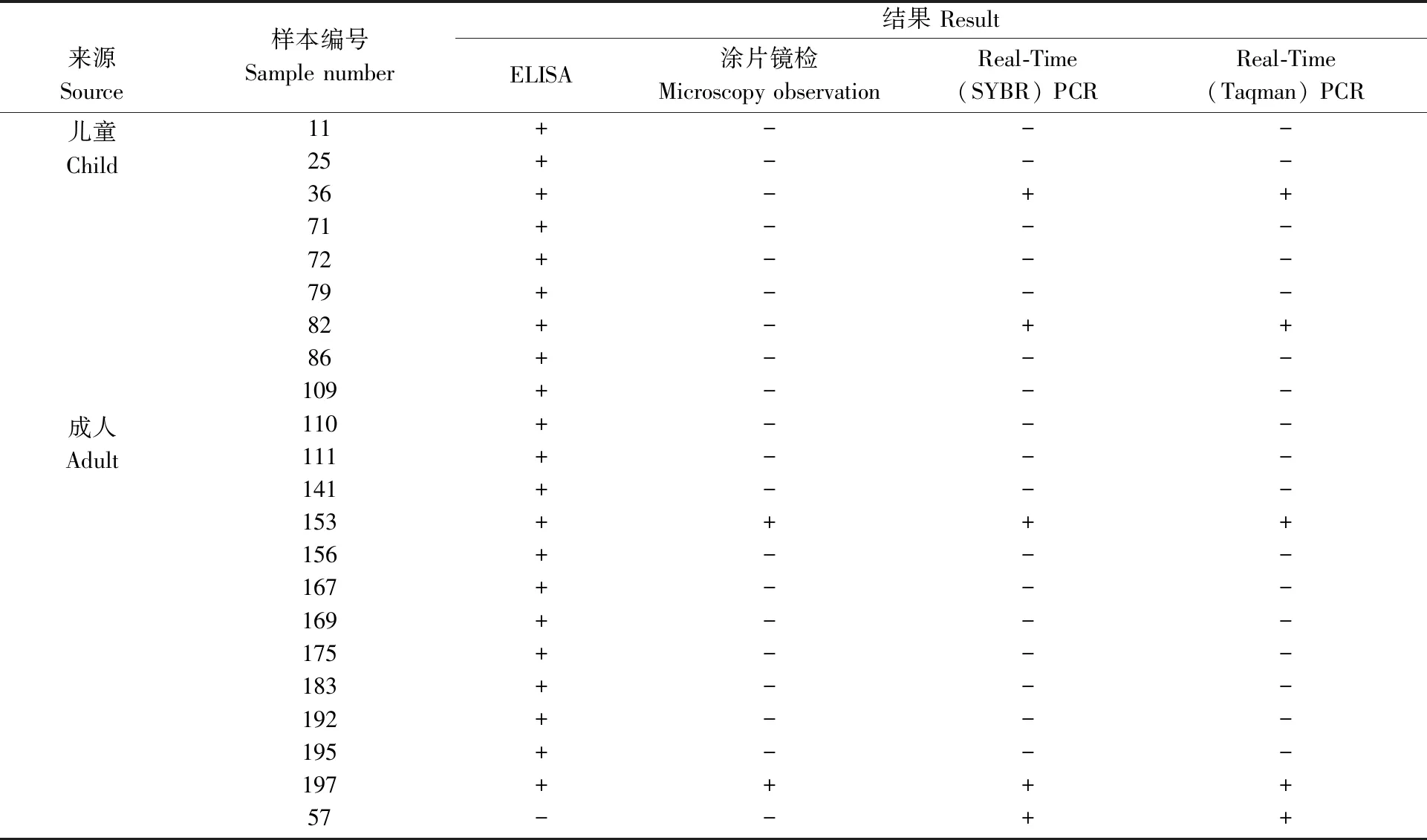
表3 镜检法、ELISA法、Real-Time PCR法检测阳性的标本及结果Tab.3 The results of microscopy, ELISA and Real-Time PCR
Real-Time (SYBR) PCR和Real-Time (taqman) PCR方法检测结果完全一致,且临床表现和诊断支持溶组织内阿米巴原虫感染。Real-Time PCR法检出阳性的5例标本中,2例镜检法和ELISA法的结果均为阳性(153、197号标本),2例镜检阴性而ELISA法阳性(36、82号标本),1例镜检法和ELISA法均为阴性(57号标本)。三种方法的检测结果一致性比较见表4。
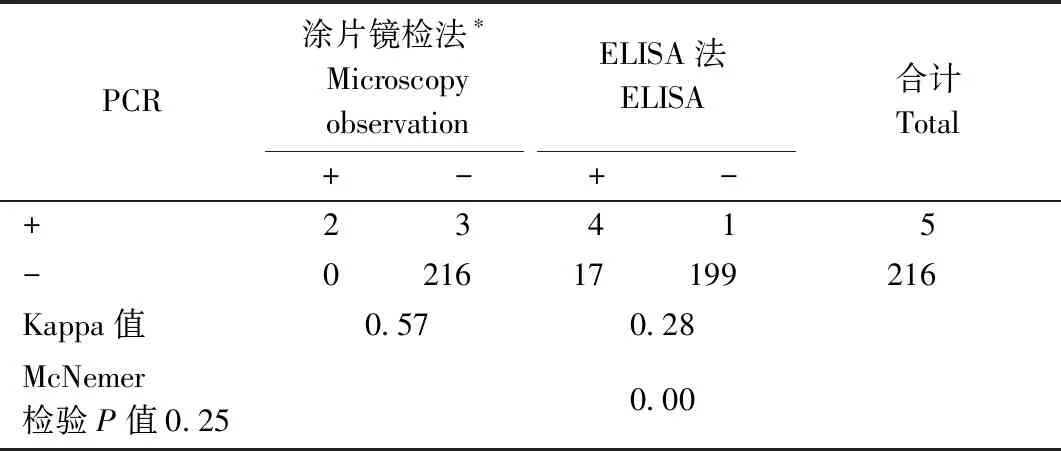
表4 镜检法、ELISA法、Real-Time PCR检测法的比较Tab.4 Comparison of microscopy observations, ELISA and PCR methods
3 讨论
溶组织内阿米巴原虫为内阿米巴科的内阿米巴属原虫,是唯一具有致病性的内阿米巴原虫,可引起肠阿米巴病(如阿米巴痢疾)和肠外阿米巴病(如阿米巴肝脓肿),是导致患者腹泻的主要病原体之一,目前溶组织内阿米巴原虫感染仍是重要的公共卫生问题。而内阿米巴属中的非致病性阿米巴—迪斯帕内阿米巴E.dispar的遗传背景、原虫形态和宿主与溶组织内阿米巴原虫高度相似(Fotedaretal.,2007)。为避免过度诊断和过度治疗,快速准确的对病原体进行鉴定尤为重要。
溶组织内阿米巴原虫感染的实验室检查主要包括病原学方法、免疫学方法和分子生物学方法。显微镜涂片检查是常用的病原学诊断方法,也往往是诊断的依据,但该方法耗时长、敏感性较低,容易漏检,而且无法将包囊和滋养体形态极为相似的致病性的E.histolytica与非致病性E.dispar区分(Stanleyetal., 2003)。因此,为正确区别E.histolytica和E.dispar,本研究建立了可特异扩增溶组织内阿米巴原虫SSU rRNA的Real-Time PCR方法,并收集221例腹泻患者的粪便标本,对该方法在临床粪便标本中检测溶组织内阿米巴原虫的应用价值进行了初步评价。
本研究中,涂片镜检法共检出两例阿米巴原虫包囊,检出率为0.90%,由于阳性数量较少,与其他文献报道的感染率可比性较差。
免疫学方法简单快速,理论上可区别E.histolytica和E.dispar,但目前国内尚无成熟的商品化ELISA试剂盒可供使用。本研究使用从国外购买的ELISA试剂盒检测溶组织内阿米巴原虫特异性抗原,检出21例阳性,阳性率为9.50%,检出率与镜检法、PCR法差异较大。该类试剂盒已在国内外不同的实验室中使用多年,用于检测世界范围流行地区或非流行地区的溶组织内阿米巴原虫。在国内研究中,孙晓东等(2006)使用TechLab II溶组织内阿米巴原虫ELISA试剂盒检测云南省某地的E.h,检出率为9.29%,与本研究检出率相似。刘慧等(2008)报道ELISA法对云南省普洱市某爱尼族村寨常住居民的粪便中溶组织内阿米巴原虫感染的检测阳性率为12.23%,与PCR法检测的符合率为77.36%,符合率高于本研究结果。国外研究中,有报道(Shahrametal.,2006)显示该试剂盒在溶组织内阿米巴原虫高度流行国家的检测灵敏度达到95%至100%,但与PCR方法比较,TechLab II试剂盒的检测灵敏度较低(Starketal.,2008)。一项在厄瓜多尔北部溶组织内阿米巴原虫高度流行地区进行的研究显示(Gattietal.,2002),TechLab II试剂盒的表现不佳(灵敏度为14.3%,特异性为98.4%)。也有研究报道在溶组织内阿米巴原虫感染低流行地区,TechLab II试剂盒的检测灵敏度较低(Goninetal.,2003)。TechLab II试剂盒在不同流行地区和不同研究中检测的敏感性差别大,可能与溶组织阿米巴原虫不同的生活阶段中的抗原有关,TechLab II试剂盒只能识别急性阿米巴原虫感染导致的腹泻粪便样本中的滋养体,而不能识别包囊阶段的寄生虫(Gattietal.,2002; Starketal.,2008)。由于国外的试剂盒在不同流行地区检测的灵敏度和特异性差异较大,在应用于国内临床检验方面还需进一步评估。
随着分子生物学技术的发展,PCR技术逐渐应用到溶组织内阿米巴原虫感染的临床诊断(卢艳等,2016),该方法灵敏度和特异度高,广泛应用于病原检测和鉴定。本研究采用Real-Time (SYBR) PCR和Real-Time (taqman) PCR技术均检出5例阳性标本,临床表现和诊断均支持溶组织内阿米巴原虫感染。其中2例镜检和ELISA法均阳性,2例镜检阴性而ELISA法阳性,1例镜检和ELISA法均阴性。PCR阴性而ELISA阳性的17例病例中,6例为住院病人,诊疗记录不支持溶组织内阿米巴原虫感染的诊断。我们同时重新设计E.dispar的特异性引物对这17例标本进行PCR扩增,发现2例为E.dispar阳性,提示本研究使用的ELISA检测试剂盒不能准确将致病性E.h和非致病性E.dispar区分,与Visser等和Stark等(2008)的研究结论一致,而本文设计的引物可准确区分E.h和E.dispar。文献报道使用巢式多重PCR也可将E.h和E.dispar进行鉴别和区分(卢艳等,2016; 阚珍珍等,2018)。综合分析,本研究3种检测方法的结果中,PCR法显现出更好的敏感性和特异性,且能够区分E.h与其他内阿米巴原虫如E.dispar。
在溶组织内阿米巴原虫的PCR检测技术中,有两个重要关键步骤,一是粪便标本的核酸提取,本研究使用专门提取粪便DNA的商品化试剂盒,为美国CDC推荐使用。二是选择合适的分子遗传标记,SSU rRNA基因参与编码溶组织内阿米巴原虫核糖体小亚基,是一段高度保守的核苷酸序列,在致病性E.histolytica和非致病性E.dispar之间存在稳定的遗传差异,被广泛用于溶组织内阿米巴原虫的检测和鉴别。本研究基于溶组织内阿米巴原虫SSU rRNA基因设计特异性引物,使用Real-Time (SYBR) PCR和Real-Time (taqman) PCR技术对溶组织内阿米巴原虫标准株DNA系列稀释后进行扩增,检测引物的表现和PCR的灵敏性,成功建立溶组织内阿米巴原虫感染的Real-Time PCR技术,可检测的最低模板DNA浓度为0.5 fg/μL。与普通PCR相比,Real-Time PCR是在PCR反应体系中,加入过量SYBR 荧光染料或Taqman探针,实现荧光信号的增加与PCR产物的增加完全同步,操作简单,灵敏度高,特异性好,可进行高通量大规模实时检测,减少了普通PCR对终产物进行电泳的步骤。Real-Time (SYBR) PCR通用性好,不需要设计探针,省时简便,价格低廉;Real-Time (Taqman) PCR结果稳定重复性好,可进行多重扩增,但需要设计合成特异性探针,检测成本稍高,临床实验室可根据本地溶组织内阿米巴原虫流行情况及实验室设备进行选择应用。
本研究结果显示,采用镜检法检测溶组织内阿米巴原虫滋养体或包囊操作简单,但灵敏性最低,主观性强,需要经验丰富的临床检验人员进行观察;ELISA方法快速便捷,但目前尚无可用的国产商品化试剂盒,国外试剂盒的临床应用价值尚需进一步评估;PCR方法检测灵敏度高,模板DNA浓度要求低,可以准确区分形态学上非常相似的致病性E.histolytica和非致病性E.dispar,可对临床可疑的溶组织内阿米巴原虫感染进行快速准确的检测,减少或避免临床漏诊,对临床指导及流行病学调查具有重要的意义。但要将Real-Time PCR方法作为成熟的临床诊断方法并对临床标本进行定量检测还需要进一步研究标准曲线和内参设置等问题,内参设置需要筛选稳定可靠的溶组织内阿米巴原虫管家基因,目前还未相关PCR定量检测的文献报道。另外本研究还需扩大临床样本进行验证,为建立成熟完善的临床溶组织内阿米巴原虫感染的Real-Time PCR检测方法提供可靠的理论和实验基础,为临床检测其他致腹泻原虫的分子生物学检测方法提供参考。

