2 株鸡传染性支气管炎病毒的分离鉴定及S1 基因遗传分析
施丽薇,高新乐,承 南,董彦鹏
(江苏南农高科技股份有限公司,江苏江阴214400)
鸡传染性支气管炎(infectious bronchitis,IB)是由冠状病毒科、冠状病毒属的传染性支气管炎病毒(infectious bronchitis virus,IBV)引起的鸡的一种急性高度接触性传染病。鸡通过吸入病毒或直接接触污染物而感染,发病率通常为100%,表现为急性上呼吸道症状、产蛋数量和质量下降、肾炎等症状,严重影响养鸡业的发展[1]。IBV是单股正链RNA 病毒,编码的蛋白主要有S 蛋白(spike glycoprotein)、M蛋白、N蛋白等。其中S蛋白为纤突蛋白,可裂解为S1 和S2 亚基[2]。S1 亚基携带受体结合位点,影响病毒的组织嗜性[3]。S1 是中和性抗体和特异性抗体的主要诱导剂,在保护性免疫中也发挥着重要作用[4-5]。此外,S1 是IBV 中最易变异的基因,这种变异可能导致毒株间存在重要的生物学差异,因此常用该基因序列确定病毒基因型[6]。
IBV病毒基因组在复制过程中极易发生基因突变、缺失、插入及重组等,使IBV不断发生变异,不同血清型之间交叉保护性较低[7]。研究显示,我国目前流行的主要基因型为QX型,且毒株间重组现象非常普遍,促进病毒进化及新基因亚群的出现[8]。本研究于2020年6月从疑似发病鸡场的病死鸡体内分离到2株IBV毒株,对其S1基因进行遗传分析及核苷酸同源性分析,以了解IBV 遗传进化情况,为IBV的监测与防控提供参考。
1 材料与方法
1.1 试验材料
1.1.1 病料来源
样品采自安徽蚌埠某蛋鸡养殖场送检的疑似感染传染性支气管炎的病死鸡。
1.1.2 鸡胚及试剂
试验所用SPF鸡胚购自济南斯帕法斯家禽有限公司。
HiScript Q RT SuperMix for qPCR(R122-01)购自南京诺唯赞生物科技股份有限公司;remix Taq™(TaKaRa Taq™Version 2.0 plus dye)(RR901A)、DL2000 DNA Marker(3427A)购自宝日医生物技术(北京)有限公司;Z-10 Spin Column Viral Total RNA Extraction Kit(B158667)、Ezup Column Virus DNA Purification Kit(B518267)购自生工生物工程(上海)股份有限公司。
1.1.3 引物合成
传染性支气管炎病毒、H9亚型禽流感病毒、H5亚型禽流感病毒、新城疫病毒、传染性法氏囊病病毒、马立克病毒、禽白血病病毒、呼肠孤病毒、减蛋综合征病毒引物由上海生工生物工程有限公司合成。PCR 扩增引物序列见表1。
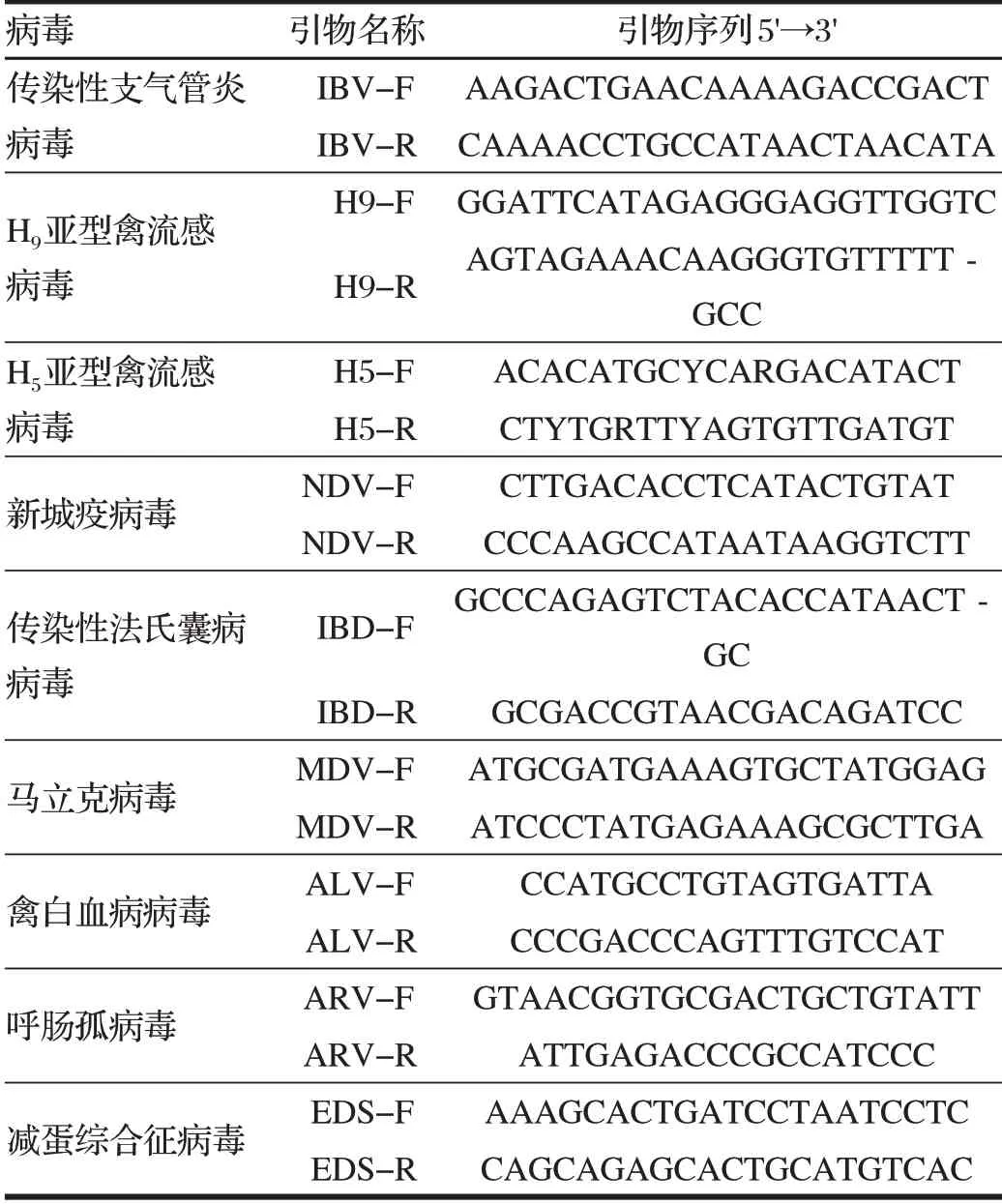
表1 PCR扩增引物序列Tab.1 Sequence of PCR amplification primer
1.2 试验方法
1.2.1 病毒分离
采集气管、心、肝、脾、肺、肾、法氏囊,按1∶5的比例加入灭菌PBS(pH 值7.2),经研磨处理,反复冻融3 次后8000 r/min离心5 min后取上清,经0.22 μm无菌滤器过滤除菌。将上述组织上清液经绒毛尿囊腔途径接种10日龄SPF 鸡胚,0.2 mL/胚,弃去24 h 内死亡鸡胚,48~72 h 收取鸡胚尿囊液继续接胚,盲传3 代,收集尿囊液,保存于-80 ℃备用。
1.2.2 PCR鉴定
提取盲传后第3 代鸡胚尿囊液DNA 和RNA,将RNA并进行反转录。将获得的DNA 和cDNA 为模板进行PCR扩增。体系为25 μL:Premix Taq 12.5 μL、模板2 μL、上下游引物各1 μL、添加ddH2O 至总体积为25 μL。PCR 反应条件为:94 ℃、5 min;94 ℃、35 s,54 ℃、35 s,72 ℃、50 s,循环30次;72 ℃、10 min,4 ℃保存。PCR产物经琼脂糖凝胶电泳,在紫外灯下切胶回收并送测。
1.2.3 序列测定与分析
对获得的序列进行分析,从GeneBank 中下载IBV 各分支的S1基因序列作为本研究的参考。利用MEGA X软件通过Clustal W进行序列比对,通过Neighbour-Joining法进行进化树绘制;利用MegAlign 对分离株和各参考株的S1基因进行核苷酸同源性分析。
1.2.4 分离毒株EID50的测定
用灭菌PBS连续10倍倍比稀释分离毒株鸡胚尿囊液,每个稀释度接种5枚10日龄鸡胚,置于37 ℃孵化箱培养,弃去24 h 内死亡鸡胚。144 h 取出鸡胚观察IBV 典型病变,表现为鸡胚卷曲,发育不良,用Reed-Muench 法[9]计算EID50。
1.2.5 致鸡胚矮小化试验
将病毒尿囊液经尿囊腔接种5 枚10 日龄SPF 鸡胚,0.1 mL/枚,并设置阴性对照组。对照组接种同样剂量生理盐水。将鸡胚在37 ℃培养144 h,弃去24 h 内死亡鸡胚,144 h 打开鸡胚观察胚体病变并称重,经GraphPad Prism8计算体重平均值及差异。
2 结果与分析
2.1 病毒的分离与鉴定(见图1)
由图1 可知,用不同病毒的特异性引物对第3 代鸡胚尿囊液进行PCR 检测,结果仅IBV 为阳性,显示大小约为1700 bp的条带,其他病毒引物PCR结果均为阴性,表明鸡胚尿囊液中存在IBV。经测序确定毒株序列,共分离到2株IBV,分别命名为AH01/2020和AH02/2020。
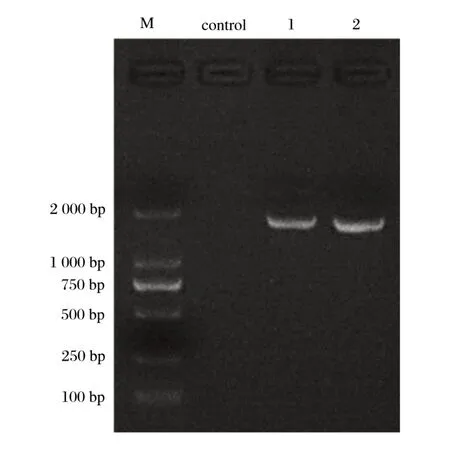
图1 IBV分离株S1基因的PCR鉴定结果Fig.1 PCR identification of S1 gene of IBV
2.2 病毒S1基因的遗传进化分析(见图2、图3)
由图2、图3可知,将IBV 分离株与GenBank 上的参考毒株S1 基因进行序列比对并绘制系统进化树,可知分离株AH01/2020 为LSC/99I 型,AH02/2020 为QX 型。AH01/2020、AH02/2020 与参考株S1 基因的核苷酸相似性分别为76.7%~97.8%和78.1%~90.9%。2 株分离毒株与常用疫苗株H120、H52、M41、4/91、W93 的同源性普遍偏低,分 别 为 76.7%~78.3%、76.8%~78.1%、76.8%~78.6%、77.6%~79.4%以及77.1%~78.6%,表明使用传统疫苗免疫并不能完全保护鸡免于病毒感染。
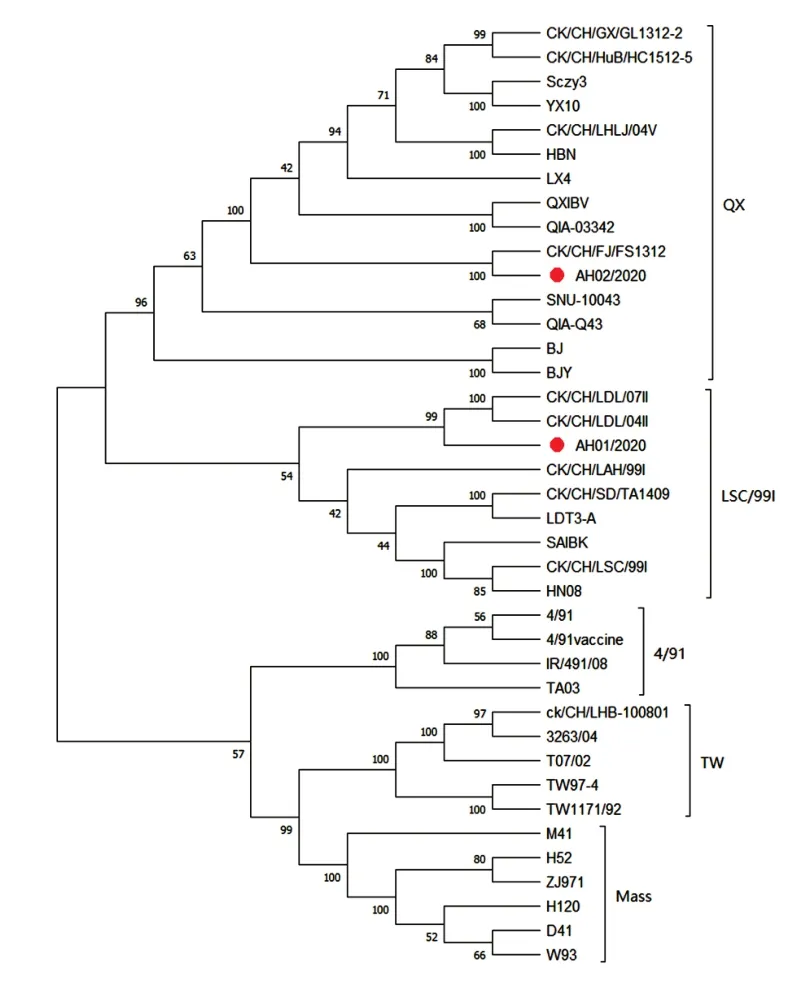
图2 基于IBV S1基因序列的系统进化树Fig.2 Phylogenetic tree based on IBV S1 gene sequence
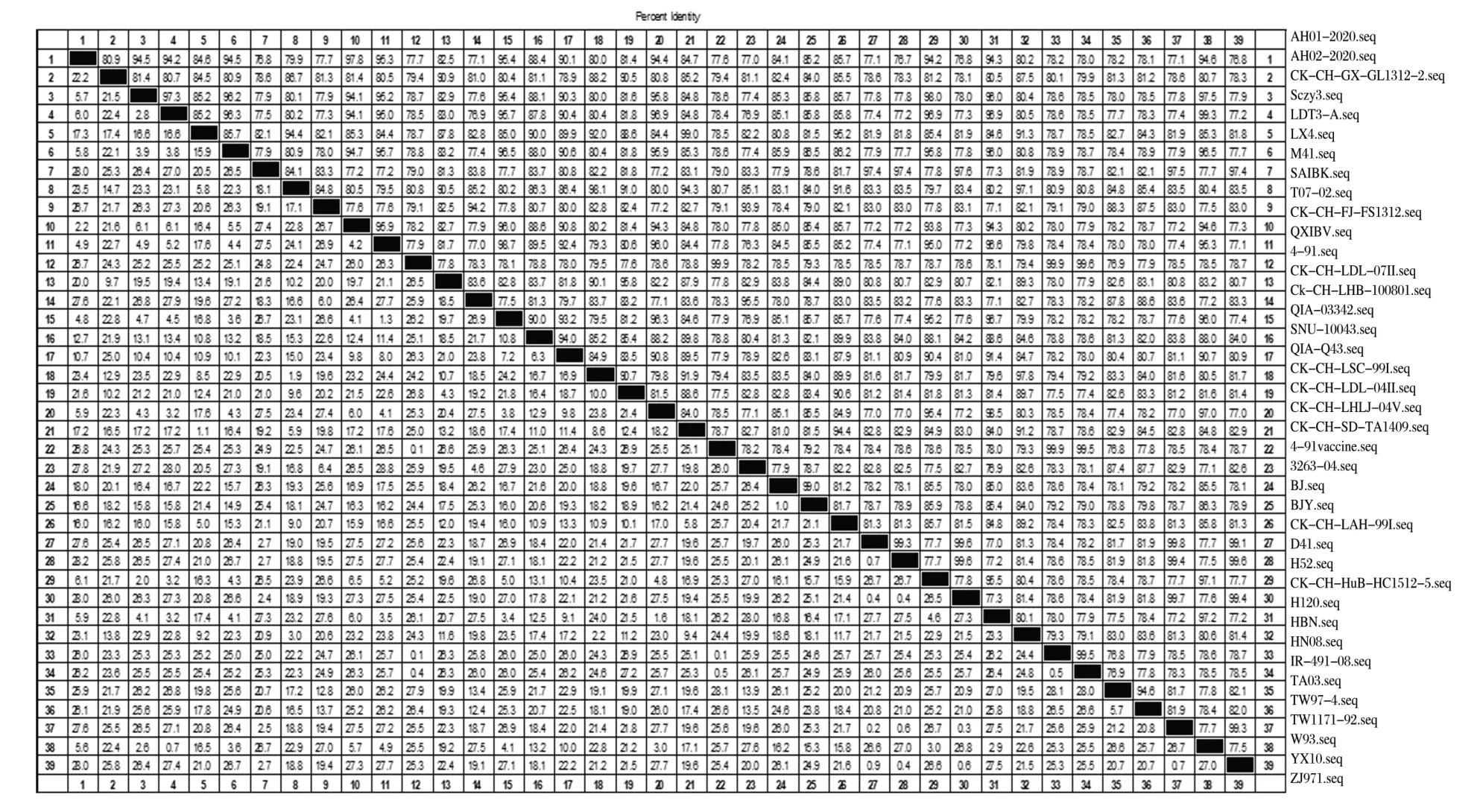
图3 基于IBV S1基因的核苷酸同源性分析Fig.3 Analysis of nucleotide homology based on IBV S1 gene
2.3 病毒对鸡胚的致病力(见图4、图5)
由图4、图5 可知,根据胚体病变情况计算可得AH01/2020 株EID50为106.17/mL,AH02/2020 株EID50为1010.67/mL。将2株IBV分别感染SPF鸡胚,144 h后可见胚体蜷缩、出血、发育不良等,呈卷曲胚胎,符合IBV 致鸡胚病变的表现,感染鸡胚病变极其明显,而对照胚体无肉眼可见病变。与正常鸡胚相比,2 株IBV 感染鸡胚体重下降均极显著(P<0.01)。
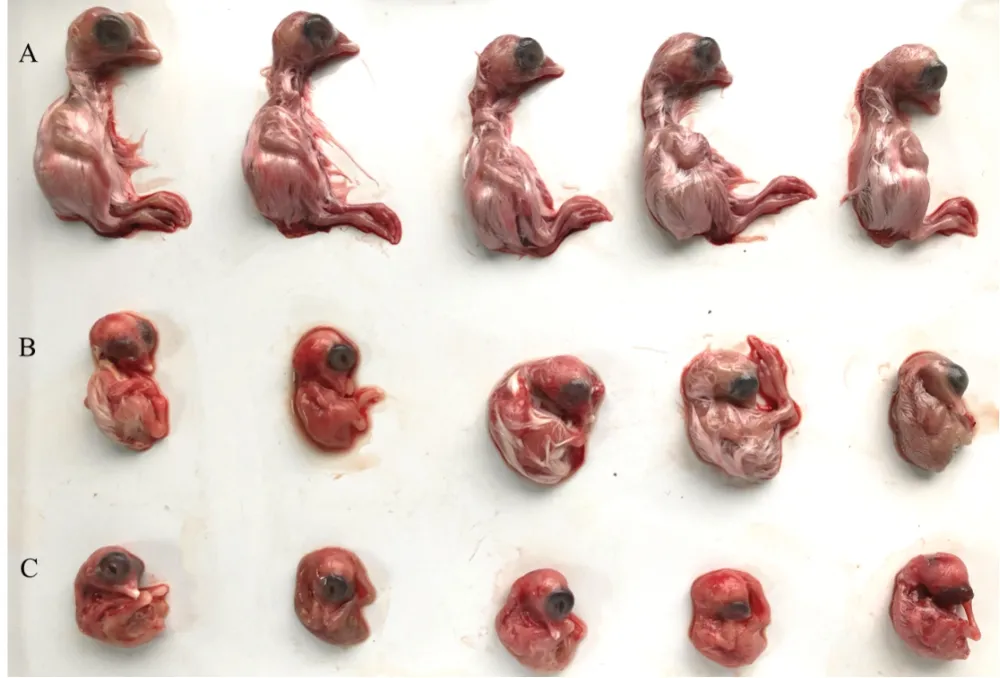
图4 IBV毒株致鸡胚病变Fig.4 Embryo lesions caused by IBV
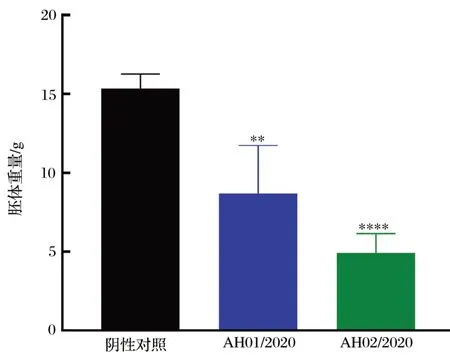
图5 鸡胚胚体重量比较Fig.5 Weight compare of embryo
3 讨论
传染性支气管炎呈世界性分布,可感染所有日龄的鸡。感染鸡生长缓慢、死淘率增加,给养鸡业造成巨大经济损失[10]。该病目前没有特异性治疗方法,主要通过改善饲养管理条件和疫苗接种来预防。理想的管理方法包括严格隔离、注重生物安全、减小饲养密度、消除冷应激、保证良好的通风等[11]。疫苗接种包括活疫苗和灭活疫苗[12],目前我国主要应用H120、H52、M41 等毒株制备弱毒疫苗和活疫苗,以上毒株均属于Mass型。但IBV突变率高,主要是由于该病毒特有的套氏转录方式及病毒RNA酶缺乏校正能力,还有自然选择、免疫压力等外在因素影响。此外,IBV血清型众多,交叉保护能力较差[13],常与其他病毒、细菌混合感染鸡群[14-16],且有研究显示,近年来QX型IBV占据了优势流行地位[17-19],这些因素给疫苗防控带来了巨大挑战。
为进一步了解我国IBV毒株的遗传变异情况,本试验从安徽某蛋鸡养殖场病死鸡中分离到两株病毒,接种鸡胚可产生典型IBV 病变,经PCR 鉴定证实所分离的病毒为IBV。将分离的2株IBV毒株的S1基因与从GenBank下载的参考株进行序列比对,显示2株病毒分属于LSC/99Ⅰ型和QX 型,符合近年来QX 型为主要流行基因型的研究结果,LSC/99I型的流行也需进一步进行监测,同时应关注不同基因型IBV 混合感染的情况。2 株IBV 与疫苗株S1 基因的核苷酸同源性偏低,可能是由于长期使用活疫苗形成的免疫选择压导致。这种免疫选择压易导致野生毒株发生基因突变、重组等情况,从而产生新型野毒,使传统疫苗的保护力下降[20]。因此,盲目使用IBV疫苗可能会导致新型变异毒株出现,需对IBV 进行持续的流行病学监测,尤其应注意多种基因型IBV 混合感染、共同流行的情况,为IBV防控和新疫苗开发提供参考。
4 结论
本试验从蛋鸡养殖场病死鸡体内分离到2 株病毒,经鸡胚接种、序列比对和进化树绘制,可知2株病毒均可导致鸡胚出现IBV 特征性病变,根据进化树分析2 株病毒分属于LSC/99I 和QX 分支,确定本次分离毒株为鸡传染性支气管炎病毒。

