八角幼苗对三种环境因子的生理响应
黄建辉,王凌晖,滕丽琨,何 江,覃贵毕,梁武斌
(1.广西大学 林学院,广西南宁 530004;2.广西林业集团桂钦林浆纸有限公司,广西南宁 530023;3.广西国有六万林场,广西玉林 537000)
植物抗逆性是植物应对环境变化的适应机制[1]。在全球气候变暖的背景下,植物物候发生了不同程度的改变,如春季物候提前、秋季物候推迟等[2-3]。随着极端天气的频发,短时性低温、旱涝等逆境会对植物生长和生产实践产生影响。研究植物在不同逆境下的生理生化变化是了解植物抗逆性的重要途径,是植物引种驯化和栽培管理的科学依据,对实现农林作物的可持续经营有指导意义。
温度、光照和水分是植物生长和发育的重要环境因子,这些环境因子在植物生长、生产及适宜性分布等方面发挥着不同作用[4]。低温会引起植物胞内结冰或细胞间隙结冰,导致原生质凝固变性,也会使细胞内膜破裂影响细胞器结构和功能[5-6]。植物可通过冷驯化来提高抗寒性,如油菜(Brassica na⁃pus)种子[7]和茶树(Camellia sinensis)[8]经过短期冷驯,恢复后植物抗寒性高于未经冷驯的植物。前人大多通过测定生理指标并用隶属函数法[9]或主成分分析法[10]进行抗寒性综合评价。光照影响植株正常生长发育、结构特征、光合作用和休眠等[11],牛欢等[12]对金线莲(Anoectochilus roxburghii)的研究表明,光照是影响和调控金线莲产量构成的核心因子,不同的光照度对其叶绿素含量、根系生长与物质积累有不同的作用。土壤中的水分影响植物生长发育以及其对土壤养分的迁移和吸收[13]。杨顺强等[14]从猫尾草(Phleum pratense)等8 种牧草的抗旱性评价中得出,脯氨酸等渗透调节物质是主要的抗旱指标,叶绿素含量所占的权重较小。在夏腊梅(Sinoca⁃lycanthus chinensis)[15]和狭叶红景天(Rhodiola kirilowii)[16]的抗旱性研究中发现,保护酶活性和丙二醛(MDA)含量之间存在极大的相关性。
八角(Illicium verum)是木兰科(Magnoliaceae)八角属植物,是我国南亚热带重要的“药食同源”的经济树种,主要分布在我国广西、云南和广东等省(自治区)[17]。八角果实和提取物茴香油被广泛应用于食品、医药和香料等方面[18-21]。目前,国内外对于八角的研究主要集中在化学成分[17-19]、医药应用[20-21]、栽培管理[22-23]与病虫害防治[24]等方面,关于八角对环境因子生理响应的研究少有报道。前人对环境因子与植物抗逆性的研究多数是对单一环境因子的讨论,涉及不同因子间交互作用影响的研究较少[25-28]。本研究以八角幼苗为对象,讨论温度、光照和土壤相对含水量对八角幼苗生理的影响,可为八角幼苗栽培管理及环境适应性等方面的研究提供参考。
1 材料与方法
1.1 试验地概况
试验地位于广西大学林学院(108°17'E,22°51'N),属亚热带季风气候,年均气温21.7 ℃,年均降水量1 300 mm,年均日照时长1 827 h,光热充足,雨热同期,适合八角幼苗生长。
1.2 试验材料
八角幼苗由广西壮族自治区林业科学研究院提供,为长势一致且无病虫害的幼苗,苗高15 ~20 cm,地径2 ~5 mm。土壤取自表层土壤,黄褐色,团粒状。
1.3 试验设计
试验时间为2019年12月,昼夜平均气温为18/12 ℃。试验前将八角幼苗放入8 cm × 10 cm 的育苗杯中进行2 周的缓苗处理,结束后放入可控制温度、光照度的四温区光照培养箱(上海丙林电子科技有限公司MGZ-220L-4)。采用三因素三水平正交试验设计,模拟冬季短时性低温、强弱光和旱涝的极端天气,分别设置了低温0、4 和8 ℃,光照度800、1 600 和5 000 lx,土壤相对含水量90%~95%、50% ~55%和30% ~35%,每处理10 株,重复3 次(表1)。因温度与光照度存在一定的交互影响[25],参照交互效应表,将L9(34)正交试验表的第3 列设置为误差列,用于检验温度与光照度是否存在交互作用。每个处理分别在胁迫0 和3 天时同一时间段取样并测定相关生理指标,取样时以从植株顶芽开始第3 ~8 片功能叶为供试材料,用去离子水洗净,用滤纸吸干水分后,进行不同生理指标测定。

表1 L9(34)正交试验Tab.1 L9(34)orthogonal test
1.4 生理指标测定
叶绿素含量的测定用分光光度法[29],可溶性糖含量的测定用蒽酮比色法[30],可溶性蛋白质含量的测定用考马斯亮蓝法[31],MDA 含量的测定用硫代巴比妥酸比色法[30],游离脯氨酸含量的测定用酸性茚三酮法[32]。
1.5 数据处理
采用Excel 2016 软件进行统计分析及图表的绘制,SPSS 22.0 软件进行单因素方差分析、差异显著性检验和主成成分分析。
2 结果与分析
2.1 极差分析
影响八角幼苗叶绿素含量的环境因子为光照度> 温度> 土壤相对含水量,八角幼苗叶绿素含量在8 ℃(θ3)、1 600 lx(E2)和50% ~55%(W2)土壤相对含水量时含量最高;在4 ℃(θ2)、5 000 lx(E3)和90%~95%(W1)土壤相对含水量时含量最低(表2~3)。影响可溶性糖含量的环境因子为温度>光照度> 土壤相对含水量,可溶性糖含量在0 ℃(θ1)、1 600 lx(E2)和95%~55%(W1)土壤相对含水量时含量最高;在8 ℃(θ3)、5 000 lx(E3)和50% ~55%(W2)土壤相对含水量时含量最低。影响可溶性蛋白含量的环境因子为温度>土壤相对含水量>光照度,可溶性蛋白含量在0 ℃(θ1)、1 600 lx(E2)和30% ~35%(W3)土壤相对含水量时含量最高;在8 ℃(θ3)、800 lx(E1)和50% ~55%(W2)土壤相对含水量时含量最低。影响MDA 含量的环境因子为温度>土壤相对含水量>光照度,MDA含量在0 ℃(θ1)、1 600 lx(E2)和90%~95%(W1)土壤相对含水量时含量最高;在8 ℃(θ3)、5 000 lx(E3)和50% ~55%(W2)土壤相对含水量时含量最低。影响游离脯氨酸含量的环境因子为温度> 土壤相对含水量> 光照度,游离脯氨酸在4 ℃(θ2)、1 600 lx(E2)和90% ~95%(W1)土壤相对含水量时含量最高;含量在0 ℃(θ1)、5 000 lx(E3)和30% ~35%(W3)土壤相对含水量时含量最低。

表2 L9(34)正交试验方案及结果Tab.2 L9(34)orthogonal test plan and results
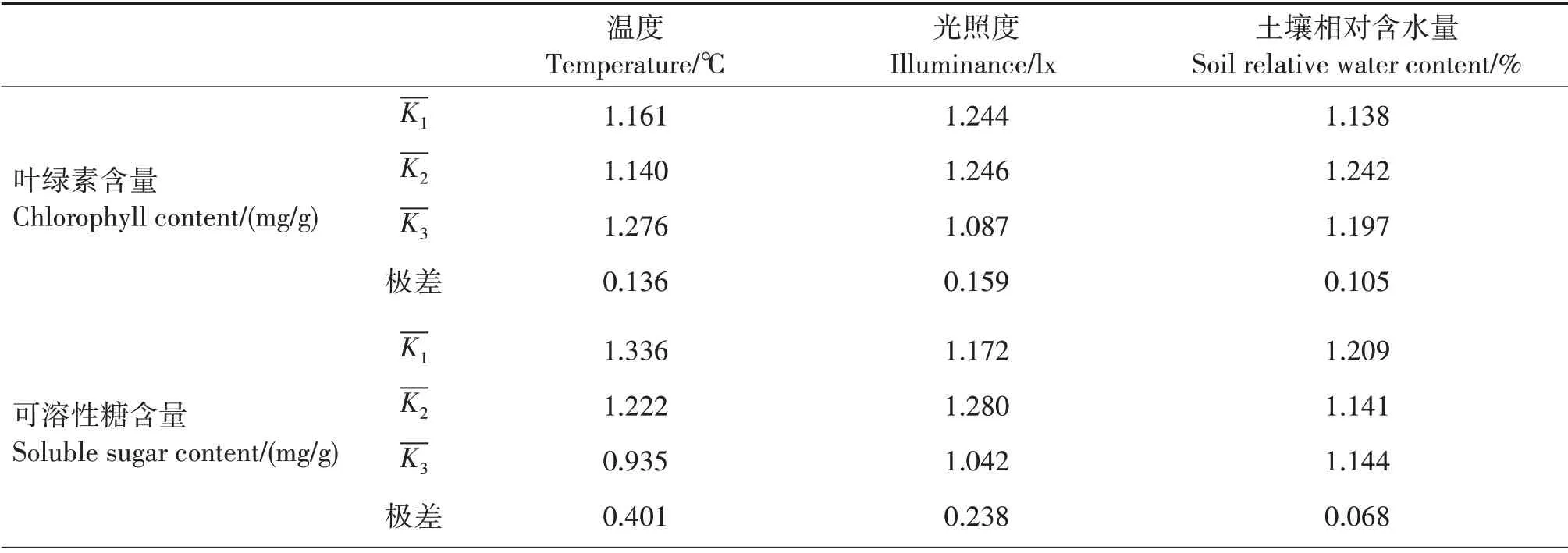
表3 L9(34)正交试验极差分析结果Tab.3 L9(34)orthogonal test range analysis results
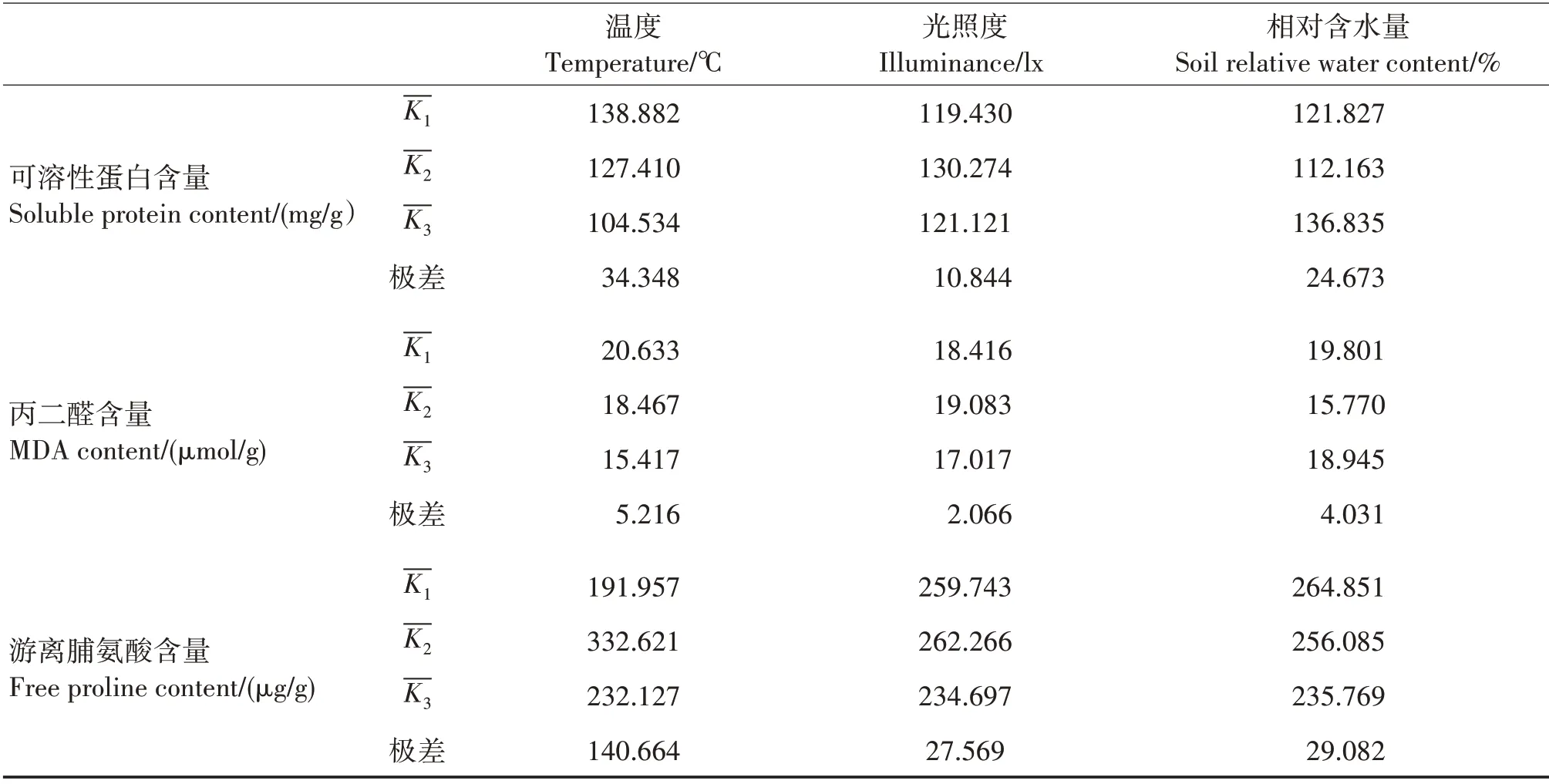
续表3Continued
2.2 方差分析结果
根据方差分析可知,表1中的误差列差异极显著(P<0.01),说明温度与光照度存在极显著的交互效应,因此将误差列更名为温度与光照度的交互作用列,与其他因素一同进行分析(表4)。
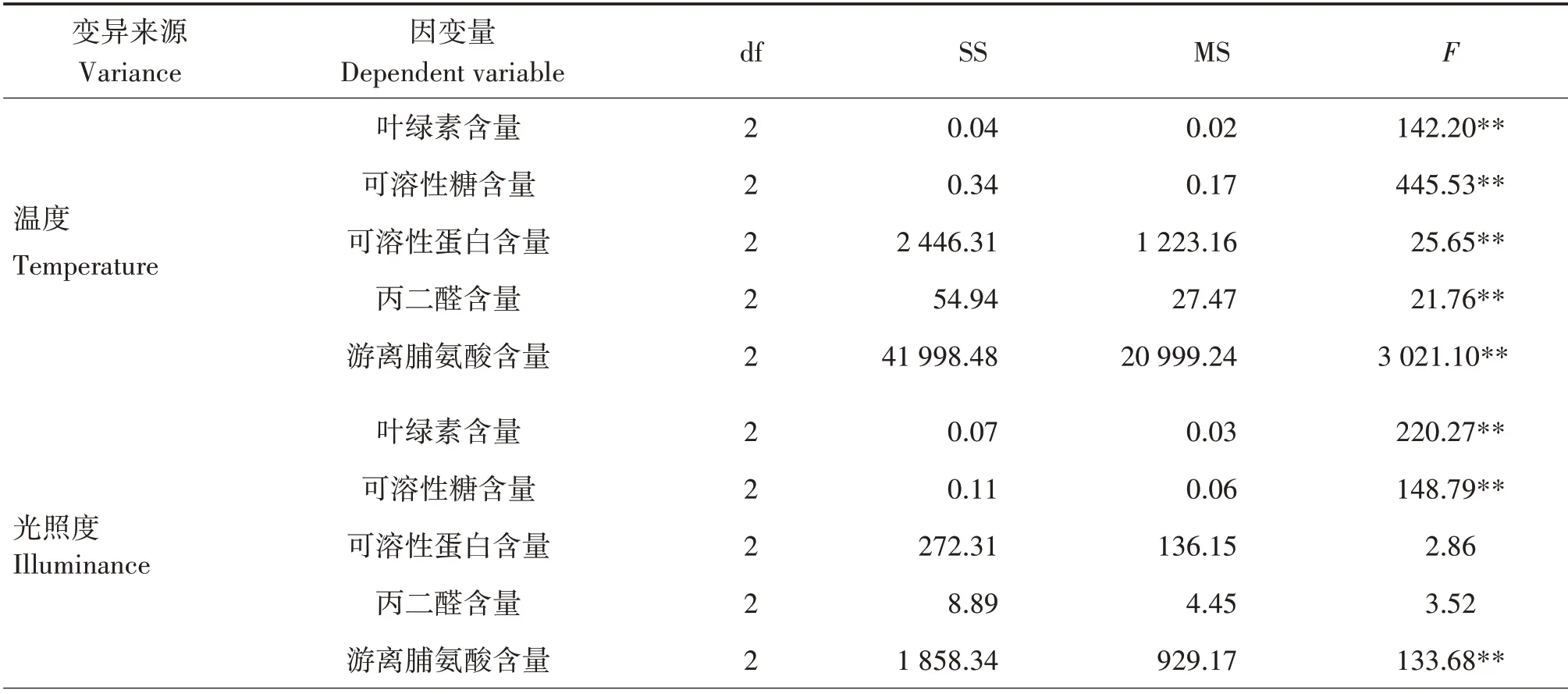
表4 不同环境因子对八角幼苗各生理指标影响的方差分析Tab.4 ANOVA of effects of different environmental factors on physiological indexes of I.verum seedlings
各环境因子对八角幼苗叶绿素、可溶性糖和游离脯氨酸含量影响极显著(P<0.01)。环境因子对叶绿素的影响程度为温度与光照度的交互作用>光照度>温度>土壤相对含水量,与极差分析结果一致;对可溶性糖和游离脯氨酸含量的影响程度均为温度>光照度>土壤相对含水量>温度与光照度的交互作用,环境因子对可溶性糖含量的影响与极差分析结果一致,光照度与土壤相对含水量对游离脯氨酸影响的顺序与极差分析结果不一致,但极差值相差较小,可能是试验误差或其他因素导致,需进一步综合分析。温度、土壤相对含水量及温度与光照度的交互作用对可溶性蛋白和MDA 含量的影响极显著(P<0.01),而光照度对其影响不显著,对可溶性蛋白含量的影响程度为温度>土壤相对含水率>温度与光照度的交互作用>光照度,对MDA的影响程度为温度与光照度的交互作用>温度>土壤相对含水量>光照度,均与极差分析结果一致。
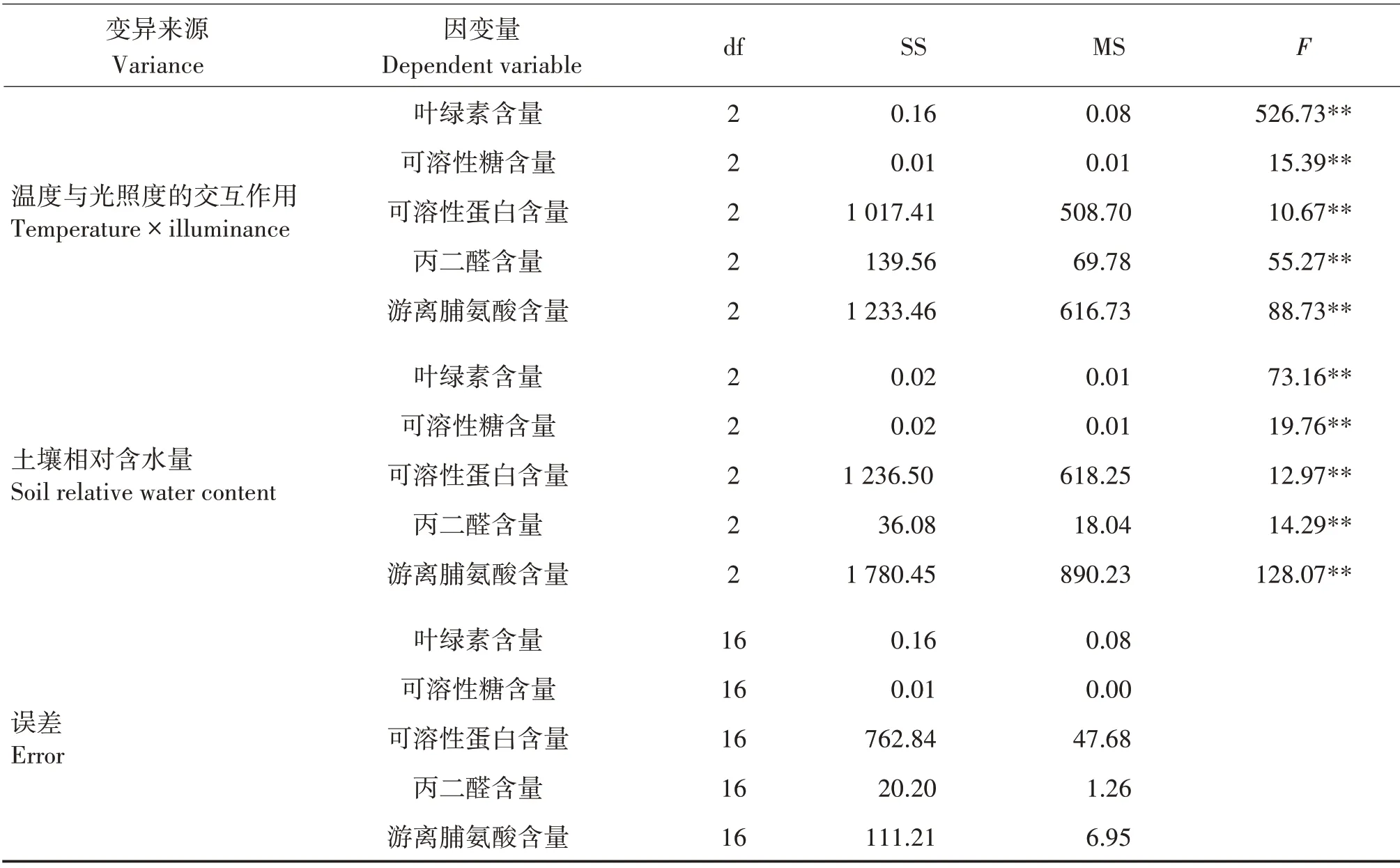
续表4Continued
2.3 不同指标最佳处理组合筛选
通过极差与方差分析可综合得出各生理指标的最佳组合。叶绿素含量是判断植物光合作用强弱的指标,含量越高越有利于八角幼苗的生理生长[33-35]。因此叶绿素以含量高的处理组合(θ3E2W2)为最好,与实际含量最高的处理8(θ3E2W3)基本接近。可溶性糖、可溶性蛋白和游离脯氨酸等是植物细胞内重要的渗透调剂物质,与植物受胁迫程度有着一定的正相关关系[36-37]。含量越低,表明植物受到的逆境危害较低[38-39]。可溶性糖以含量低的处理组合(θ3E3W2)为最好,与实际含量最低的处理9(θ3E3W1)基本接近。可溶性蛋白以含量低的处理组合(θ3E1W2)为最好,与实际含量最低的处理7(θ3E1W2)一致。在实际处理与极差分析结果中,游离脯氨酸含量最低的处理均为θ1E3W3,但θ1为0 ℃低温,与生产实践不一致,故将温度调整为游离脯氨酸含量较低的水平θ3,得到游离脯氨酸含量较低的处理组合为θ3E3W3。MDA 含量的变化反映了植物细胞发生膜质过氧化的剧烈程度和植物对逆境条件反应的强弱[40],其含量越低表明植物受到的逆境危害越低[41-42]。MDA 以含量低的处理组合(θ3E3W2)为最好,与实际含量最低的处理6(θ2E3W2)基本接近。
2.4 八角幼苗抗逆性综合评价
利用主成分分析法[30]可将多个彼此相关的生理指标转换为个数较少且彼此独立的新指标,可对八角幼苗的综合抗逆性进行量化比较。在主成分分析前需对各指标进行标准化:
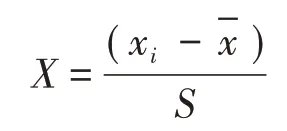
式中,X为标准化后所得数据,xi为i项指标的观察值,-x为某项指标的平均值,S为标准差。以累积贡献率达85%以上为参考值,确定主成分个数。由于主成分之间相互独立且有着不同的贡献率,因此,每个主成分的得分就是其加权值,其中权重就是主成分对应的贡献率。
对5 个生理指标进行主成分分析(表5)。经主成成分分析后,得到两个影响八角幼苗抗逆性得分的新变量,分别为Prin1 = -0.297X1+ 0.327X2+0.333X3+ 0.272X4- 0.083X5和Prin2 = 0.176X1+0.281X2+ 0.035X3+ 0.090X4+ 0.910X5。可得不同处理下八角幼苗的综合抗逆性评价值,再通过极差分析求得各环境因子影响八角幼苗综合抗逆性的主次,为温度>温度与光照度的交互作用>光照度>土壤相对含水量(表6)。
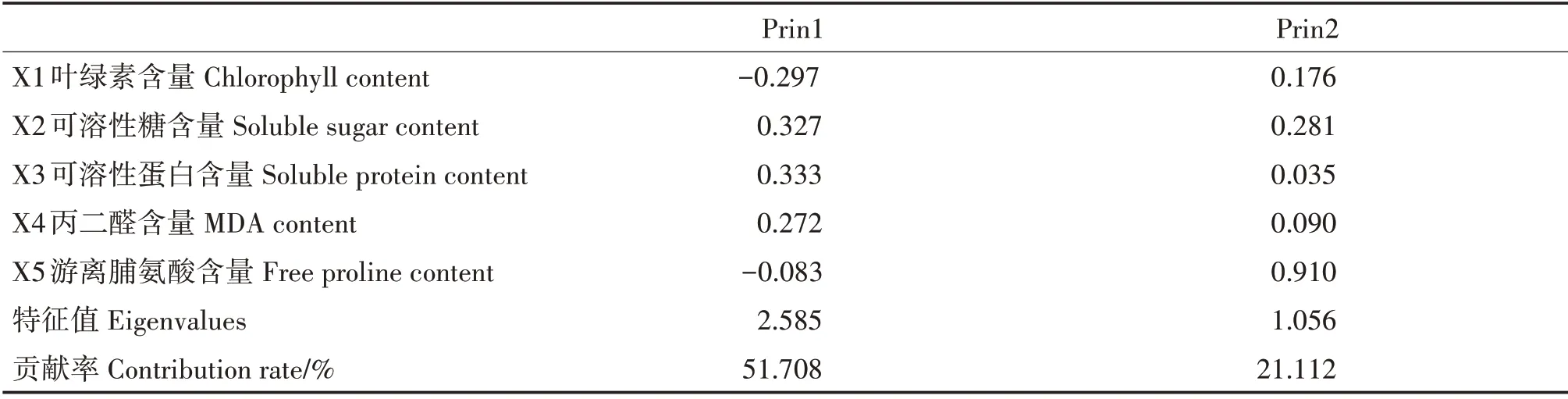
表5 不同处理下八角幼苗的生理指标主成分分析Tab.5 Principal component analysis of physiological indexes of I.verum seedlings in different treatments

表6 不同环境因子下八角幼苗抗逆性得分的极差分析及排序Tab.6 Scores range and order of stress resistance of I.verum seedlings under different environmental factors
3 结论与讨论
通过极差、方差与主成分分析可知,叶绿素最高含量组合为θ3E2W2、可溶性糖、可溶性蛋白、MDA和游离脯氨酸的最低含量组合分别为θ3E3W2、θ3E1W2、θ3E3W2和θ3E3W3,各环境因子影响八角幼苗综合抗逆性的程度为温度> 温度与光照度的交互作用> 光照度> 土壤相对含水量。温度是影响八角幼苗生理生化的主要环境因子,是影响可溶性糖、可溶性蛋白和游离脯氨酸含量的首要因素。各指标的最佳温度均为8 ℃(θ3),在该温度下,可溶性糖、可溶性蛋白和游离脯氨酸含量较小,表明该低温对八角生理的影响程度较低,各抗逆性指标均能正常响应环境因子的变化。从主成分分析变量Prin2的权重占比来看,游离脯氨酸可能是影响八角幼苗抗逆性评价的关键指标,其含量在0 ℃时最低,这可能是导致八角幼苗抗寒性弱的潜在限制因素。光照度与温度存在极显著的交互效应,成为影响八角幼苗生理生化的次要环境因子,对叶绿素、可溶性糖和游离脯氨酸含量的影响较大。单一光照度胁迫对可溶性蛋白和MDA含量的影响不显著,但随着温度降低,过量的可溶性蛋白质和MDA可能会影响叶绿素等相关指标的合成与降解[33],间接地对光合作用产生影响,从而形成温光的交互影响。在低温主导的逆境下,渗透调节物质的含量越高表明该光照度下植物的抗寒能力越强。1 600 lx(E2)是最佳的光照度,在该光照度下,叶绿素、游离脯氨酸和可溶性糖含量较高,表明在低温主导下,1 600 lx 光照度更有利于八角幼苗抵御低温逆境的危害。土壤相对含水量对八角幼苗生理生化的影响最小,对可溶性蛋白和游离脯氨酸含量的影响较大。其中可溶性蛋白在50% ~55%(W2)土壤相对含水量下含量最低,说明八角在该含水量下受到的胁迫最少,而游离脯氨酸含量随着淹水程度的增加而增加。因此,综合考虑得到八角抗逆性最佳的组合为θ3E2W2,在8 ℃(θ3)、1 600 lx(E2)和50% ~55%(W2)土壤相对含水量条件下,更适于八角幼苗的生理平衡,抗逆能力较强。在生产实践中应考虑温度与光照度的交互作用对八角幼苗的影响,低温逆境下,适量的光照度有利于八角幼苗叶绿素及其渗透调节物质的积累。

