不同树种林下套种金花茶土壤微生物多样性分析
伍思宇,李宝财,李纪元,廖健明,韦晓娟,傅镜远,李开祥
(1.广西壮族自治区林业科学研究院 广西特色经济林培育与利用重点实验室,广西南宁530002;2.中国林业科学研究院亚热带林业研究所,浙江杭州 311400;3.合浦佳永金花茶开发有限公司,广西合浦 536100)
金花茶(Camellia nitidissima)属小乔木或常绿灌木,高度为2 ~6 m[1],主要分布在中国广西南部和越南北部[2],原始生境的伴生植物主要有白栎(Quer⁃cus fabri)、水冬哥(Saurauia tristyla)和白颜树(Giron⁃niera subaequalis)等[3]。金花茶是山茶属稀有的黄色种质资源,含有丰富的黄酮类、多糖和茶多酚等化学活性成分以及锗(Ge)和砷(Se)等微量元素[4-5],具有极高的观赏和科研价值[6]。
土壤微生物是森林生态系统的重要组成部分,在养分转化和循环上发挥重要的作用[7],其多样性受林分、枯落物和土壤因子等因素共同影响[8-10]。Waid[11]指出植被类型和数量不同,林下凋落物及根系分泌物也不同,使土壤微生物发生变化。宋贤冲等[12]研究表明,土壤有机质、全磷(P)和全钾(K)含量等土壤理化性质可能是造成不同季节常绿阔叶林土壤微生物群落功能多样性差异的主要原因。
林下套种是通过空间将目标树种与其他植物组合在一起的栽培模式,不仅能充分利用林地空间,增加森林单产,还能促进养分循环,提高土壤肥力和土壤微生物数量[13]。吉艳芝等[14]研究表明与落叶松(Larix gmelinii)纯林相比,落叶松混交林的土壤养分、微生物多样性和酶活性均得到了显著提高。由于金花茶耐阴的特性[3],研究人员采取林下套种金花茶的栽培模式,研究金花茶的生长和光合特性[15-16],但鲜少关注林下的土壤特性。本研究对不同树种林下套种金花茶的土壤微生物多样性进行研究,探讨土壤微生物群落结构的差异,以及枯落物和土壤理化性质对土壤微生物多样性的影响,以期为林下套种金花茶选择适宜的上层树种提供理论依据和指导。
1 材料与方法
1.1 试验地概况
试验地位于广西合浦县佳永金花茶开发有限公司龙门江基地(109°21'E,21°67'N),海拔12 m,属亚热带海洋季节性气候,年均气温22.4 ℃,年均降水量1 667 mm,年均相对湿度75% ~86%。选择造林时间相近的3 种树种套种金花茶,对枯落物和土壤进行调查研究。3 种树种分别为印度紫檀(Ptero⁃carpus indicus)、荔 枝(Litchi chinensis)和 湿 地 松(Pinus elliottii)(表1)。印度紫檀为高大落叶乔木[17],林下透光度在春季、夏季、秋季和冬季分别为20%、12.5%、44.8%和100%;荔枝为常绿乔木[18],林下透光度常年为5%左右;湿地松为常绿针叶乔木[19],林下透光度常年为60%左右。
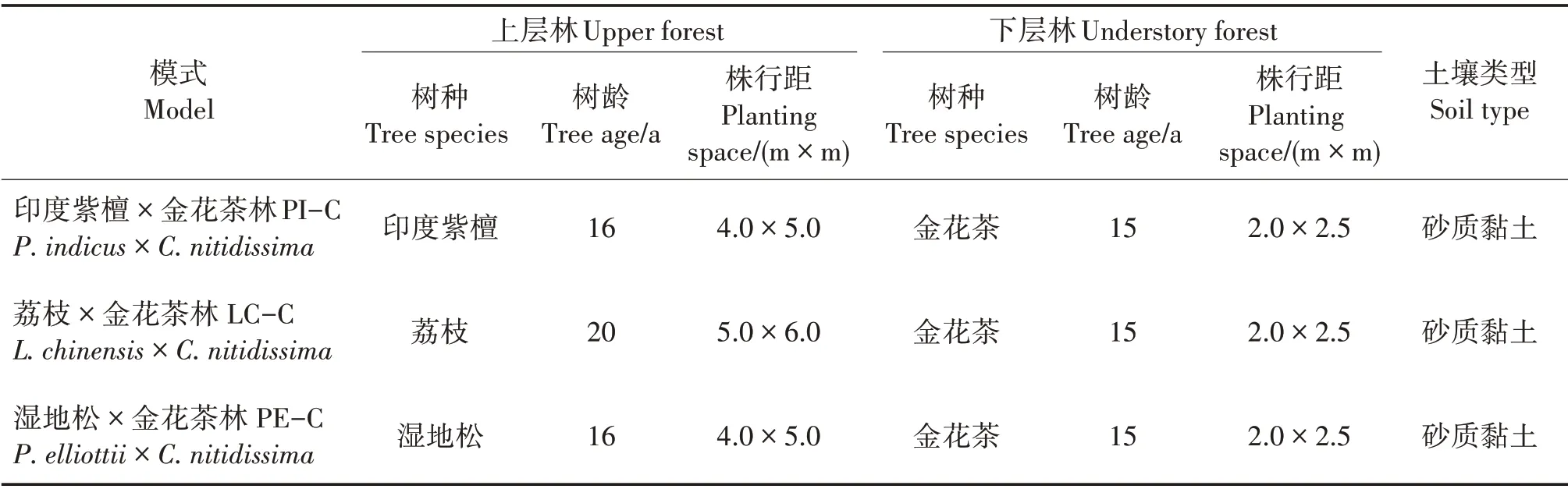
表1 不同套种模式基本概况Tab.1 General situation of different interplanting models
1.2 样品采集
2018年12月—2019年12月,每3 个月采集1次枯落物。收集面积为1 m2的枯枝落叶,风干后称重,用于测定枯落物蓄积量,另取部分枯枝落叶样品带回室内测定养分。
2019年6月采集土壤,测定土壤理化性质和微生物。在3 种树种的林地分别随机选取3 个采样点,清除表层杂质后,用环刀取出深度为0 ~10 cm的土壤,用于土壤物理性质分析。于平行断面下铲取土样,剔除石砾和植物残根等杂物后,将采集的土壤分别混合均匀,采用四分法,将一部分装入15 mL 无菌离心管中冷藏,用于土壤微生物分析;另一部分置于自封袋中,用于土壤化学性质分析。
1.3 样品测定和数据分析
用称重法测枯落物蓄积量[20];凯氏定氮法测全氮(N)含量,钼锑抗比色法测全P 含量,火焰原子分光光度法测全K 含量[21]。用烘干法测土壤含水量,环刀法测土壤容重和土壤孔隙度[22];用电位法测土壤pH 值;用重铬酸钾-硫酸消化法测土壤有机质含量,用凯氏定氮法测土壤全N含量,用钼锑抗比色法测土壤全P 含量,用酸溶-火焰光度法法测土壤全K含量[23]。采用Excel和SPSS 19.0软件进行数据处理。
用Illumina-MiSeq 高通量测序技术(上海美吉生物医药科技有限公司)进行土壤微生物群落基因组测序。采用E.Z.N.A.®soil DNA Kit 提取试剂盒(Omega Bio-Tek,Norcross,GA,U.S.)提取土壤总DNA。细菌V3 ~V4可变区采用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物进行PCR扩增,真菌18S rDNA 的V5 ~V7区采用SSU0817F(5’-TTAGCATGGAATAATRRAATAGGA-3’)和1196R(5’-TCTGGACCTGGTGAGTTTCC-3’)引物进行扩增。将PCR 扩增产物用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA 凝胶回收试剂盒(AXYGEN 公司)切胶回收PCR 产物,Tris-HCl 洗脱,1%琼脂糖电泳检测。再将PCR 回收产物用QuantiFluor™-ST 蓝色荧光定量系统(Promega公司)进行检测定量,之后按照测序量,进行相应比例的混合。先连接“Y”字形连接器,再用磁珠过滤,自连接片段,然后通过PCR 扩增文库模板,对NaOH变性,产生单链DNA片段。利用测序公司MiseqPE300平台进行测序(上海美吉生物制药有限公司)。将原始数据上传至NCBI数据库进行比对,并在美吉I-Sanger 云数据分析平台上进行在线数据分析(www.majorbio.com)。
2 结果与分析
2.1 不同套种模式枯落物蓄积量和养分分析
枯落物累计年限相近时,不同林分枯落物蓄积量主要与枯落物的输入量和分解速率有关[20]。3 种套种处理的枯落物单位面积蓄积量均呈先减少后增加的趋势,说明枯落物随着时间的推移会逐步分解,待到新一轮落叶期时,枯落物又会再次累积(图1a)。在枯落物分解的过程中,枯落物的养分贮量也会随之变化。PI-C 枯落物的全N、全P 和全K 含量随时间呈波动变化(图1b ~d),LC-C 和PE-C 全年变化趋势均不太明显。PI-C枯落物全N含量呈先增多后减少再增多的趋势,年变化量为16.36 g/kg,全年均高于LC-C和PE-C,PI-C、LC-C和PE-C凋落物全N含量 分别 为13.39 ~29.75、10.68 ~14.36 和4.90 ~8.38 g/kg。PI-C 枯落物全P 含量呈先增多后减少的趋势,年变化量为0.51 g/kg。PI-C、LC-C 和PE-C 枯落物全P含量分别为0.55 ~1.06、0.49 ~0.68和0.20 ~0.31 g/kg,PI-C 枯落物全P 含量存在明显优势。PIC 枯落物全K 含量呈先减少后增多的趋势,年变化量为3.52 g/kg,全K 含量最大值为5.15 g/kg,分别为LC-C和PE-C全K含量最大值的1.40和2.83倍。
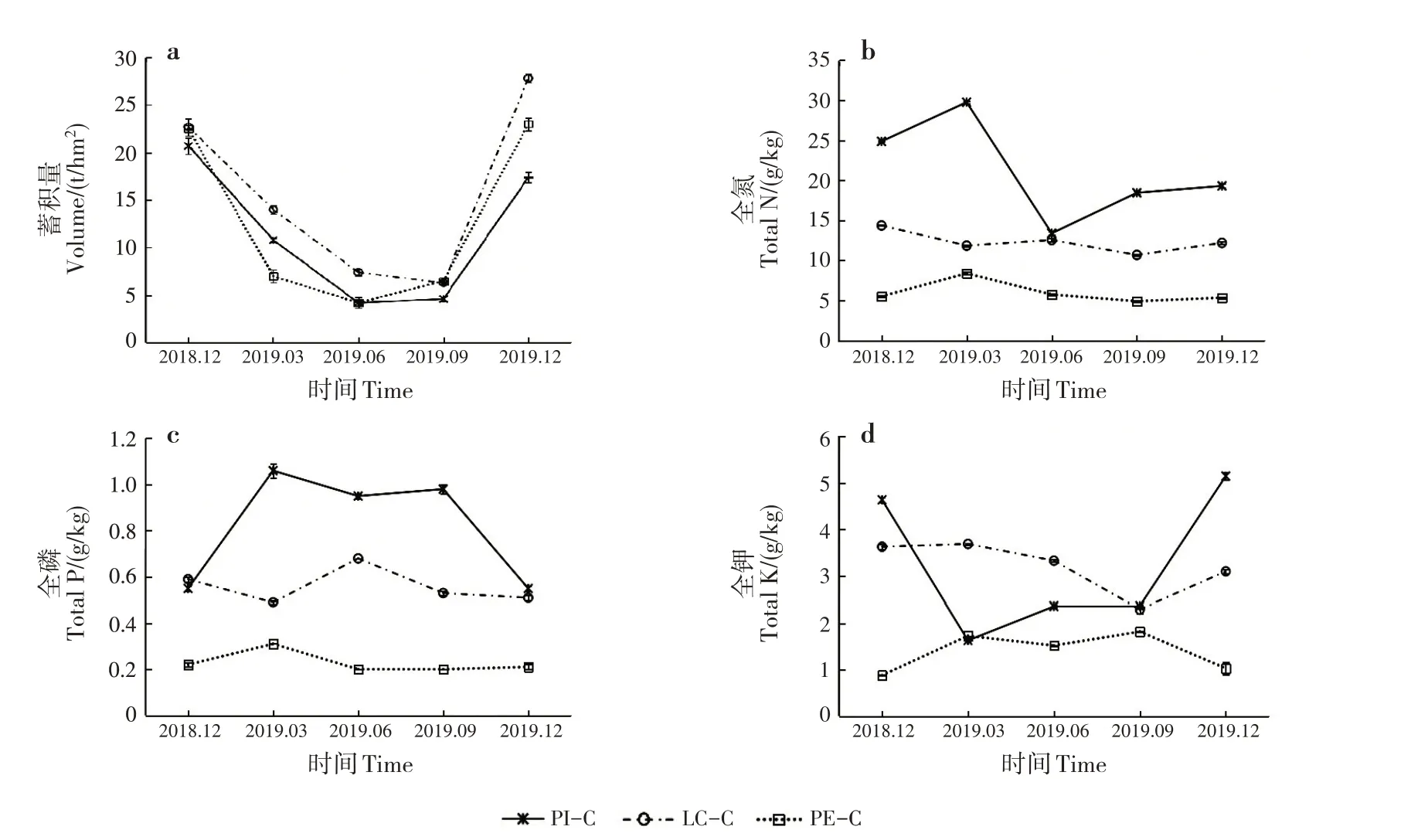
图1 不同套种模式的枯落物蓄积量和养分贮量动态变化Fig.1 Dynamic changes of litter volume and nutrient storage of different interplanting models
2.2 不同套种模式土壤理化性质分析
不同套种模式对土壤的最小持水量、毛管持水量、非毛管孔隙、毛管孔隙、总孔隙度、pH、全P 和全K 含量影响显著(P< 0.05),对土壤容重、最大持水量、有机质和全N含量影响不显著(表2)。土壤孔隙度能反映出土壤透水通气性能是否良好[24],PI-C 土壤总孔隙度最大,与LC-C 和PE-C 差异显著(P<0.05),说明PI-C 土壤透水通气性最好。3 种土壤均为酸性土壤,其中PE-C 土壤pH 为4.70,与PI-C 和LC-C 差异显著(P<0.05)。LC-C 土壤全P 含量最高(1.08 g/kg),与PE-C差异显著(P<0.05),与PI-C差异不显著;LC-C 土壤全K 含量最高(2.99 g/kg),与PI-C和LC-C均差异显著(P<0.05)。
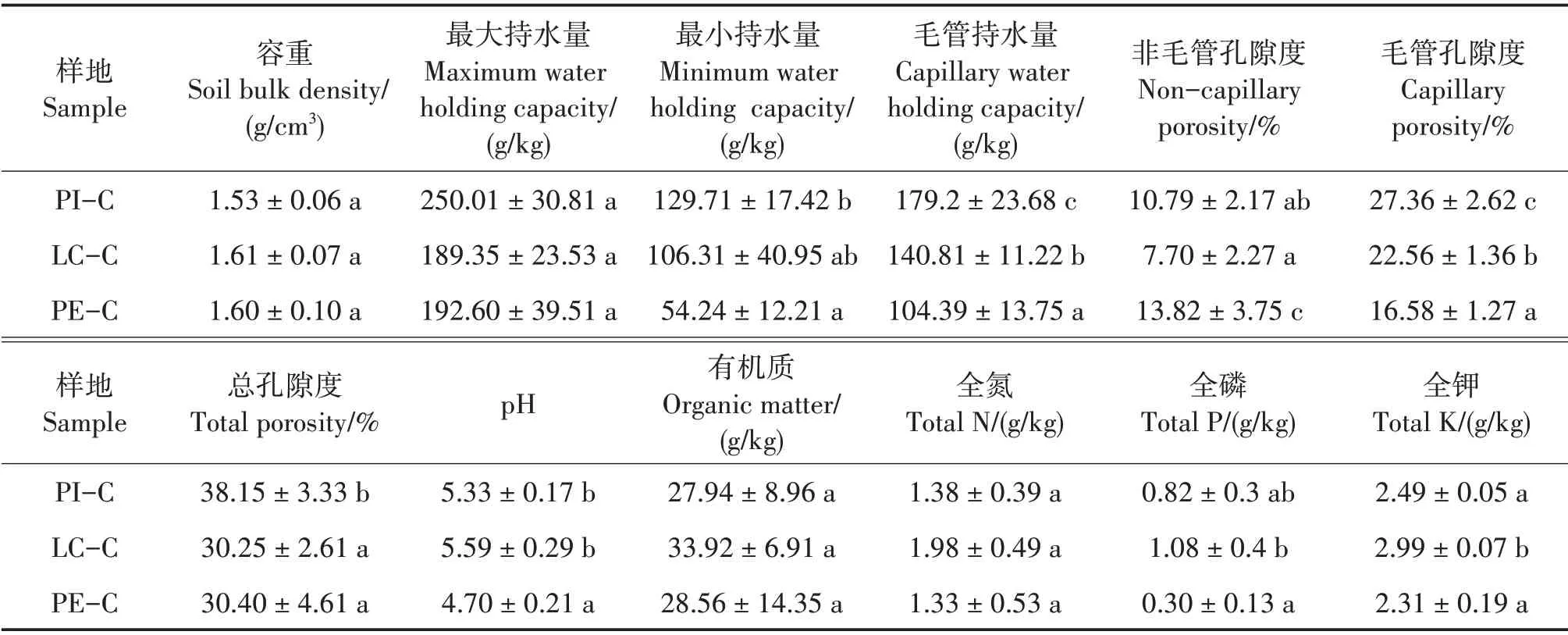
表2 不同套种模式的土壤理化性质Tab.2 Soil physical and chemical properties of different interplanting models
2.3 不同套种模式土壤微生物多样性分析
PI-C、LC-C 和PE-C 土壤细菌群落各获得4 471、4 310 和2 897 个OTU,真菌群落各获得243、300 和259 个OTU,真菌细菌比分别为0.054、0.070 和0.089。对0.97%相似水平的OTU 代表序列进行分类学分析,PI-C、LC-C 和PE-C 土壤细菌群落分别归为32 个门734 个属、28 个门638 个属和26个门465个属,真菌群落分别归为36个门124个属、39个门136个属和32个门117个属。
2.3.1 不同套种模式土壤微生物Alpha多样性分析
Chao1和Ace指数越大,说明样本中微生物丰富度越高;Shannon 指数越大,Simpson 指数越小,说明样本中微生物群落多样性越高[25];Coverage 指数越高,说明样本中序列被测出的概率越高。PI-C 和LC-C土壤细菌的Chao1、Ace和Shannon指数显著大于PE-C(P< 0.05),且Simpson 指数显著小于PE-C(P<0.05),说明PI-C 和LC-C 土壤细菌丰富度和多样性明显优于PE-C,PI-C 与LC-C 差异不显著;PIC、LC-C 和PE-C 土壤真菌的Chao1、Ace、Shannon和Simpson 指数差异不显著,说明3 种土壤真菌丰富度和多样性差异不大(表3)。
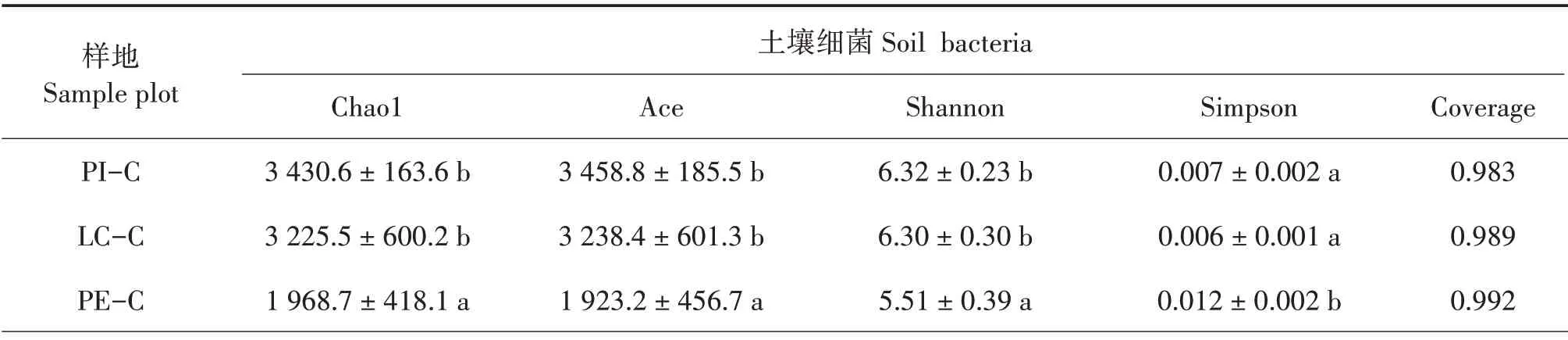
表3 不同树种套种模式的土壤微生物多样性指数Tab.3 Soil microbial diversity index of different interplanting models
续表3Continued
2.3.2 不同套种模式土壤微生物群落组成分析
PI-C、LC-C 和PE-C 土壤优势细菌门分别为13、13 和12 个,其中变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)在3 种土壤中均为优势菌群,变形菌门在3 种土壤中占比为LC-C(34.67%)>PE-C(28.35%)>PI-C(22.40%);放线菌门为PE-C(30.50%)>LC-C(23.39%)>PI-C(11.52%);酸杆菌 门 为PE-C(23.31%)>PI-C(16.07%)>LC-C(12.16%);绿弯菌门为PI-C(29.81%)>LC-C(13.48%)>PE-C(6.81%)(图2a)。在属分类水平上,PI-C 土壤中细菌占比最多的3 个群落分别为norank_c_AD3(19.78%)、norank_f_Xanthobacterace⁃ae(5.73%)和norank_o_Subgroup_2(5.04%);LC-C土壤中细菌占比最多的3个群落分别为norank_f_Xan⁃thobacteraceae (9.97%) 、 norank_c_Subgroup_6(4.17%)和norank_c_AD3(3.99%);PE-C 土壤中细菌占比最多的3 个群落分别为热酸菌属(Acidother⁃mus,10.95%)、norank_f_Xanthobacteraceae(8.49%)和norank_o_Acidobacteriales(6.46%)(图2b)。
PI-C、LC-C 和PE-C 土壤优势真菌为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉门(Mucoromycota)和纤毛门(Ciliophora)。子囊菌门在3 种土壤中占比为PI-C(77.61%)>LC-C(62.19%)>PE-C(28.45%);担子菌门为PE-C(63.55%)>LC-C(26.35%)>PI-C(11.91%);毛霉门 为 PI-C (5.22%) >LC-C (4.80%) >PE-C(2.49%);纤毛门为PI-C(1.46%)>LC-C(1.10%)>PE-C(0.79%)(图2c)。PI-C、LC-C 和PE-C 土壤中占比最多的细菌和真菌群落分别为绿弯菌门和子囊菌门、变形菌门和子囊菌门、放线菌门和担子菌门。PI-C 真菌占比最多的3 个群落为unclassi⁃fied_f_Aspergillaceae(16.46%)、unclassified_f_Hypo⁃creaceae(14.12%)和毛壳菌属(Chaetomium,13.57%);LC-C 真菌占比最多的3 个群落为unclas⁃sified_f_Aspergillaceae(17.45%)、Saitozyma(15.42%)和unclassified_f_Hypocreaceae(7.75%);PE-C 真菌占比最多的3 个群落为Saitozyma(55.68%)、unclas⁃sified_f_Hypocreaceae(8.26%)和毛壳菌属(6.10%)(图2d)。
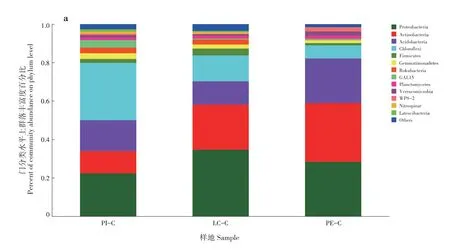
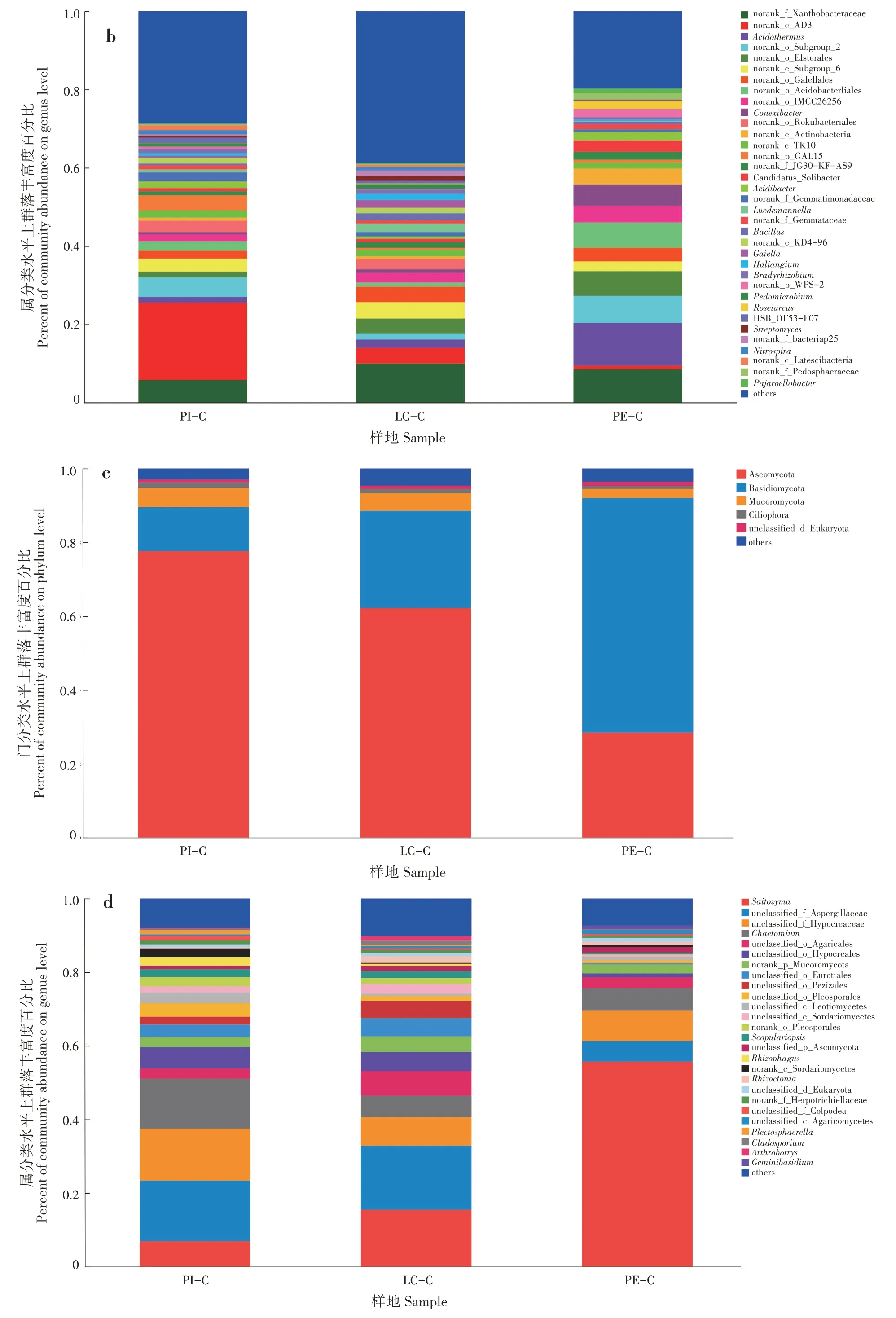
图2 不同套种模式土壤微生物群落(a和b:细菌;c和d:真菌)Fig.2 Soil microbial community of different interplanting models(a and b:bacteria;c and d:fungi)
3 种套种模式土壤中共有的细菌属和真菌属分别为351个和82个(图3)。PI-C 土壤中特有的细菌属为176 个,多于LC-C(25 个)和PE-C(14 个)(图3a)。PI-C、LC-C 和PE-C 土壤中特有的真菌属分别为17个、25个和11个(图3b)。
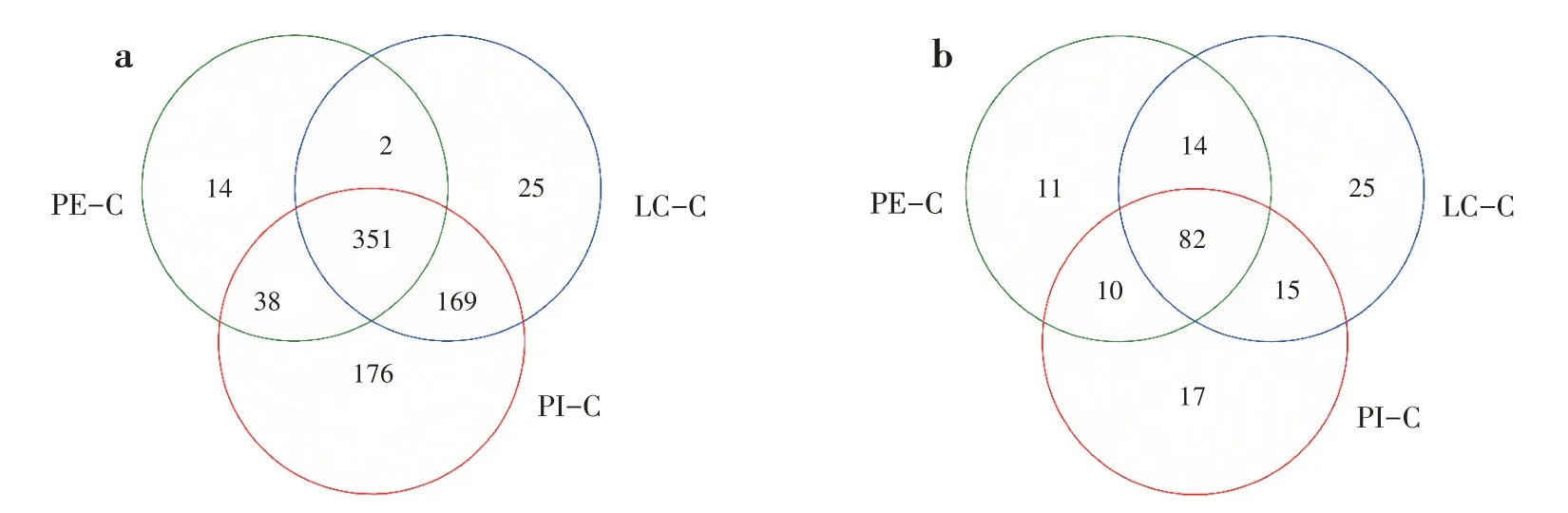
图3 不同套种模式土壤微生物属分类水平上Venn图(a:细菌;b:真菌)Fig.3 Venn diagram of soil microbe of different interplanting models at the genus level(a:bacteria;b:fungi)
2.3.3 不同套种模式土壤微生物与环境因子关联分析
冗余分析(RDA)是环境因子约束化的PCA 分析,反映样本分布和环境因子间的关系[26]。细菌群落多样性与pH、有机质呈显著正相关(P<0.05),与全P 含量呈极显著正相关关系(P<0.01),说明pH、有机质和全P 含量共同影响土壤细菌多样性(图4a);真菌群落多样性与毛管持水量呈显著正相关(P< 0.05),说明毛管持水量影响土壤真菌多样性(图4b)。
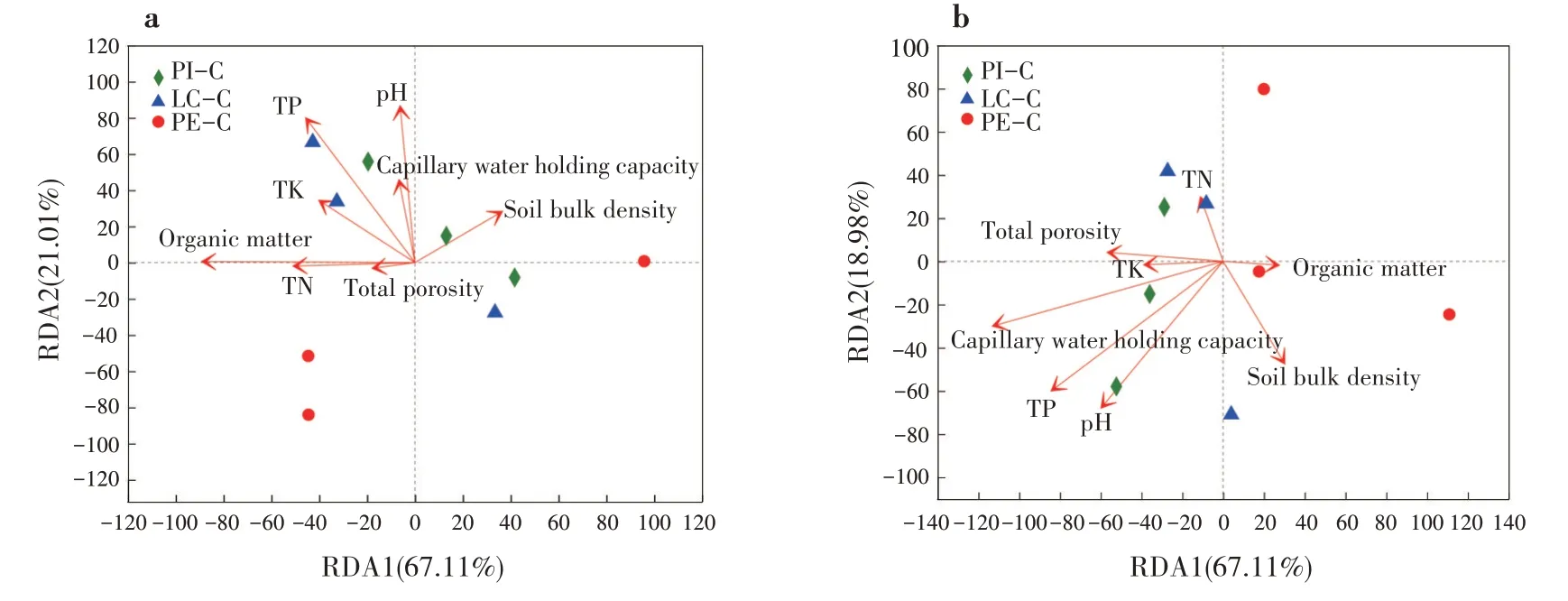
图4 不同套种模式土壤微生物群落结构与环境因子的RDA分析(a:细菌;b:真菌)Fig.4 RDA analysis of soil microbial community structure and environmental factors of different interplanting models(a:bacteria;b:fungi)
通过计算环境因子和菌群之前的Spearman 等级相关系数发现,细菌的pH 与赭黄嗜盐囊菌属(Haliangium)、Gaiella、硝化螺旋菌属(Nitrospira)、unclassified_o_Acidobacteriales、芽孢杆菌属(Bacil⁃lus)、Luedemannella、土微菌属(Pedomicrobium)呈现极显著极强正相关(P<0.01;P<0.001;R ≥0.8);全P 含量与赭黄嗜盐囊菌属、Gaiella、硝化螺旋菌属、unclassified_o_Acidobacteriales、芽孢杆菌属、链霉菌属(Streptomyces)呈极显著极强正相关(P<0.01;P<0.001;R ≥0.8),与norank_p_WPS-2 呈极显著极强负相关(P<0.01;R ≤-0.8);全K 含量与芽孢杆菌属呈极显著极强正相关(P<0.01;R ≥0.8);有机质与norank_p_GAL15 呈极显著极强负相关(P<0.01;R ≤-0.8)(图5a)。
真菌的容重与norank_f_Stenostomidae、有机质含量与Nuclearia均呈极显著极强负相关(P<0.01;R ≥0.8);全钾含量与Plectosphaerella和枝孢属(Cladosporium)呈极显著极强正相关(P<0.01;R ≥0.8),与乳菇属(Lactarius)呈极显著极强负相关(P<0.01;R ≥0.8);毛管持水量与unclassified_o_Peziza⁃les、unclassified_o_Eurotiales 呈极显著极强正相关(P<0.01;R ≤-0.8),与Saitozyma、unclassified_p_As⁃comycota 和双担菌属(Geminibasidium)呈极显著极强负相关(P<0.01;R ≤-0.8);pH 与Arthrobotryss、全P含量与unclassified_o_Pezizales 均呈极显著极强正相关(P<0.01;R ≤-0.8)(图5b)。
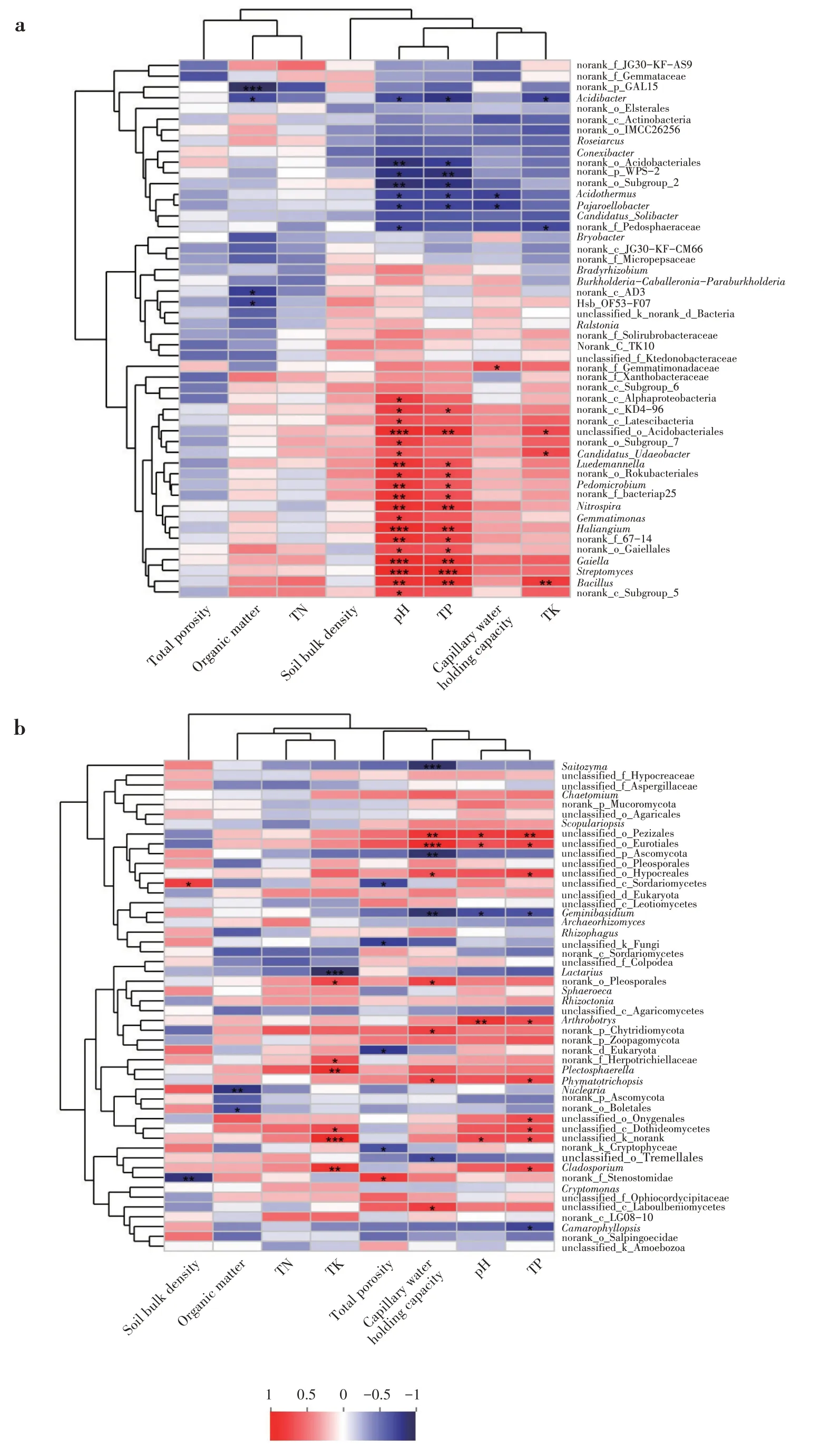
图5 属分类水平上土壤微生物相对丰度与环境因子相关性(a:细菌;b:真菌)Fig.5 Correlation between relative abundance of soil microbes and environmental factors at genus level(a:bacteria;b:fungi)
3 讨论与结论
3.1 不同套种模式枯落物对土壤微生物多样性的影响
不同植物的凋落物理化性质不同,分解时释放的养分也具有差异性,对土壤微生物生长具有选择性刺激作用,进而影响微生物群落结构和功能及其多样性[27]。本研究表明印度紫檀×金花茶林、荔枝×金花茶林土壤细菌丰富度和多样性明显优于湿地松× 金花茶林,这与Klimek 等[28]研究结果相似,阔叶树种较针叶树种具有更高的土壤微生物活性和功能多样性,亦与张信思[3]调查发现的野生金花茶原生生境的伴生植物多为阔叶林的特性相一致。
土壤细菌真菌比可反映细菌和真菌的相对丰富度[29]。在本研究中,印度紫檀×金花茶林的细菌真菌比明显高于荔枝× 金花茶林和湿地松× 金花茶林,可能是因为印度紫檀×金花茶林枯落物的全N 和全P年变化量均明显高于其他两种林地,有研究表明枯落物中的N、P 元素释放量越高,越有利于细菌的生长[30]。在后续研究中,还需进行枯落物矿化速率试验进一步阐明不同金花茶套种模式的枯落物对微生物群落结构和多样性的影响。
3.2 不同套种模式土壤理化性质对微生物多样性的影响
土壤微生物对环境极为敏感,森林类型和土壤理化性质是影响其多样性的重要因素[31-32]。RDA 结果表明,pH、有机质和全P 含量对土壤细菌多样性的影响较大,其中,全P 含量的影响最大,呈极显著相关;毛管持水量则影响土壤真菌多样性。宋贤冲等[12]研究发现全P 含量与土壤微生物多样性指数极显著相关,有机质与土壤微生物多样性表现为显著相关;邵颖等[33]研究表明pH 值与土壤细菌群落多样性有关,与本研究的发现一致。孔隙度、全N和全K 含量对土壤微生物多样性贡献不大,这与赵春梅等[34]的研究结果不一致,可能是收获金花茶花朵和叶片时人为活动较多所致,且孔隙度、全N和全K并不能影响所有土壤微生物群落。根据相关性Heat⁃map 分析结果可知,pH、有机质、全P 和全K 含量可与部分细菌属种类呈极显著极强相关性,容重、毛管持水量、pH、全P含量和全K含量可与部分真菌属呈极显著极强相关性。
土壤生境不同,主要菌群的丰度和结构不同[35]。由于3 种套种模式土壤的孔隙度、pH、全P 和全K 含量均差异显著,使土壤生境具有差异。3 种套种模式土壤中的优势微生物均为变形菌门、放线菌门、酸杆菌门、绿弯菌门4个细菌菌群和子囊菌门、担子菌门2 个真菌菌群,研究结果与张胜男等[35]和Han⁃son 等[36]的基本一致。有研究认为绿弯菌门和富营养化程度有关[37],酸杆菌门与贫瘠的土壤环境有关[38],子囊菌门能利用环境中多种养分供其生长[39],担子菌门可作为土壤扰动强弱的指示真菌[40]。印度紫檀×金花茶林土壤微生物丰富度和多样性最高,占比最多的是绿弯菌门和子囊菌门,特有的细菌属种类也远远多于其他两种模式的土壤,可能原因是印度紫檀×金花茶林枯落物代谢较快,更多养分流入土壤。荔枝× 金花茶林土壤中占比最多的是变形菌门和子囊菌门,湿地松×金花茶林土壤中占比最多的是放线菌门和担子菌门。
本研究结果表明,枯落物蓄积量、全N 和全P年变化量以及土壤pH、有机质、全P 含量和毛管持水量能影响土壤微生物群落结构和多样性。综合考虑土壤理化性质和微生物多样性,在林下套种金花茶栽培模式中,宜选择落叶阔叶林作为上层林树种。

