热疗对巨噬细胞M2极化作用及其对肺癌细胞侵袭、迁移影响的体外实验研究
饶紫琦,刘菁,陈炳林,邓永然,刘文其
肺癌的发病率、病死率均居全球恶性肿瘤的首位,目前主要是以手术、放疗、化疗以及靶向治疗为主的综合治疗,但总体生存率仍然较低。肿瘤微环境(tumor microenvironment,TME)一直以来被认为是癌症的主要标志,在肿瘤的发生、发展及预后中均起着重要的作用,而巨噬细胞是TME系统中最重要的免疫炎性细胞群之一[1]。巨噬细胞由单核细胞分化而来,不同于其他免疫细胞,其最大特征是具有极强的功能异质性和可塑性,并能够根据机体内复杂微环境中的信号被分化为不同功能的细胞亚群,即经典活化的M1型巨噬细胞与替代活化的M2型巨噬细胞[2]。M1型巨噬细胞通过分泌多种促炎性因子、趋化因子等参与炎症和宿主免疫反应,而M2型巨噬细胞则分泌抑制性细胞因子,下调免疫应答,促进肿瘤进展[3]。然而,巨噬细胞在维持表型平衡的过程中受多种因素及机制的影响。
热疗是继传统治疗方式后的一种新兴、无创、绿色的癌症治疗方式,目前已被广泛运用于各种肿瘤的辅助治疗中,得到了许多临床医生及科研学者的广泛关注[4]。热疗过去被认为可以对肿瘤细胞进行直接杀伤,通过抑制肿瘤细胞的增殖生长,促进凋亡,改善TME中的低pH值、乏氧状态,增加肿瘤的血流灌注和氧合[5]。最近的研究发现,热疗还可以有效刺激机体产生抗肿瘤的免疫反应[6]。有研究表明,热疗不仅能直接作用于肿瘤细胞进行杀伤,还能调节机体微环境中各种免疫细胞的活性,包括T淋巴细胞、自然杀伤细胞(natural killer cell,NK)和抗原提呈细胞(antigen-presenting cells,APC)等[7]。因此,推测热疗带来的热效应能作用于TME,调控巨噬细胞的表型及对肿瘤细胞的恶性生物学行为产生抑制作用。目前,TME以及免疫治疗对于以往直接靶向治疗肿瘤细胞是一种新的思路,热疗是如何改善TME、提高机体免疫反应的相关机制仍然需要通过大量的研究来探索。本研究从分子和细胞的角度初步探讨热疗对M2型肿瘤相关巨噬细胞的调控作用,分析热疗抗肿瘤的免疫机制,探索热疗在治疗肿瘤方面的价值。
1 材料与方法
1.1 研究时间 2019年6—12月。
1.2 材料 RAW264.7细胞(M0型巨噬细胞)购自中国科学院,由广西医科大学基础实验室保存,小鼠肺癌细胞(LLC)购自ATCC,DMEM培养液和胎牛血清购自Gibco公司,聚合酶链反应(PCR)引物由上海生物工程有限公司设计并合成,小鼠干扰素γ(IFN-γ)、小鼠白介素(IL)-4购自Peprotech公司,小鼠脂多糖(LPS)购自Sigma,PE标记的抗小鼠CD86〔CD86(B7-2)Monoclonal Antibody(GL1),FITC,eBioscience)〕和APC标记的抗小鼠CD206抗体〔(CD206(MMR)Monoclonal Antibody(MR6F3),APC,eBioscience)〕购自赛默飞世尔科技公司,Transwell小室及培养板、Corning Incorporated、细胞增殖活力试剂盒(CCK-8)购自Sigma公司,反转录试剂盒、实时荧光定量聚合酶链反应(real time quantitative PCR,RT-PCR)试剂盒购自TaKaRa公司。
1.3 方法
1.3.1 RAW264.7细胞株的培养 用含10%胎牛血清和1%青链霉素混合液的DMEM培养基培养RAW264.7细胞,于37 ℃,5%CO2细胞恒温培养箱中培养。
1.3.2 细胞的培养和诱导分化 RAW264.7细胞用含100 ml/L胎牛血清DMEM完全培养基培养并传代;3×105/ml的RAW264.7细胞接种至6孔板内,24 h后移去RAW264.7细胞中的培养基,磷酸缓冲盐溶液(PBS)清洗2次。加入IFN-γ(10 000 ng/L)、LPS(100 000 ng/L),继续培养48 h为M1型巨噬细胞;加入IL-4(20 000 ng/L),继续培养48 h为M2型巨噬细胞。
1.3.3 流式细胞术检测M0、M1、M2型巨噬细胞表面标志抗原CD86、CD206表达率 收集不同诱导处理的RAW264.7细胞,用PBS清洗2次,分析表面标志抗原CD86、CD206的表达。参考抗体说明书,加入荧光素偶联的抗体,4 ℃避光孵育30 min。对细胞内分子进行染色,先加入固定/透膜缓冲液200 μl,混匀并重悬细胞,4 ℃孵育30 min,洗涤3次,分别加入抗小鼠CD86和CD206抗体,4 ℃避光孵育30 min。PBS重悬细胞,流式细胞仪进行检测,结果用Flow Jo 7.6.1软件分析。
1.3.4 ELISA法检测M0、M1、M2型巨噬细胞培养上清液中IL-10、IL-12分泌水平 按照试剂盒说明书稀释标准品。测定450 nm波长处吸光度(OD)值。以标准品浓度为横坐标,OD值为纵坐标,绘制标准曲线,然后根据标准曲线的OD值查出相应的浓度,乘以稀释倍数,即为样品的实际浓度绘制标准曲线并计算M0、M1、M2型巨噬细胞培养上清液中IL-10、IL-12分泌水平。
1.3.5 细胞热疗及分组 将细胞置于41 ℃、42 ℃、43 ℃恒温循环水浴锅中分别孵育1 h,然后放入37 ℃,5%CO2的培养箱中复温继续培养6 h后,进行后续实验。细胞分为空白对照(37 ℃)组,热疗(41 ℃、42 ℃、43 ℃)组。
1.3.6 CCK-8法检测热疗对M2型巨噬细胞增殖活性的影响 调整RAW264.7细胞浓度1×104/ml,加入96孔板内,200 μl/孔,贴壁过夜培养。每孔加入CCK-8溶液(5 mg/ml用PBS配制,pH 7.4),37 ℃继续孵育4 h后终止培养。在热疗时、热疗后24、48、72 h 4个时间点测量OD值。酶联免疫检测仪选用450 nm波长,测定各孔OD值,计算热疗后各温度处理组的细胞存活率。每组实验重复3次,取其均值记录结果。
1.3.7 RT-PCR检测M0、M2型巨噬细胞及热疗(42 ℃)后M2型巨噬细胞Ym-1、Arg-1、Fizz-1 mRNA相对表达水平 取RAW264.7细胞,分组及诱导方法同上,贴壁生长过夜后,按照TRIzol 说明书提取细胞总RNA,按Primescript RT reagent Kit反转录试剂盒说明书降RNA反转录为cDNA。引物序列见表1,RT-PCR反应体系及条件参照SYBR Premix Ex TapTM 试剂盒(TaKaRa公司),以GAPDH 作为内参,以M0型巨噬细胞各目的基因的表达量为对照,采用2-ΔΔCT法计算mRNA 的相对表达量[8],每组实验重复3次。

表1 PCR引物序列Table 1 Primers for RT-PCR and their amplification size
1.3.8 Western blotting法检测M2型巨噬细胞、热疗(42 ℃)后M2型巨噬细胞Ym-1、Arg-1、Fizz-1的蛋白相对表达水平 诱导分组〔M2型巨噬细胞、热疗(42 ℃)后M2型巨噬细胞〕干预后,提取各组细胞总蛋白,Western blotting法检测热疗前后Ym-1、Arg-1、Fizz-1蛋白的相对表达水平。
1.3.9 Transwell法检测LLC、LLC+M2、LLC+M2+热疗(42 ℃)中LLC的侵袭、迁移能力 诱导分组〔LLC、M2型巨噬细胞与LLC共培养(LLC+M2)、LLC+M2+热疗〕干预后,按照Transwell说明书,调整细胞浓度后种在上室,下室加入培养液,放入培养箱8 h、24 h后分别进行细胞计数,观察M2型巨噬细胞、热疗(42 ℃)对LLC的侵袭、迁移能力的影响。
1.4 统计学方法 采用SPSS 26.0进行统计学分析。计量资料采用(±s)表示,每组实验重复3次,两组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同诱导分化状态下的巨噬细胞形态 显微镜下观察到M1型巨噬细胞形态,24 h后开始向周围放射状生长并伸出伪足,胞体由圆形变成纺锤状、梭形,细胞体积较M0型巨噬细胞大,在培养液中半贴壁生长;M2型巨噬细胞的体积较M0型巨噬细胞大,形状呈或类似成纤维状,伪足较M1型巨噬细胞短,呈聚团生长(见图1)。

图1 不同诱导分化状态下的巨噬细胞形态(结晶紫染色,×200)Figure 1 Macrophages morphology in different activation states
2.2 流式细胞术检测M0、M1、M2型巨噬细胞表面标志抗原CD86、CD206表达率 不同激活状态巨噬细胞M0、M1和M2 CD86表达率分别为6.13%±1.83%、3.24%±0.76%和16.46%±3.11%。M2型巨噬细胞CD86表达率高于M0、M1型巨噬细胞,差异均有统计学意义(P<0.001, 见 图 2)。M0、M1、M2型 巨 噬 细 胞CD206的表达率分别为3.87%±1.02%、1.01%±0.57%和41.83%±6.73%。M2型巨噬细胞CD206表达率高于M0、M1型巨噬细胞,差异均有统计学意义(P<0.001,见图3)。
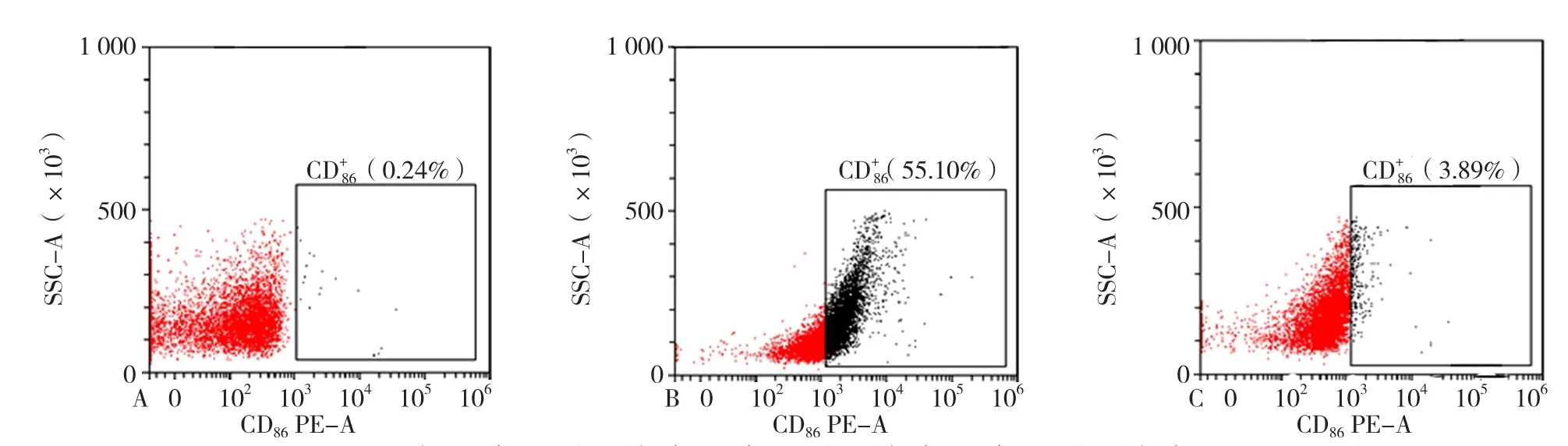
图2 不同诱导分化状态下巨噬细胞中CD86表达情况Figure 2 CD86 expression of different activated macrophages
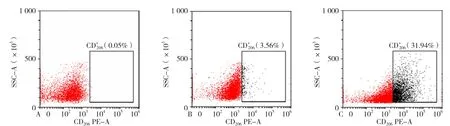
图3 不同诱导分化状态下巨噬细胞中CD206表达情况Figure 3 CD206 expression of different activated macrophages
2.3 ELISA法检测M0、M1、M2型巨噬细胞培养上清液中IL-10、IL-12分泌水平 ELISA法检测结果显示,M0、M1、M2型巨噬细胞上清液中培养IL-10分泌水平分别为(670±50)ng/L、(619±42)ng/L、(770±46)ng/L,IL-12分泌水平分别为(33±2)ng/L、(49±3)ng/L、(41±2)ng/L。M2型巨噬细胞IL-10分泌水平较M0和M1型巨噬细胞高,差异均有统计学意义(P<0.001);M1型巨噬细胞IL-12分泌水平较M0和M2型巨噬细胞高,差异均有统计学意义(P<0.001,见图4)。
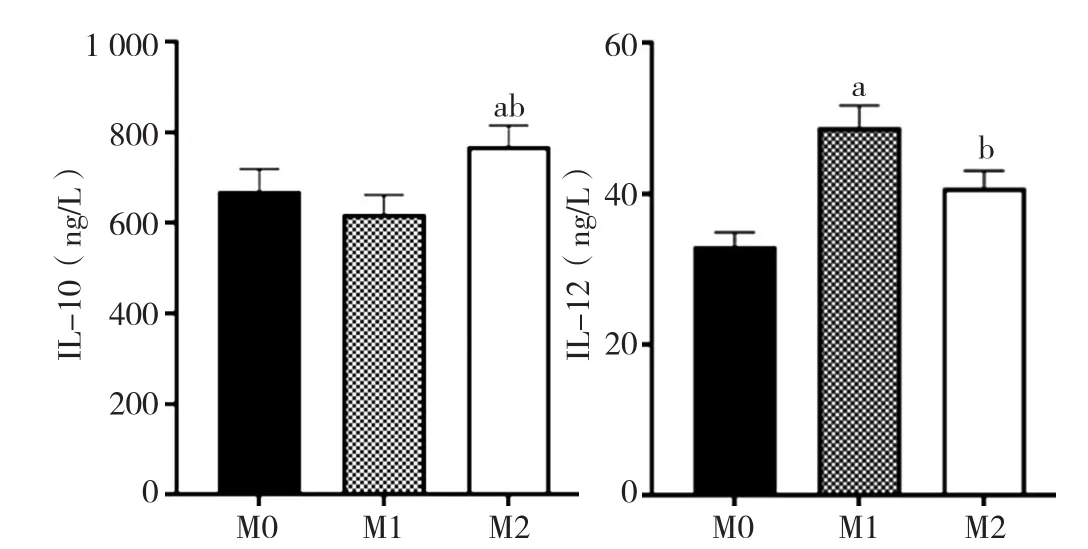
图4 不同诱导活化状态下巨噬细胞IL-10与IL-12的分泌水平Figure 4 The secretion levels of IL-10 and IL-12 in macrophages under different activation states
2.4 CCK-8法检测热疗(42 ℃)后M2巨噬细胞增殖活性 热疗后(41 ℃、42 ℃、43 ℃)M2型巨噬细胞的OD值低于37 ℃时的OD值,差异均有统计学意义(P<0.001)。72 h时42 ℃热疗对巨噬细胞增殖活性的抑制效果高于37 ℃、41 ℃、43 ℃时,差异均有统计学意义(P<0.001,见图5)。
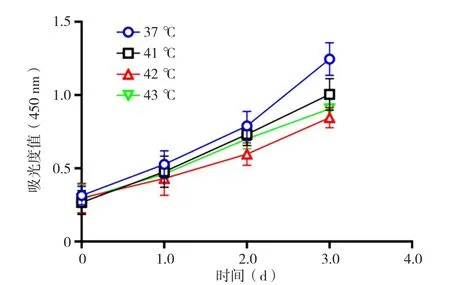
图5 不同温度的热疗对巨噬细胞增殖活性的影响Figure 5 The effect of hyperthermia at different temperatures on macrophage proliferation
2.5 RT-PCR检测M0、M2型巨噬细胞及热疗(42 ℃)后M2型巨噬细胞Ym-1、Arg-1、Fizz-1 mRNA的相对表达水平 M2型巨噬细胞的Ym-1、Arg-1、Fizz-1 mRNA相对表达水平高于M0型巨噬细胞,差异有统计学意义(P<0.001)。热疗(42 ℃)后M2型巨噬细胞的Ym-1、Arg-1 mRNA相对表达水平低于热疗前,差异有统计学意义(P<0.001,见图6)。

图6 M0型巨噬细胞、M2型巨噬细胞及热疗后M2型巨噬细胞相关因子的相对表达量Figure 6 Relative expression of M0 macrophages,M2 macrophages and M2 macrophages after hyperthermia related factors
2.6 Western blotting法检测M2型巨噬细胞、热疗(42 ℃)后M2型巨噬细胞Ym-1、Arg-1、Fizz-1蛋白相对表达水平 热疗(42 ℃)后M2型巨噬细胞Ym-1、Arg-1蛋白相对表达水平降低,差异有统计学意义(P=0.014,P=0.029,见图7)。
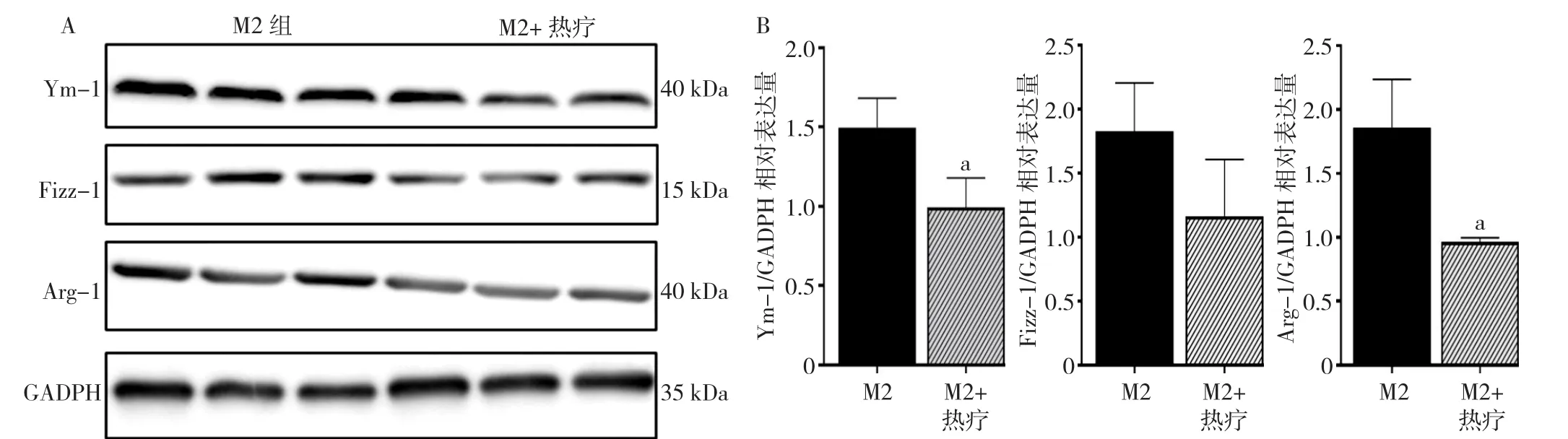
图7 M2巨噬细胞及热疗后M2巨噬细胞相关蛋白情况Figure 7 M2 macrophages and M2 macrophages after hyperthermia related proteins
2.7 Transwell法检测LLC、LLC+M2、LLC+M2+热疗(42 ℃)中LLC的侵袭、迁移能力
2.7.1 M2型巨噬细胞对LLC侵袭能力的影响 LLC和LLC+M2中LLC侵袭细胞数分别为:(38±4)个和(85±6)个。LLC+M2中LLC侵袭细胞数较LLC增多,差异有统计学意义(P<0.001,见图8)。
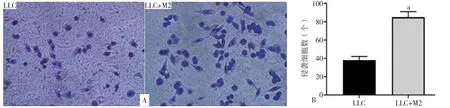
图8 M2型巨噬细胞对LLC侵袭能力的影响Figure 8 The effect of M2 macrophages on invasion ability of LCCs
2.7.2 热疗对LLC侵袭能力的影响 LLC+M2和LLC+M2+热疗中LLC侵袭细胞数分别为:(85±6)个和(24±4)个。LLC+M2+热疗中LLC侵袭细胞数较LLC+M2减少,差异有统计学意义(P<0.001,见图9)。
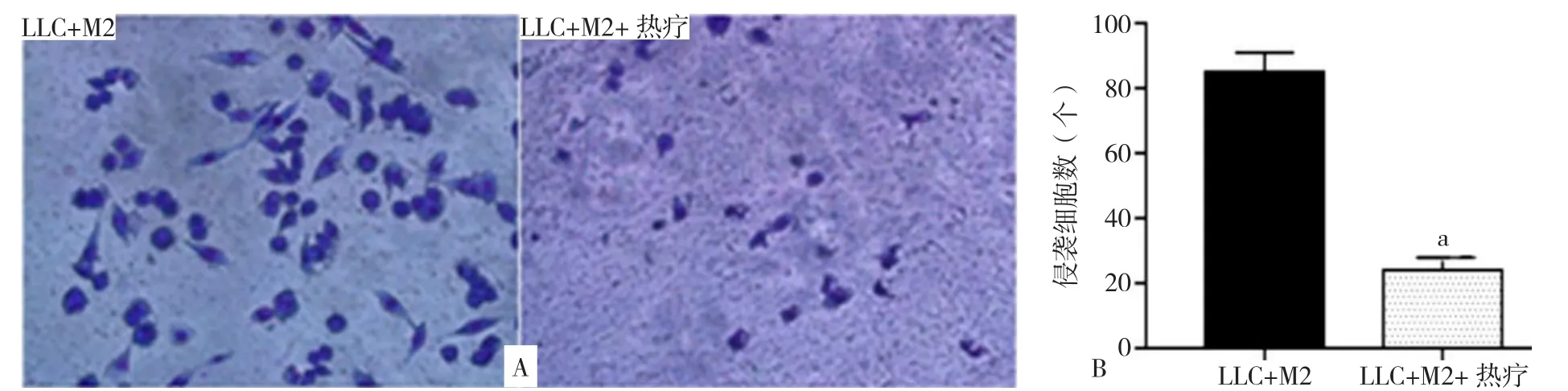
图9 热疗对LLC侵袭能力的影响Figure 9 The effect of hyperthermia on invasion ability of LCCs
2.7.3 M2巨噬细胞对LLC迁移能力的影响 LLC和LLC+M2中LLC迁移细胞数分别为:(92±5)个和(132±6)个。LLC+M2中LLC迁移细胞数较LLC增多,差异有统计学意义(P<0.001,见图10)。
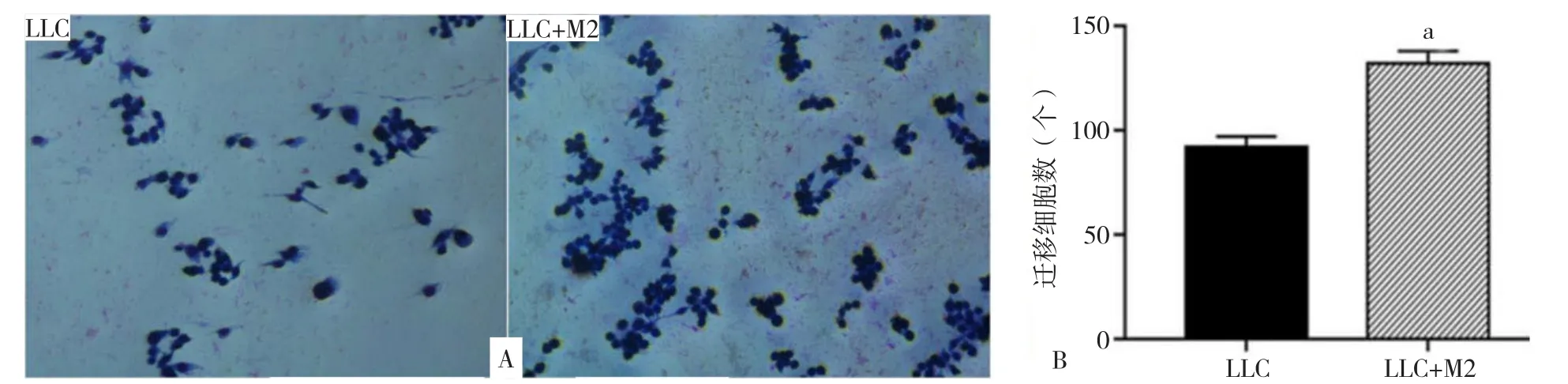
图10 M2型巨噬细胞对LLC迁移能力的影响Figure 10 The effect of M2 macrophages on migration ability of LCCs
2.7.4 热疗对LLC迁移能力的影响 LLC+M2和LLC+M2+热疗中LLC迁移细胞数分别为:(85±6)个和(24±4)个。LLC+M2+热疗中LLC迁移细胞数较LLC+M2减少,差异有统计学意义(P<0.001,见图11)。

图11 热疗对LLC迁移能力的影响Figure 11 The effect of hyperthermia on migration ability of LCCs
3 讨论
肿瘤相关巨噬细胞(TAMs)在微环境中对肿瘤的具体作用是双重且呈动态变化的,且作为微环境中重要的侵袭转移的关键驱动因素启动子,其几乎参与了肿瘤进展、侵袭转移所有的级联步骤。在越来越多的研究中报道[7,9],热疗能够通过调节肿瘤血流灌注、淋巴细胞的运输、炎性因子的表达、淋巴细胞与内皮细胞的相互作用,增强先天和适应性免疫功能从而积极广泛地影响肿瘤免疫微环境[10]。本实验表明42 ℃热疗可以抑制因子Ym-1、Arg-1、Fizz-1的mRNA及蛋白的相对表达水平,说明热疗能够使巨噬细胞的表型发生改变,减少M2型巨噬细胞的转化。
巨噬细胞在调节生理机能、维持各项功能的动态平衡、炎性反应中是不可或缺的一部分。特异性和可塑性是巨噬细胞的特点,在不同微环境和细胞因子的综合影响下,巨噬细胞可以极化成不同类型,即经典活化的M1型和替代活化的M2型。M1型具有释放促炎因子、调节Th1型免疫、抗原的提呈等功能;而M2型则表现出“抑炎”功能,可以促进血管生成和组织修复。IL-4、IL-13等均可刺激巨噬细胞实现M2型极化,STAT6信号通路在被IL-4/IL-13激活后可以增加M2型极化所必需的相关基因表达,如Ym-1、Fizz-1、Agr-1[11]。STAT6 是 IL-4/IL-13 介导的 M2 型巨噬细胞极化的关键转录因子。IL-4和IL-4Rα结合激活 Janus 激酶1(Janus kinase 1,JAK1)/JAK3或JAK1/酪氨酸激酶2(tyrosine kinase 2,Tyk2),促进胰岛素受体底物(insulin receptor substrate,IRS)的聚集,进而使 STAT6 酪氨酸磷酸化并形成二聚体,进入细胞核启动M2型巨噬细胞相关基因表达,调节包括 Arg-1、CD206、Fizz-1及Ym-1在内的相关因子的表达[12]。本研究采用侵袭和迁移实验,首先观察M2型TAMs对LLC共培养后的侵袭、迁移能力的变化。通过Transwell共培养的结果观察到,M2型巨噬细胞对促进LLC细胞的侵袭与迁移作用明显,与既往研究报道相符[13]。在此基础上,行42 ℃水浴加热干预,结果提示热疗能够抑制LLC的侵袭和迁移。在ZHANG等[14]的研究中发现缺氧微环境能够通过ERK信号的激活使巨噬细胞从M1型向M2型偏转,从而促进LLC在体内和体外的侵袭转移。由于缺氧能够介导侵袭性肿瘤行为,促使M1型向M2型TAMs表型的极化,而热疗能够改善肿瘤组织乏氧环境已被许多研究所明确,所以推测热疗可能是通过对乏氧的改善从而抑制LLC的侵袭与迁移,但具体机制是怎样的?仍需要更多的研究进一步阐明。
综上所述,热疗在TME中有着重要的免疫调节功能,探讨热疗调控肿瘤相关巨噬细胞极化的相关机制,不仅有利于对肿瘤发生发展过程的认识,还可以通过合理干预巨噬细胞极化过程中的某些关键步骤,扭转M1/M2型巨噬细胞间偏移的极化失衡状态,可为治疗多种肿瘤提供新的角度和思路。
作者贡献:饶紫琦进行文章的构思与设计,数据收集,统计学处理,结果的分析与解释,撰写论文;刘菁进行研究的实施与可行性分析;陈炳林进行数据整理;邓永然进行论文的修订;刘文其负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。

