丹参酮ⅡA对心肌缺血再灌注损伤的保护作用及对JAK2/STAT3通路的影响
王 煜
缺血-再灌注损伤(ischemia/reperfusion injury,IRI)是指缺血组织器官恢复血流后,不仅组织器官功能未恢复,反之,缺血进一步加重功能、代谢障碍和结构破坏,甚至出现不可逆。目前研究较多的是心肌缺血-再灌注损伤(myocardial ischemia/reperfusion injury,MIRI),特别是老年人MIRI。IRI发生过程复杂,涉及多种病理生理过程,最终对心脏造成损害[1]。Janus激酶2(Janus kinase 2,JAK2)/信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)是一条重要的细胞内信号通路,涉及细胞增殖、分化、凋亡、自噬和炎症反应等过程,已有研究证明,其与MIRI密切相关[2-3]。有研究发现,通过激活JAK2/STAT3可发挥心肌细胞保护作用,减少凋亡[4-5]。丹参酮ⅡA(tanshinone ⅡA,TA)是从中药丹参中分离提取得到的一种脂溶性二萜醌类成分,具有抗炎、抗氧化、抗肿瘤和抗心肌缺血等作用,且毒副作用较低。有研究表明,TA通过丝裂原活化蛋白激酶/细胞外信号调节激酶/雷帕霉素靶蛋白(MEK/ERK/mTOR)通路改善肝脏IRI[6];通过Toll样受体4/核因子κB(TLR4/NF-κB)通路改善缺血缺氧性脑病[7];通过p38促丝裂原活化蛋白激酶(MAPK)信号通路改善肾脏IRI[8]。Pan等[9]发现,TA通过改善炎症损伤和凋亡,增加自噬,从而改善大鼠MIRI并提高心功能。Li等[10]研究证实,TA通过激活磷脂酰肌醇-3-激酶/蛋白激酶B/雷帕霉素靶蛋白(PI3K/Akt/mTOR)通路从而改善MIRI。为进一步明确TA对MIRI的影响及机制,本研究观察TA对老年MIRI大鼠及缺氧/复氧损伤(hypoxia/reoxygenation injury,HRI)心肌细胞的影响,并探讨JAK2/STAT3抑制剂AG490对心肌细胞的保护作用,现报道如下。
1 材料与方法
1.1 实验动物、细胞与试剂 取24只健康老年雄性Wistar大鼠,18个月龄,体重(355.62±20.35)g,购自北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2006—2009。取出生48 h内的Wistar大鼠8只,分离原代心肌细胞,培养于含10%胎牛血清的DMEM培养基中,置于37 ℃、5%CO2恒温箱中培养。实验试剂:TA(南京清泽医疗科技有限公司),Evan′s蓝染液(美国Sigma公司),氯化三苯基氮四唑 (TTC)溶液(美国Sigma公司),胎牛血清和DMEM培养基(上海联合赛尔生物工程有限公司),四甲基偶氮唑盐微量酶反应比色法(MTT)检测试剂盒(上海碧云天生物技术有限公司),TUNEL原位细胞凋亡检测试剂盒(生工生物工程有限公司),DCFH-DA活性氧ROS荧光探针(上海懋康生物科技有限公司),抗体(美国Sigma公司),乳酸脱氢酶(LDH)细胞毒性分析试剂盒(艾美捷科技有限公司)。
1.2 老年大鼠MIRI模型的建立及分组 术前禁食12 h,使用苯巴比妥麻醉大鼠,于胸骨左侧第3肋与第4肋间作一纵向切口,剪断第3根肋骨,暴露心脏,结扎左心耳下缘与肺动脉圆锥之间左冠状动脉前降支中下1/3,结扎45 min后再灌注24 h[11]。将24只大鼠随机分为3组。假手术组(Sham组)不进行冠状动脉结扎;MIRI组,术前经颈外静脉注射生理盐水,之后建立MIRI模型;MIRI+TA组,术前经颈外静脉注射20 mg/kg TA[10],之后建立MIRI模型。模型建立后,采用超声心动图测定所有大鼠心功能,包括射血分数、缩短分数。
1.3 心功能指标检测 采用全自动生化检测仪检测大鼠血清肌酸激酶(creatine kinase,CK)、LDH。
1.4 心肌梗死面积 应用Evan′s蓝染液和TTC染色法测定心肌梗死范围,将0.2~0.3 mL的2%Evan′s蓝染液注入右颈静脉,明确缺血损伤危险区域(area at risk,AAR)。再灌注结束时迅速取出大鼠心脏,使用磷酸缓冲盐溶液(PBS)冲洗,-20 ℃条件下冷冻30 min。将左心室(LV)切成5块,置于1% TTC中孵育15 min,之后使用10%甲醛固定。显微镜下观察梗死区(the infarct area,INF,白色)和AAR(红色)。
1.5 细胞HRI模型的建立及分组 将细胞暴露于缺氧条件下(1%O2、5%CO2、94%N2)3 h,之后复氧(95%O2、5%CO2)3 h。将细胞分为4组:对照组、HRI组(缺氧3 h后复氧3 h)、HRI+TA组(HRI前应用10 μmol/L TA预处理)[12]、HRI+TA+AG490组(HRI前应用10 μmol/L TA和20 μmol/L AG490预处理)。
1.6 细胞活力检测 将细胞按1×103/孔接种于96孔板上,每孔100 μL,CO2恒温培养箱中培养72 h。避光条件下每孔加入MTT溶液10 μL,37 ℃条件下培养3 h,酶标仪(波长设置为450 nm)上测定吸光度(OD)值,评价细胞存活率。LDH检测采用LDH细胞毒性分析试剂盒。
1.7 细胞凋亡检测 应用TUNEL试剂盒检测凋亡。样品中加入5 μL TUNEL反应混合物,载玻片于37 ℃避光条件下孵育60 min,之后应用PBS冲洗3次,5 min。为检测细胞核,将细胞在室温避光条件下使用4′,6-二脒基-2-2-苯基吲哚(DAPI)孵育5 min,PBS洗涤3次,之后应用荧光显微镜观察。以TUNEL阳性细胞数与DAPI阳性细胞数比值反映凋亡情况。
1.8 抗氧化指标检测 应用流式细胞术检测心肌细胞内活性氧(ROS)含量,将细胞接种于6孔板,培养24 h后加入10 μmol/L的DCFH-DA 1 mL荧光探针溶液,之后洗涤3次,应用PBS重悬并计数,取含有2×105个细胞悬浮液,使用流式细胞仪检测。应用全自动生化检测仪检测细胞上清液丙二醛(malondialdehyde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)。
1.9 免疫印迹法(Western Blotting)检测蛋白 Western Blotting检测p-JAK2、p-STAT3、JAK2、STAT3及凋亡相关蛋白Bcl-2、Bax、cleaved Caspase-3。样品中加入SDS缓冲液煮沸5 min使蛋白变性。经凝胶电泳(SDS-PAGE)后将蛋白转移至聚偏二氟乙烯(PVDF)膜上,使用5%脱脂奶粉封闭1 h,孵育一抗,4 ℃过夜,弃去一抗,TBST洗膜3次,每次5 min。室温孵育二抗2 h,弃去二抗,TBST洗膜3次,每次5 min。ECL显色,以GAPDH作为内参,计算目标蛋白条带与GAPDH灰度比值。

2 结 果
2.1 TA改善心肌细胞HRI 与对照组比较,HRI组心肌细胞增殖活性明显降低,而LDH释放增加(P<0.05),经TA预处理可预防这些病理损伤。详见图1A和图1B。TUNEL检测结果显示,经TA预处理可改善HRI心肌细胞凋亡(P<0.05)。详见图1C和图2。
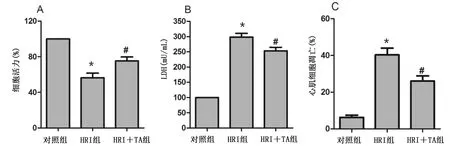
与对照组比较,*P<0.05;与HRI组比较,#P<0.05。图1 TA改善心肌细胞HRI(A为MTT法检测TA对心肌细胞活力的影响;B为TA对心肌细胞释放LDH的影响;C为TUNEL检测TA对心肌细胞凋亡的影响)
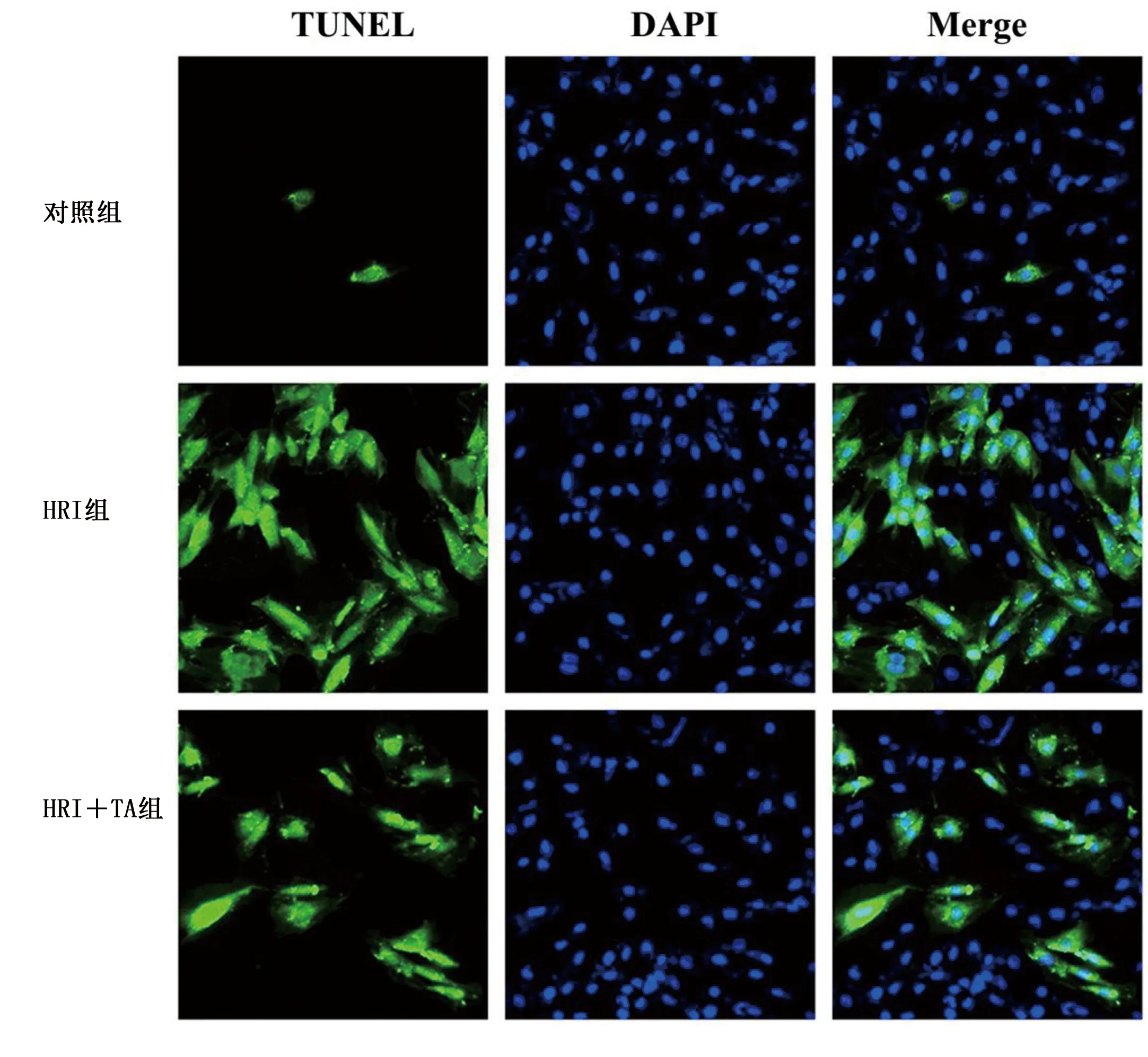
图2 TUNEL法检测细胞凋亡(×400)(Merge为TUNEL与DAPI叠加图像)
2.2 TA改善老年大鼠MIRI 与MIRI组比较,MIRI+TA组大鼠心脏梗死面积较小(P<0.05),详见图3。TA改善MIRI大鼠心肌组织细胞凋亡(P<0.05),详见图4。与Sham组比较,MIRI组大鼠射血分数、缩短分数明显较低,而血清CK、LDH升高(P<0.05),经TA预处理可预防上述病理改变(P<0.05),详见图5。
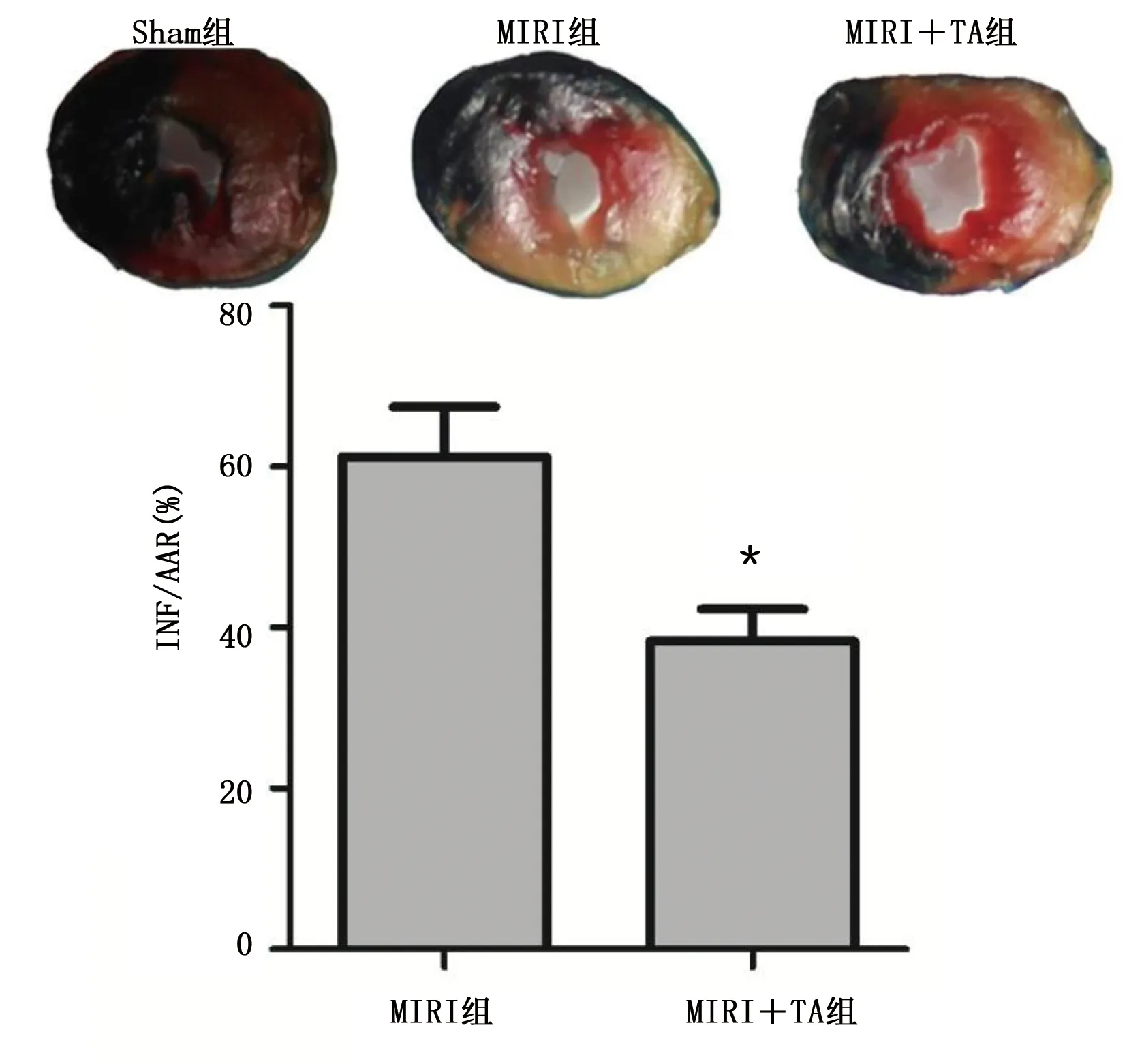
与MIRI组比较,*P<0.05。图3 TA改善大鼠心肌梗死面积
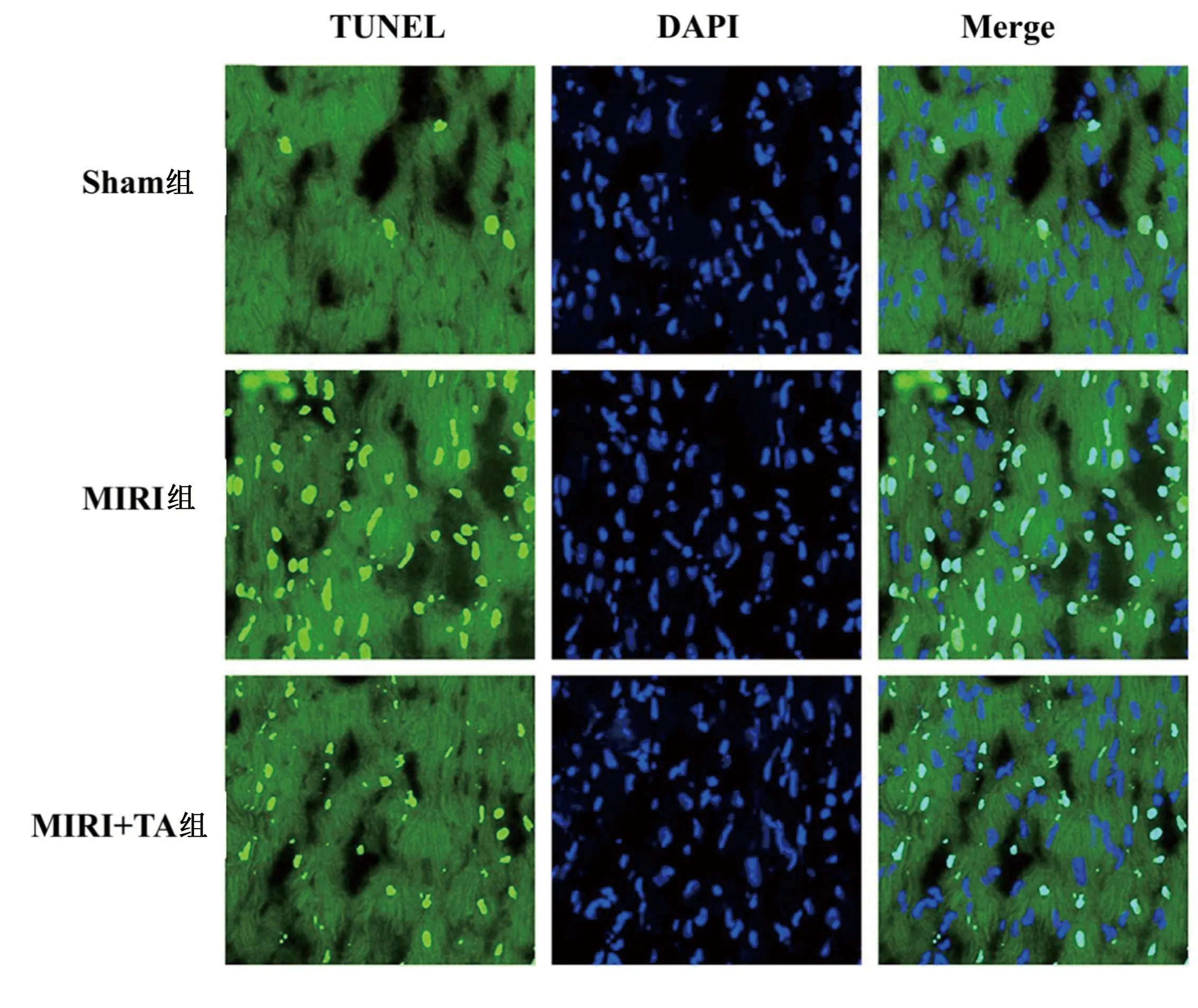
图4 TUNEL检测TA对心肌组织细胞凋亡的影响(×400)(Merge为TUNEL与DAPI叠加图像)
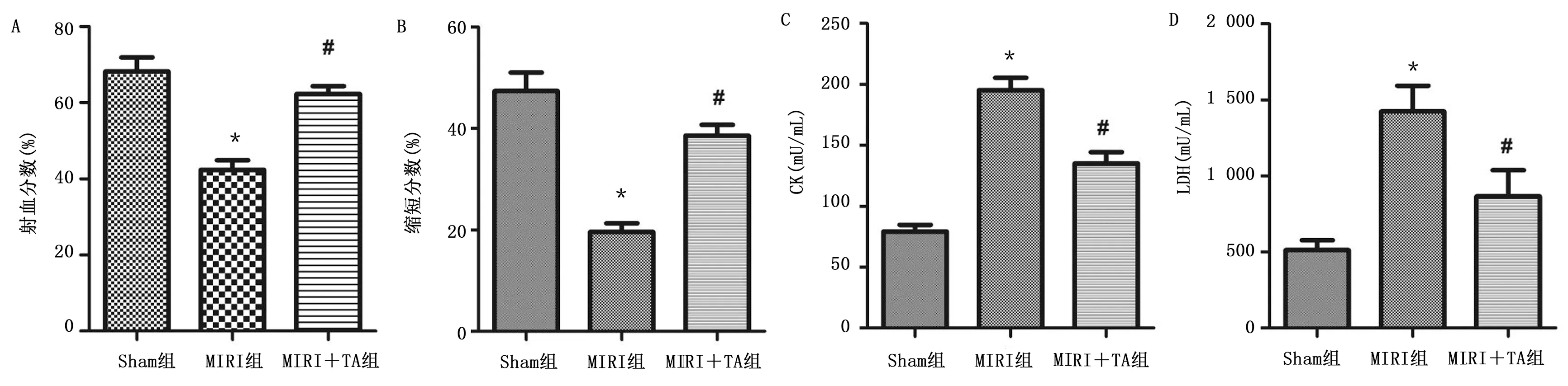
与Sham组比较,*P<0.05;与MIRI组比较,#P<0.05。 图5 各组射血分数、缩短分数、血清CK和LDH比较
(A为射血分数;B为缩短分数;C为CK;D为LDH)
2.3 TA改善心肌细胞的抗氧化能力 与对照组比较,HRI组ROS荧光强度和MDA增高,而SOD降低,TA预处理可预防上述指标改变(P<0.05),说明TA可提高HRI心肌细胞抗氧化能力。详见图6。
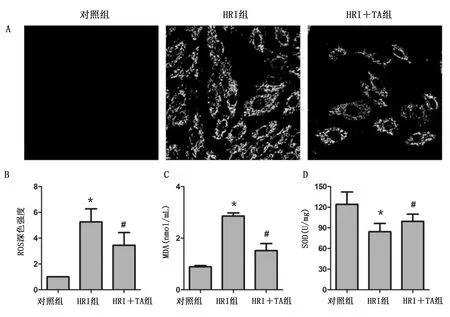
与对照组比较,*P<0.05;与HRI组比较,#P<0.05。 图6 TA增强心肌细胞的抗氧化能力(A为DCFH-DA检测细胞内ROS; B为ROS荧光染色强度;C为细胞培养上清液MDA;D为细胞培养上清液SOD)
2.4 TA通过调控JAK2/STAT3通路减轻心肌细胞HRI JAK2/STAT3通路抑制剂AG490可抵消TA对心肌细胞的保护作用。与HRI组比较,HRI+TA组p-JAK2和p-STAT3表达水平升高,而AG490可抵消TA的作用(P<0.05)。HRI+TA组凋亡蛋白Bcl-2/Bax比值高于HRI组, cleaved Caspase-3低于HRI组,AG490可逆转上述变化(P<0.05)。详见图7、图8。上述结果说明,TA可能通过JAK2/STAT3通路降低HRI心肌细胞的凋亡。
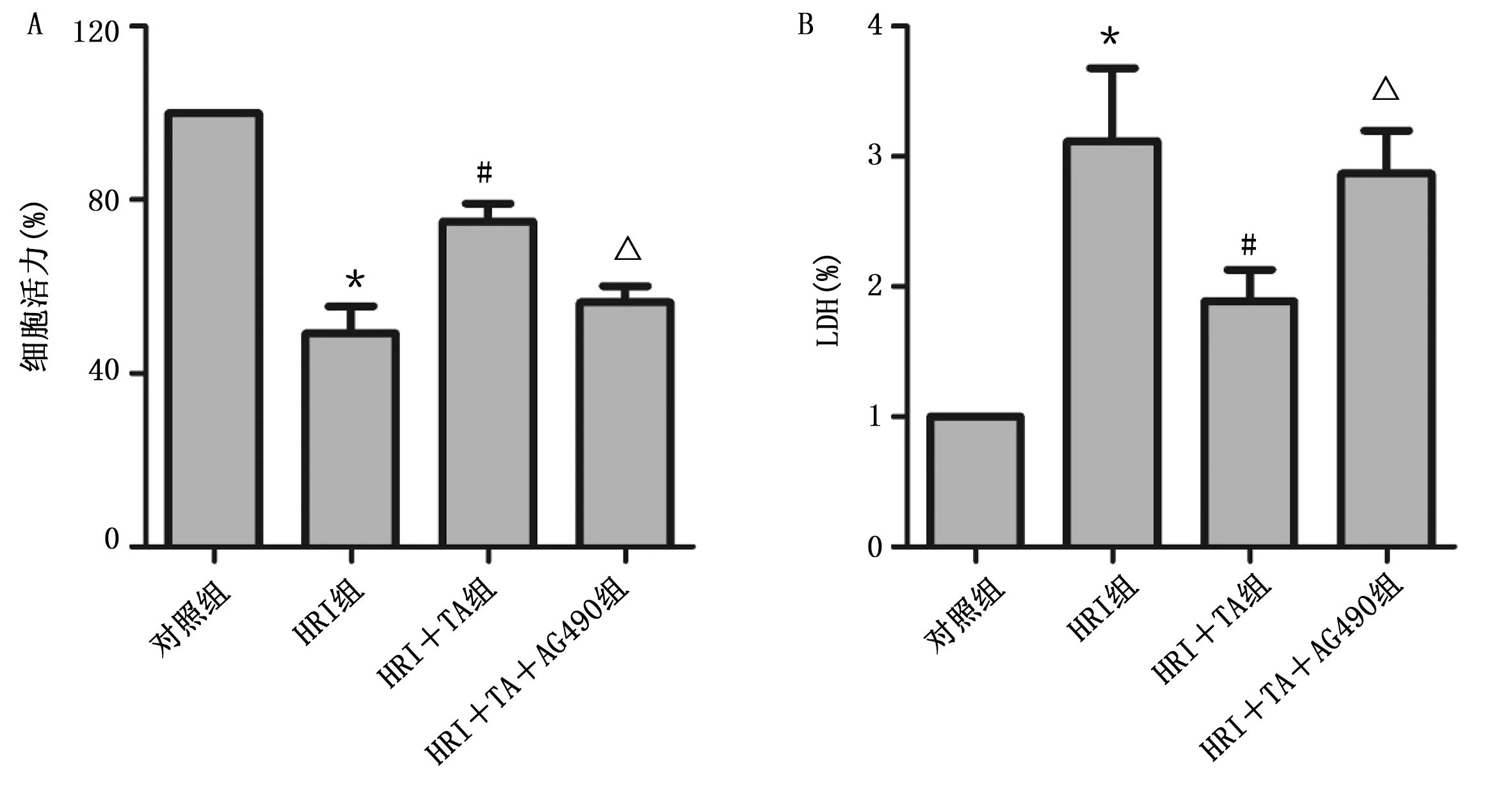
与对照组比较,*P<0.05;与HRI组比较,#P<0.05;与HRI+TA组比较,△ P<0.05。图7 TA和JAK2/STAT3通路抑制剂AG490对心肌细胞活力和LDH的影响(A为心肌细胞活力;B为LDH)
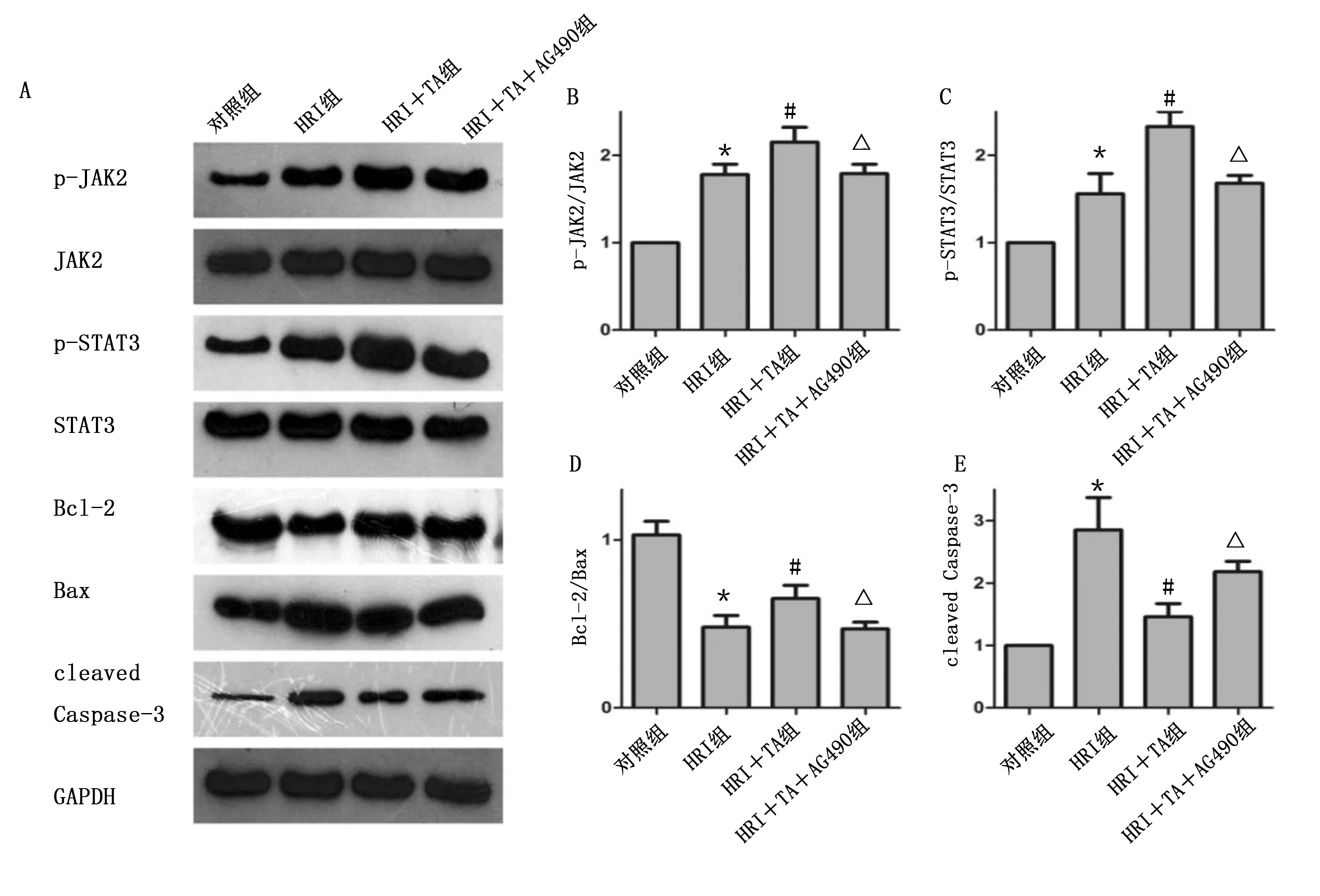
与对照组比较,*P<0.05;与HRI组比较,#P<0.05;与HRI+TA组比较,△ P<0.05。图8 TA和JAK2/STAT3通路抑制剂AG490对心肌细胞相关蛋白表达的影响(A为Western Blotting检测p-JAK2、JAK2、p-STAT3、STAT3、Bcl-2、Bax、cleaved Caspase-3蛋白表达电泳图;B为p-JAK2/JAK2比值;C为p-STAT3/STAT3比值;D为Bcl-2/Bax比值;E为cleaved Caspase-3)
3 讨 论
TA是从中药丹参中分离提取到的一种脂溶性二萜醌类成分,传统认为TA具有活血调经、祛瘀消肿和安神宁心等作用,药理研究表明,TA具有心血管保护的作用,其机制可能与抗缺血、抗心律失常、抗动脉粥样硬化、调脂和抑制凝血等有关[13]。本研究结果表明,TA通过JAK2/STAT3通路减少心肌细胞凋亡从而改善IRI,并对心功能有一定保护作用。
相关研究发现,线粒体ROS产生异常与心血管疾病有关[14]。线粒体过度产生ROS可能造成氧化应激,与心脏缺血性疾病病理生理过程相关。缺血引起的细胞变化包括H+、Ca2+积聚和线粒体膜电位破坏,导致ROS产生[15]。ROS积聚可直接激活应激反应,造成细胞凋亡[16]。本研究结果显示,TA可预防HRI造成的ROS产生和细胞凋亡。氧自由基在心肌缺血再灌注损伤中的作用已证实。氧自由基诱导脂质过氧化后产生的MDA具有较强的交联能力,导致多种酶失活。MDA反映细胞损伤程度;SOD是体内重要的抗氧化酶,是天然的自由基清除因子,对维持机体氧化/抗氧化平衡具有重要作用。本研究结果显示,TA可提高细胞SOD水平,并降低MDA水平,提示TA对HRI有明显保护作用。
细胞凋亡是为维持内环境稳定,由基因控制的细胞自主有序的死亡。经典凋亡途径包括外源性死亡受体途径和内源性线粒体途径,特点是Caspases激活,特别是Caspase-3。阻断细胞凋亡过程可防止细胞大量丢失,减少IRI引起的心脏损伤,进而缓解甚至预防心力衰竭发生[17]。本研究结果发现,TA可抑制IRI后心肌细胞凋亡。Cui等[18]体外研究发现,TA可调节凋亡相关蛋白p53、Bax、Caspase-3和Bcl-2表达,抑制心肌微血管内皮细胞凋亡,进而改善HRI。动物研究发现,TA可改善MIRI大鼠心肌组织细胞凋亡,并缩小心肌梗死面积,对大鼠心功能有一定保护作用。
JAK/STAT可改变IRI发生、发展和转归[19]。有研究发现,早期IRI、钙超载引起线粒体通透性转换孔开放,导致线粒体肿胀和破裂,进而释放细胞色素C及凋亡诱导因子等,启动凋亡和死亡级联反应[20]。JAK/STAT通路激活抑制细胞凋亡,保护心肌细胞。JAK2/STAT3是JAK/STAT通路中重要的成员之一,在MIRI保护机制中起核心作用[21-22]。本研究结果发现,TA可提高HRI心肌细胞Bcl-2/Bax,降低cleaved Caspase-3,说明TA具有抗凋亡作用。应用JAK2/STAT3通路抑制剂AG490可抵消TA的抗凋亡作用,证实TA通过JAK2/STAT3通路减少心肌细胞凋亡。
综上所述,本研究观察TA对IRI的保护作用,为TA在体内外调节心肌细胞凋亡提供了基础研究证据,TA可能通过激活JAK2/STAT3通路减少心肌细胞凋亡而改善IRI。

