Hangman 骨折的诊断与治疗进展
张腾飞 梅伟
Hangman 骨折是指在急剧过伸过屈和轴向暴力作用下枢椎上下关节突间部发生的骨折,常伴有周围韧带及椎间盘的损伤,继发枢椎椎体的不稳或脱位,通常由交通事故伤或坠落伤造成。因其是发生于枢椎峡部的垂直或斜行骨折,可使枢椎峡部后方和椎体分离,进而引发枢椎椎体滑移,所以也称为创伤性枢椎滑脱 ( traumatic spondylolisthesis of the axis,TSA )。据相关数据统计,Hangman 骨折约占枢椎骨折的 23%~27%,颈椎骨折的 4%~7%,病死率约 7%[1-4]。对于 Hangman 骨折,如何针对不同分型选择合适的治疗方法,是脊柱外科当下的研究热点之一。
一、分型
自 1965 年 Schneider 首次报道了 Hangman 骨折这一损伤类型后,关于其具体描述尚未有确切定论,Verheggen等[5]将 Hangman 骨折称为枢椎椎弓骨折;Müller 等[6]将Hangman 骨折称为创伤性枢椎前滑脱;Coric 等[7]认为Hangman 骨折是指发生在枢椎上下关节突骨质连接区域的骨折,这一定义后被广泛认同。1985 年,Levine 等[8]在Effendi 分型的基础上根据致伤机制、骨折形态及稳定程度将 Hangman 骨折分为四种类型 ( 图 1 )。Ⅰ 型:C2相对于C3移位 < 3 mm 且无成角,致伤机制为过伸和轴向压缩负荷,椎间盘及前后纵韧带无明显损伤;Ⅱ 型:C2相对于C3移位 > 3 mm 伴移位后椎体成角,致伤机制为过伸压缩负荷损伤前纵韧带后,额外的屈曲负荷又导致后纵韧带和椎间盘损伤,加重椎体的移位成角;Ⅱa 型:Ⅱ 型骨折的变型,C2、C3间严重的成角伴轻微的移位,骨折线从前下到后上斜行通过关节突连接区域,致伤机制为屈曲合并轴向牵引负荷,因明显的屈曲作用力,前方韧带复合体常保持完好;Ⅲ 型:椎体明显移位和成角,伴单侧或双侧关节突脱位,致伤机制为高能量屈曲负荷致后方关节交锁,额外的伸展和轴向负荷致关节突间部骨折[9]。
1993 年,Starr 等[10]将 Hangman 骨折中骨折线波及椎体后壁的特殊类型称为“不典型 Hangman 骨折”。Al-Mahfoudh 等[11]将不典型 Hangman 骨折分为三类,1 型:骨折线沿冠状位平行于椎体后壁,枢椎环完整或不完整;2a 型:单侧斜形骨折伴椎体后壁破损,对侧峡部骨折;2b 型:单侧斜形骨折伴椎体后壁破损,对侧椎板骨折。王清等[12]根据骨折部位将其大致分为单侧椎体后壁骨折和双侧椎体后壁骨折,包括按照骨折线与椎体后壁的垂直平行关系等损伤形态分类的四种亚型。不典型Hangman 骨折较为复杂,目前尚无确切的分型方法,统一系统的分类标准还须大样本的临床研究。
一般认为大多数 Ⅰ 型骨折为稳定性骨折,Ⅱ 型、Ⅱa 型、Ⅲ 型、不典型 Hangman 骨折为不稳定性骨折,基于骨折稳定性的分型对临床指导治疗有重要意义[13]。
二、诊断
Hangman 骨折的临床表现多无特殊性,诊断较依赖于影像学检查。车祸、跳水、坠落等是常见的致伤原因,可见患者头面部不同程度的挫伤。骨折后枢椎前后结构分离椎管矢状径增加,相当于形成一个“间接减压”的环境,可仅表现为颈部疼痛僵硬及活动受限,多不伴有神经功能障碍。
常规动力位 X 线片可提供骨折稳定情况的有效信息,但急性期内的屈伸活动可能存在加重脊髓损伤的风险,Hangman 骨折在静态侧位和斜位 X 线片下,可对骨折线和移位成角情况作大致判断,但不能作为惟一诊断依据[13-15]。Ⅲ 型骨折因其特殊的解剖变化,X 线表现较易诊断,而对于一些 Ⅱ 型、Ⅱa 型骨折,可存在创伤后的自发性复位或在仰位摄片时的暂时性复位,骨折线不易发现,易将移位较轻的 Ⅱ 型骨折误诊为 Ⅰ 型稳定性骨折[16-17]。在常规 X 线诊断不明确的情况下,CT 能较好地显示骨折线特点和椎管内变化情况,特别是当骨折线不对称或累及椎体时。CT 扫描下椎体前缘的小骨碎片可能提示前纵韧带断裂后 C2椎体下缘或 C3椎体上缘的骨性撕脱,这是一个明显的不稳定性指标。三维重建可对骨折形态进行整体评估,可避免 X 线检查的误诊和漏诊。骨折后椎体的稳定性与 C2~3椎间盘及前、后纵韧带密切相关。由于椎间盘损伤后自我修复能力较差,轻者仅表现为纤维环断裂,重者可致纤维环、软骨终板破裂和髓核突出,故椎间盘是判定稳定性的关键因素。MRI 可了解脊髓及椎间盘、韧带等软组织,判断椎间盘的损伤状况。Xie 等[15]报道了一些最初被诊断为 Ⅰ 型骨折的患者通过 MRI 均检测出不同程度的前纵韧带及 C2~3椎间盘损伤,同时术中证实了后纵韧带完全或不完全断裂或撕裂,后方韧带复合体 ( posterior ligamentous complex,PLC ) 存在不稳定因素。在 X 线或 CT上缺乏明确的不稳定性指标的情况下,稳定性的验证对于预防保守治疗的不良结果至关重要[15]。
椎动脉损伤 ( vertebral artery injuries,VAI ) 是不稳定性 Hangman 骨折的并发症之一,累及横突孔的骨折碎片或严重的脱位会损伤牵拉椎动脉,导致单侧或双侧的椎动脉激惹痉挛或内膜破裂,轻者出现头晕等一过性症状,重者双侧椎动脉栓塞可致猝死。Ding 等[18]研究认为 VAI 发生率与 C2骨折类型无相关性,但在 TSA 中 Ⅰ型、Ⅱ 型、Ⅱa 型的发生率分别为 4.5%、9.1%、13.6%,证明 VAI 发生率与骨折不稳定性有关。椎动脉血管成像( magnetic resonance angiography,MRA ) 和椎动脉血管造影( computed tomography angiography,CTA ) 能够有效帮助诊断 VAI,防止发生严重的并发症[19]。VAI 引起的神经系统症状可在原发损伤后几小时或几天后出现,对于 CT 扫描下横突孔不完整,怀疑 VAI 的患者,入院后常规行 CTA是有必要的[20-22]。
总之,应明确外伤史并结合影像学表现进行诊断,除X 线片外常规应用 CT、MRI 检查,以对 Hangman 骨折稳定性的判定进行补充,必要时行 MRA 检测 VAI 情况。
三、治疗
Hangman 骨折的治疗目的是通过适当的固定方法使骨折断端愈合,重建颈椎的生理曲度并恢复正常的生理功能,治疗方法分为非手术治疗和手术治疗。
1. 非手术治疗:在内固定技术应用于 Hangman 骨折之前,主要以保守治疗为主[5,23]。Ⅰ 型骨折属于稳定性骨折,多无明显的成角移位,椎间盘韧带和后方关节结构稳定,骨折区域松质骨血运丰富,通过 2 周的枕颌带牵引或颅骨牵引后,佩戴头颈胸支具或 Halo 外固定架至骨愈合,一般能获得良好的疗效[5,9]。颅骨牵引可起一定的固定和复位作用,通过牵引后 X 线片亦可判定椎间隙有无增宽,可提示椎间盘是否受损。Ⅱ 型、Ⅱa 型骨折属于不稳定性骨折,保守治疗往往效果较差。Ⅱ 型骨折视稳定程度牵引复位后行外固定。Ⅱa 型骨折由于损伤机制为屈曲加轴向牵引负荷,成角明显,再牵引会导致成角加重,脊髓受压风险加大,故多用 Halo 固定架在 X 线透视监测下适当加压,复位后继续用 Halo 架固定 3 个月。一些学者认为,手术干预只适用于 Ⅲ 型骨折或 Ⅱ 型、Ⅱa 型保守治疗后期出现慢性不稳定的患者。Vaccaro 等[23]研究认为对 Ⅱ 型和 Ⅱa 型骨折,在牵引复位后行 Halo 架固定是一种有效的治疗手段,成角程度决定固定时间,若成角 ≥12° 则通过延长牵引时间确保骨愈合。也有一些研究认为Halo 架稳定效果远远低于内固定[24],骨折断端往往固定不稳,60% 的 Ⅱ 型和 Ⅱa 型保守治疗患者可出现 C2~3假关节及后凸畸形,椎间不稳远期可产生颈肩部疼痛等轴性症状[5,8,25]。同时,较长的治疗周期会引起颈部压疮、固定钉孔感染、患者的心理恐惧等问题。Niemeier 等[26]报道了 63 例不典型 Hangman 骨折的保守治疗效果,认为对排除椎间盘韧带损伤因素且移位 < 5 mm、成角 < 15° 的患者行保守治疗有效。Al-Mahfoudh 等[11]认为不典型 Hangman骨折的非手术治疗仅适用于骨折线垂直于 C2椎体后壁的骨折。但多数学者认为,不典型 Hangman 骨折有较大的不稳定性,由于椎体后壁缺损,骨折碎片和软组织嵌顿,难以获得闭合性复位[27]。随着现代医疗和内固定材料技术的提升,患者对健康及生活质量要求提高,手术指征逐渐放宽,多数学者认为对不稳定性 Hangman 骨折应尽早行骨折复位内固定手术[14-15]。
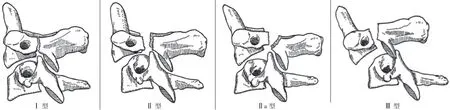
图 1 Hangman 骨折的 Levine-Edwards 分型Fig.1 Levine-Edwards classification of Hangman fracture
2. 手术治疗:非手术治疗不稳定骨折有很高的治疗失败率,手术治疗的主要目的是早期复位固定骨折断端,增加骨愈合率,提高愈合速度[25],同时通过内固定或融合技术解决不稳定因素带来的并发症。目前有关 Hangman 骨折的手术选择仍具有一些争议性,各有利弊 ( 表 1 )。常用的手术方法有颈前路椎间盘切除固定融合术 ( anterior cervical discectomy and fusion,ACDF )、后路椎弓根螺钉固定术、后路钉棒固定融合术和前后路联合固定术等。
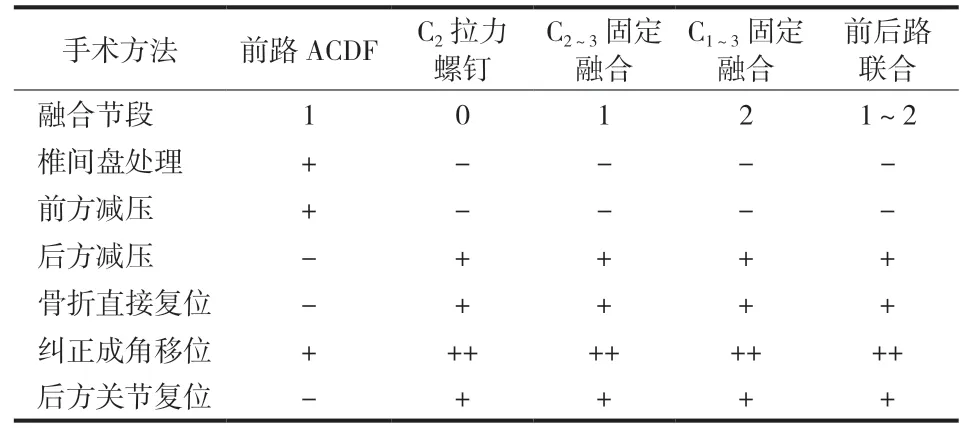
表 1 不同手术方法的优点和缺点Tab.1 Advantages and disadvantages of different surgical methods
( 1 ) 前路手术:前路手术未直接固定骨折断端,而是通过稳定 C2椎体间接达到骨愈合目的,属于间接固定。C2~3椎间盘损伤是不稳定的决定性因素,前路 ACDF 能够直接切除受损的椎间盘,解除颈髓前方压迫,C2~3融合形成长期稳态,有效维持颈椎正常序列。手术入路分为经口入路、经咽后入路和标准前入路 ( Smith-Robinson 入路 )。Wilson 等[28]早期报道了 Hangman 骨折的经口入路手术方法,但由于术后感染率高所以应用普遍受限。高位前方咽后入路是在下颌下方做一与下颌水平平行切口,切除下颌下腺,在下颌三角内,形成以上方舌下神经、外侧颈动脉鞘和下方喉上神经组成的框架结构。任先军等[29]对8 例不稳定性 Hangman 骨折行前咽后入路接骨板固定融合术,均获得植骨融合、无椎体成角移位。该入路对技术要求性较高,术中的牵拉可能造成舌下神经、面神经下颌支和喉上神经损伤[30],需要外科医生掌握专业的解剖学知识。有学者建议切除下颌下腺以避免前入路对神经的牵拉损伤,但下颌下腺的切除常伴有各种术后短期或长期并发症,常见并发症如神经功能障碍、唾液腺瘘和瘢痕问题等[31]。经咽后入路能充分显露 C1~3椎体,尤其适用于需要 C2椎体切除,或需要暴露齿状突或寰椎前弓的手术,对于不稳定性 Hangman 骨折行 ACDF 则不需要暴露 C1和C2椎体的上半部。为避免咽后入路的缺点,临床上多选择标准前入路,操作方法为在下颌角和甲状软骨上缘间做一标准的横向切口,经皮下广泛游离松解后,沿胸锁乳突肌内侧缘纵向切开颈阔肌,在颈动脉鞘内侧切开气管前筋膜,甲状腺上动脉通常横行于 C3椎体上方,若显露困难可予以结扎,向外侧牵拉胸锁乳突肌和颈动脉鞘并向内侧牵拉甲状软骨和甲状腺,切开颈长肌、椎前筋膜,C2、C3椎前显露满意后,常规行减压植骨固定融合。
Hur 等[30]使用标准入路手术治疗 17 例不稳定性Hangman 骨折患者,1 例 3 个月后发生骨不愈合,其余全部愈合且无神经功能障碍。Ying 等[32]报道使用标准入路手术治疗 38 例不稳定性 Hangman 骨折患者,骨愈合率达 100%,所有患者颈痛均得到缓解,9 例神经功能缺损患者较术前均有改善。术后食管周围和椎前组织水肿、内固定物刺激食管和术中牵拉导致吞咽发声困难,是前入路治疗不稳定性 Hangman 骨折的常见并发症[30,32-33]。Li等[33]报道前路手术术后吞咽困难发生率为 13.2%,发声困难发生率为 5.2%,随访患者 3~6 个月后症状得到缓解。为减少此类术后并发症,零切迹类融合器单独植入在临床中逐渐应用。黄阳亮等[34]使用 C2~3椎间植入新型颈椎前路融合器 ( Solis ) 融合固定的方法治疗 4 例 Ⅱ 型和 4 例Ⅱa 型 Hangman 骨折患者,该类型融合器较正常椎间高1~2 mm,通过适当垫高椎间隙从而增加椎间稳定性。Cao等[35]对比研究植入桥型椎间锁定融合器 ( ROI-C ) 固定融合和钛板固定植骨融合治疗不稳定性 Hangman 骨折的疗效差异性,ROI-C 组和钛板组的术后 3 天吞咽困难发生率分别为 0%、46.7%,椎体完全复位率分别为 100%、46.6%。也有学者提出使用 2 枚 C2~3椎体螺钉直接加压固定的方法,不需 C2~3椎体间融合,仅显露 C2椎体下缘,将有成角和移位倾向的 C2椎体固定于 C3椎体上,间接促进 C2骨折部位的愈合,对骨折复位要求不高,但其远期疗效和并发症还需要更多的临床研究报道[36]。
前路手术通过压应力下的椎间植骨固定,融合速度快,不仅能提供早期良好的动态稳定,而且能防止创伤后椎间盘突出对神经造成的延迟性损害[4],被认为是治疗不稳定性 Hangman 骨折的标准手术方法。但其在应用上具有一定的局限性[9,16,37]:① 对于先天性颈短或下颌骨肥大的患者,因下颌骨遮挡无法顺利显露术野,需考虑后路手术;② 对于三柱损伤的 Ⅱ 型和 Ⅲ 型骨折,难以仅靠前路固定维持长期稳定,尤其是 Ⅲ 型骨折伴有后方关节脱位交锁,移位严重牵引难以闭合复位,必须行后路手术或前后路联合手术;③ 合并寰枢椎脱位、寰椎骨折或 C3椎弓根骨折,须后路固定;④ 骨折累及横突孔,需后路手术行椎动脉减压。
( 2 ) 后路手术:后路手术通过直接加压固定骨折断端达到解剖复位,恢复颈椎正常生理曲度功能,属于直接固定。手术方法有 C2椎弓根拉力螺钉固定、C2椎弓根螺钉联合 C3侧块 ( 椎弓根 ) 螺钉固定融合、C1~3固定融合等[16]。
C2椎弓根拉力螺钉因加压固定确切,无节段间融合,对颈椎的活动性无破坏,被称为“生理性重建手术”[38]。拉力螺钉分为半螺纹螺钉和全螺纹螺钉,后者需在进钉点至骨折线间制备钉道,因骨折后 C2椎板在后方处于“漂浮状态”,扩孔过程极易对脊髓和椎动脉造成损伤,置钉较为困难,故临床多选用前者[39]。ElMiligui 等[40]报道了通过 C2椎弓根拉力螺钉固定选择性治疗 12 例 Ⅱ 型和3 例 Ⅱa 型骨折患者,1 例 ( 3.33% ) 术后出现单侧 VAI,骨性愈合率 100%,无神经损伤和硬膜撕裂等并发症。此术式最大限度地保留了相邻节段生理功能,对于严重不稳定性骨折难以仅靠骨折端复位解决,且骨折线必须与置钉钉道方向垂直,若对斜形骨折螺钉加压可能会造成脊髓受压,因此部分学者认为该方法仅适用于 Ⅰ 型稳定性骨折和部分 Ⅱa 型前纵韧带、椎间盘完整的骨折,对于 Ⅱ 型骨折行单纯椎弓根内固定并不可靠[16,41]。
Duggal 等[41]研究认为 Ⅱ 型骨折椎间盘损伤易导致屈伸不稳,若损伤过度,直接固定 C2对恢复屈伸无效;双侧关节间部骨折更容易导致侧凸和旋转的不稳,后路 C2~3固定融合的力学稳定性较前路 ACDF 更优。李凭跃等[42]研究显示,Ⅱ 型骨折行 C2椎弓根单纯固定在屈曲、后伸、侧弯及旋转上的稳定性相较于正常状态分别为 47.84%、21.29%、65.98%、41.69%。Ma 等[43]使用 C2椎弓根螺钉联合 C3侧块 ( 椎弓根 ) 螺钉后路短节段固定融合的方法治疗 Ⅱ 型骨折 18 例、Ⅱa 型骨折 13 例、Ⅲ 型骨折 4 例,术前均通过 MRI 检测到 C2~3椎间盘损伤,术后复位满意且达到骨性愈合,神经功能状态均有不同程度的改善。该研究中 C3椎弓根螺钉共置入 52 枚, C3侧块螺钉共置入18 枚,但对于两者的使用尚无明确的指导原则,大量生物力学研究表明椎弓根固定强度大于侧块,若不存在 C3椎弓根狭小畸形,应尽可能结合 C3椎弓根固定[37]。Salunke等[44]研究认为正常的 C2~3关节仅产生约 5°~10° 的屈伸和 5° 的侧屈功能,融合后该关节运动的丧失几乎不会造成任何问题,对于移位 ≥ 4.5 mm 的 Ⅱ 型骨折,C2~3固定融合是更合适的选择。
C2棘突为颈后肌群的附着点,术中对肌肉的剥离可能会导致轴性症状和颈部疼痛。赵华国等[45]使用一种新型的植骨联合钉棒固定的方法,该方法沿基底部切除 C2棘突,联合棘突和后方肌肉血管复合体移植到 C2与 C3椎板之间加压固定,可保留颈后肌肉韧带,结构植骨增加了骨愈合率。
许多国内外病例报道,Hangman 骨折可合并如寰枢椎脱位、寰椎骨折及枢椎齿突骨折等复杂类型的损伤,若寰枢关节失稳,需行 C1~3固定融合[46-48]。Chaudhary 等[47]报道了 1 例伴寰枢关节脱位的 Ⅱa 型骨折,经后路 C1~3融合固定术后神经功能恢复满意。马向阳等[49]报道了使用后路 C1~3固定不融合的方法治疗 Ⅱ 型和 Ⅱa 型骨折患者10 例,骨折复位满意,无椎动脉、脊髓损伤等并发症发生,通过二期取出内固定物,可有效保留部分寰枢椎旋转功能。因大部分旋转功能丢失 ( 约 50% ),C1~3固定融合在多数情况下是过度和不必要的,若不伴有其它复合性骨折和节段不稳,一般不建议行长节段固定融合[4]。
后路固定融合术具有一些明显的优势[37,40-41]:① 解剖结构简单,较前路更容易暴露;② 对骨折的直接固定可达到术后的即刻稳定,纠正局部后凸畸形;③ 拉力螺钉固定能最大限度地保留颈椎功能;④ 椎弓根拉力螺钉的三柱固定、联合 C3侧块螺钉的“三维固定”较前路的力学稳定性更强。但也存在一些应用限制:① 无法处理 C2~3椎间盘,对于椎间盘破裂突出造成脊髓压迫的患者,必须联合前路手术;② 无论是 C2椎体拉力螺钉固定或短节段固定融合,经伤椎置钉有加重骨折移位和成角的风险;③ 若存在 C2椎弓根变异、C2椎动脉高切迹,置钉损伤椎动脉的风险较大。
统计数据显示,枢椎椎弓根的高度约为 9~11 mm,宽度约为 7~9 mm,螺钉置入对重要结构的损伤率可达11%[40]。由于枢椎解剖的特殊性,椎弓根存在潜在的解剖变异,经伤椎置钉则更加困难,对技术要求较高。置钉前需要对 C2椎体行薄层 CT 扫描,测量椎弓根直径,使用拉力螺钉前还需测量进钉点分别到椎体前缘、骨折线的距离。椎弓根内侧有硬膜外脂肪保护硬膜,较少会出现因螺钉穿透骨皮质导致的脊髓受压,但考虑到椎动脉内壁较为薄弱,螺钉位置偏移有可能损伤椎动脉,引起严重的并发症。术中 CT 引导或三维透视导航可辅助术者精确置钉[50-51],降低 VAI 风险。Singh 等[50]在术中 O 型臂引导下共置入 52 颗螺钉,包括 20 颗 C2椎弓根螺钉、20 颗C3侧块螺钉和 12 颗 C4侧块螺钉,按照 Gertzbein 等[52]标准,除 1 例 C2椎弓根螺钉为 B 级置钉 ( 螺钉穿破椎弓根皮质 ≤ 2 mm ),其余均为 A 级置钉 ( 螺钉在椎弓根内 )。吴超等[53]使用 3D 打印导航模版辅助置入 24 颗 C2椎弓根拉力螺钉,均达到 A 级置钉。Lang 等[54]报道了使用术中计算机导航辅助微创经皮置钉手术治疗 Hangman 骨折,在导航技术保证精确置钉的同时,微创技术减少了软组织损伤,避免了术后的顽固性颈痛。微创和导航下置钉将是脊柱外科今后的发展趋势,但限于设备较为昂贵,目前国内仅有少数医院拥有术中导航系统,3D 打印导航模版可部分替代术中导航的功能,在社会经济的不断发展下,相信能够逐渐普及。
( 3 ) 前后路联合手术:对于一些严重的 Hangman 骨折,前后纵韧带及椎间盘均已不同程度受损,单纯行前路手术往往留下较大的骨折间隙,严重的成角远期导致 C2~3反弓畸形,单纯行后路手术无法处理前方椎间组织,远期导致盘源性疼痛和颈部轴性症状加重。Xie 等[15]通过前路C2~3接骨板固定融合联合后路 C2椎弓根螺钉加压固定治疗 16 例不稳定性 Hangman 骨折患者,术后 X 线片均未显示骨不连、骨折移位和内固定物失败的迹象,远期随访中1 例颈部稍有残余疼痛,15 例颈痛完全消失。Ⅲ 型骨折需复位后方交锁关节,牵引无法闭合复位时,需行后路手术复位固定。王春丽等[55]通过后路松解复位联合前路减压融合固定手术治疗 10 例 Ⅲ 型骨折患者,均获得了良好的骨折复位和脊髓功能改善。作者的松解方法为牵拉 C2、C3棘突复位后方关节突关节,复位后 C2、C3棘突打孔,使用双 10 号线临时固定,关闭切口后行前路手术。一些国外研究者认为,对于严重的 Ⅲ 型骨折,一期仅 C2~3固定融合不够充分,需将 C1~2纳入固定节段以获得最佳的稳定性,二期再行前路手术,但旋转功能丢失对患者生活质量的影响还需长期随访观察[22]。对于极不稳定的 Hangman 骨折患者,联合入路能获得较好的复位和功能预后。
四、总结
综上所述,Hangman 骨折应结合详细的影像学资料,做出正确的分型诊断。手术治疗被认为是治疗不稳定性Hangman 骨折的理想选择,应根据个体化差异制订不同的治疗方案。对于手术方式的选择还没有确切的指导原则,虽有部分文献报道了前后路固定的生物力学和临床疗效对比,各有其优势和局限性。前路手术和后路手术均有较高的骨融合率和内固定稳定性,前者需考虑骨折端的生理性复位和后柱的稳定性,后者的生物力学优势必须与 C2置钉困难时寰椎固定带来的功能丢失进行权衡。对此,还需要多中心、前瞻性、大样本的研究证实不同方法的远期疗效,包括前路手术的影像学改变和后路手术远期椎间盘及韧带的转归情况等。随着安全和精准化理念的深入,在未来寻找一种更加安全、简便、高效的治疗方法有助于加速早期康复,减少更多的并发症,是脊柱外科医师共同努力的方向。

