腰椎后路融合术后手术部位感染的相关危险因素分析
杨明 张文涛 柯嵩 徐钢 刘谟震 李忠海
手术部位感染 ( surgical site infection,SSI ) 是脊柱外科术后早期严重的并发症之一[1],在接受腰椎后路融合术的患者中,大约有 1%~10% 的患者会发生术后切口感染[2]。SSI 的发生往往会导致患者住院时间延长、医疗费用增加以及预后不良甚至死亡等。影响 SSI 发生的因素较多,如年龄、肥胖、糖尿病、手术方式、手术时间、脑脊液漏( cerebrospinal fluid leakage,CSFL ) 等[3],然而,关于这些影响因素的研究结果尚缺乏统一性。本研究回顾性分析我院采用传统开放腰椎后路椎间融合术治疗的 324 例的临床资料,以期得到足够的证据为腰椎后路融合术后 SSI 的预防和治疗提供更多依据。报道如下。
资料与方法
一、纳入标准与排除标准
1. 纳入标准:( 1 ) 年龄 ≥ 18 岁;( 2 ) 患有腰椎退行性疾病 ( 腰椎管狭窄、腰椎滑脱和腰椎间盘突出症 );( 3 ) 接受开放性后路椎间融合术;( 4 ) 随访时间 > 1 年。
2. 排除标准:( 1 ) 年龄 < 18 岁;( 2 ) 创伤性骨折和病理性骨折 ( 肿瘤、结核 );( 3 ) 存在免疫系统疾病;( 4 ) 术前存在其它系统感染 ( 如肺部感染、尿路感染等 );( 5 ) 资料不全。
二、一般资料
2014 年 1 月至 2018 年 10 月共 357 例实施了传统开放腰椎后路椎间融合术,其中 33 例由于随访时间过短、死亡等原因被排除 ( 失随访率 9.2% ),余共计 324 例纳入研究,其中男 171 例,女 153 例。
三、SSI 诊断标准
SSI 分为手术切口感染和器官感染,手术切口感染进一步分为浅表感染及深部感染 ( 涉及筋膜和肌肉层 ),浅表手术切口感染指手术后 30 天内发生的仅累及切口皮肤或者皮下组织的感染,深部手术切口感染指无植入物者手术后 30 天内,有植入物者手术后 1 年以内发生的累及深部软组织的感染,器官感染指无植入物者 30 天内,有植入物者手术后1 年以内发生的累及器官或者腔隙的感染[4]。当出现以下至少一项条件时,可以诊断为感染:( 1 ) 手术切口部位分泌或穿刺出脓液;( 2 ) 患者具有手术切口部位感染的症状或者体征,包括发热 ( > 38 ℃ )、局部发红、肿胀、疼痛和触痛;( 3 ) 从手术切口部位分泌物或穿刺液培养出致病菌。
四、研究方法
将 324 例分为 SSI 组和非 SSI 组,收集两组患者年龄、性别、体质量指数 ( body mass index,BMI )、术区皮下脂肪和椎旁肌厚度 ( 通过在 MRI T2像矢状面 L4水平测量获得,见图 1 )、合并糖尿病和高血压情况、既往激素使用史、腰椎手术史和 SSI史、术前美国麻醉医师协会 ( American Society of Anesthesiologists,ASA ) 分级、术前白细胞计数、术前术后血红蛋白浓度、术前淋巴细胞总数、术前血清白蛋白浓度、手术时间、手术节段数、异体骨使用、出血量、术后引流量、引流时间、异体输血、切口局部万古霉素使用、术后并发 CSFL 等资料,对这些数据进行单因素分析,然后再对差异有统计学意义 (P< 0.05 ) 的因素进行多因素 Logistic 回归分析以明确 SSI 的独立危险因素。
五、统计学处理
采用 SPSS 23.0 软件进行统计学分析。计量资料采用x-±s表示,组间比较采用独立样本t检验,计数资料以病例数和百分比表示,组间比较采用χ2检验或 Fisher 精确概率检验。将单因素分析差异有统计学意义的变量进一步进行多因素 Logistic 回归分析。P< 0.05 为差异有统计学意义。
结 果
本组 324 例中,14 例发生 SSI,发生率为4.32%。SSI 组男 8 例,女 6 例,年龄 29~73 岁;浅部感染 9 例,深部感染 4 例,器官感染 1 例。浅部感染患者经手术切口换药护理联合短程抗生素治疗后治愈,深部感染和器官感染患者经清创缝合术联合术后负压封闭引流及抗生素治疗后治愈。非 SSI组男 163 例,女 147 例,年龄 18~81 岁。
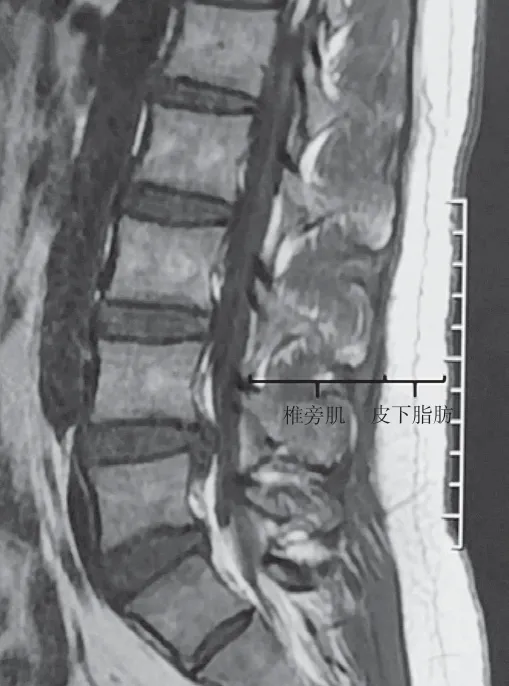
图 1 MRI T2 像矢状面 L4 水平椎旁肌肉及皮下脂肪厚度测量方法Fig.1 Measurement of L4 paraspinal muscle and subcutaneous fat thickness on the sagittal view of T2 weighted MRI
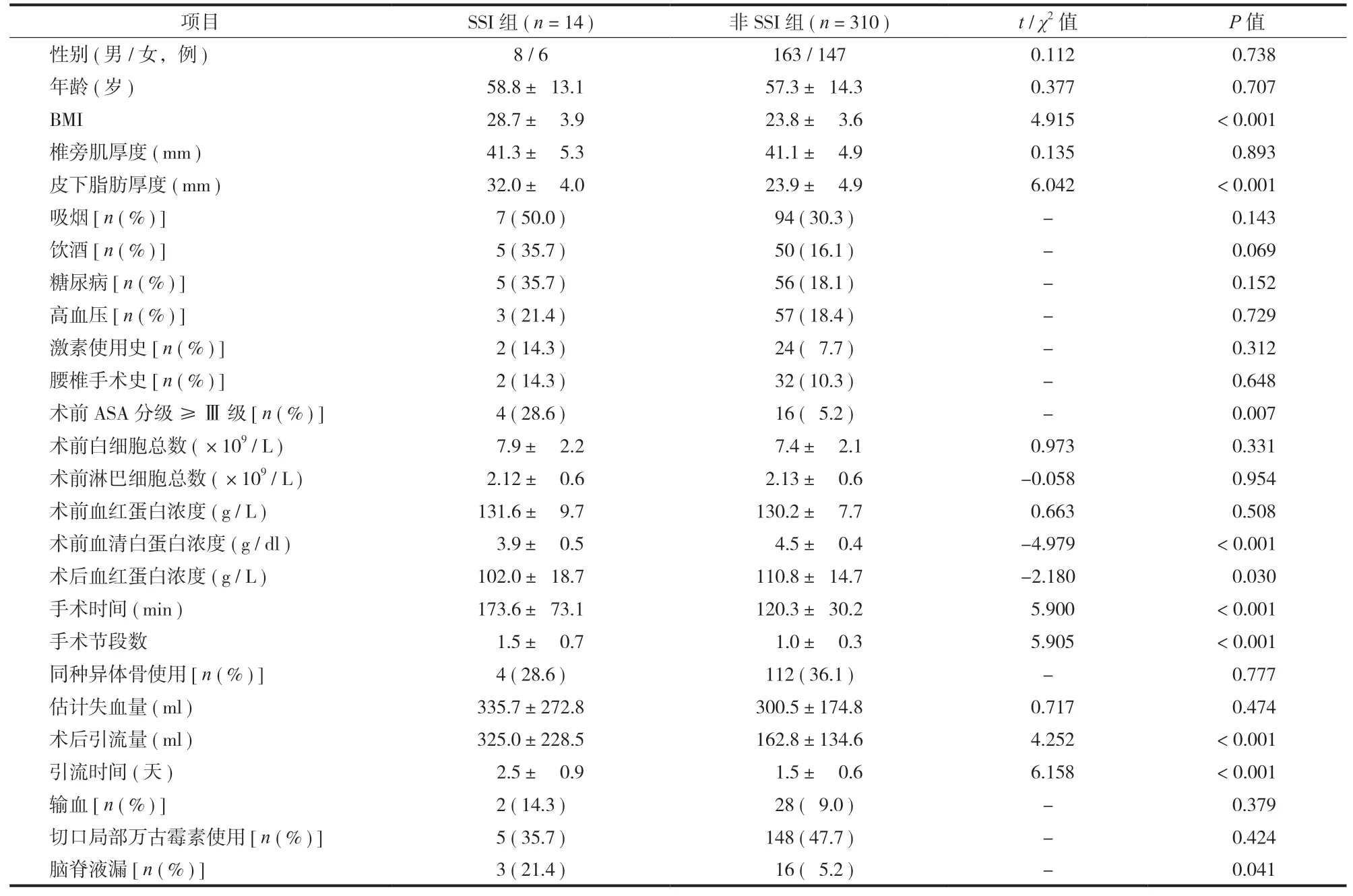
表 1 腰椎后路融合术两组患者资料的单因素分析Tab.1 Univariate analysis of the patients in two groups
对患者相关因素和手术相关因素的单因素分析结果如表 1 所示。这些因素中,BMI (P< 0.001 )、术区皮下脂肪厚度 (P< 0.001 )、术前 ASA 分级 ≥ Ⅲ 级(P= 0.007 )、术前血清白蛋白浓度 (P< 0.001 )、术后血红蛋白浓度 (P= 0.030 )、手术时间 (P< 0.001 )、手术节段数 (P< 0.001 )、术后引流量 (P< 0.001 )、引流时间 (P< 0.001 )、CSFL (P= 0.041 ) 与 SSI 的发生率显著相关。多因素 Logistic 回归分析显示 ( 表 2 ),术区皮下脂肪厚度较厚、术前血清白蛋白水平较低、术后引流时间较长是 SSI 的独立危险因素 (P< 0.05 )。
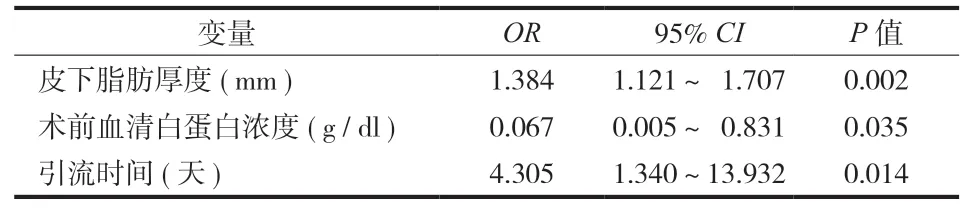
表 2 腰椎后路融合术中 SSI 危险因素的多因素 Logistic 回归分析Tab.2 Risk factors of SSI in posterior lumbar interbody fusion using multiple logistic regression analysis
讨 论
本研究中 SSI 的发病率为 4.32%,低于一些研究中的发病率,这可能是因为我科治疗方式差异所致。腰椎后路融合手术后 SSI 是脊柱外科中常见的术后并发症,它增加了患者的住院时间、再住院率和医疗费用,并可能造成内固定失败、假关节形成、永久性神经功能障碍甚至死亡等后果[5]。因此,了解腰椎后路融合术后 SSI 的危险因素对于降低术后 SSI 发病率是至关重要的。既往有文献报道了脊柱手术中许多可能的危险因素 ( 表 3 )[2,6-31],本研究发现术区皮下脂肪厚度较厚、术前血清白蛋白水平较低、术后引流时间较长是后路腰椎融合术后SSI 的 3 个独立危险因素。
一些研究表明,肥胖与围术期并发症风险增加之间存在相关性[8-13,32-33]。然而,笔者发现 BMI 不是SSI 的独立危险因素,而皮下脂肪厚度是 SSI 的独立危险因素。这可能是因 BMI 反映的是身高与体重之间的关系,而个体体质差异以及肌肉结构的不同会导致脂肪含量的显著变化。因此在 SSI 的发生中,皮下脂肪厚度是比 BMI 更重要的危险因素。手术切口部位脂肪增加 SSI 感染率可能有以下几项原因:一方面,脂肪组织血供较差,术后易液化、坏死,这成为感染的潜在诱因;另一方面,皮下脂肪层较厚意味着需要额外延长手术切口以达到理想的解剖结构暴露,并会延长手术时间;此外,这层较厚的皮下脂肪在闭合后也可能形成无效腔,从而增加感染风险[34]。
术前血清白蛋白水平较低也是 SSI 的一项重要危险因素。血清白蛋白在炎症和疾病状态下其水平下降,表明患者营养状况较差。此外,较低的血清白蛋白水平会抑制患者的免疫功能,延缓手术切口愈合。Kudo 等[35]发现术前低血清白蛋白水平是脊柱手术后 SSI 的重要危险因素。笔者的研究结果显示,术前低血清白蛋白浓度与术后 SSI 存在显著的相关性,支持使用血清白蛋白指标对患者进行术前评估,围术期纠正低蛋白血症,可以降低腰椎融合术后 SSI 的发生风险。

表 3 既往相关研究报道的脊柱手术中 SSI 的危险因素Tab.3 Previous studies on risk factors of SSI in spine surgery
脊柱手术后是否需要常规安置引流还存在争议。Patel 等[36]系统分析了脊柱手术中使用引流的情况,认为脊柱手术安置引流不能减少相关并发症的发生率,现在大多数脊柱外科医生使用引流仅仅是出于习惯,目前并没有足够的证据支持引流对脊柱手术后患者的康复有利。Kotil 等[37]通过前瞻性研究认为术后引流有利于手术切口渗血、渗液排除,可以有效减少血肿形成,加速手术切口愈合并预防感染。Ahmed 等[38]认为术后引流时间 > 72 h 会显著增加 SSI 的风险,因为引流管增加了切口内部与外界相通的机会。笔者认为不恰当的引流方式以及引流时间过长会增加感染风险,放置过浅的引流管可能会造成手术切口部位充血和血肿,放置过深的引流管很可能导致感染。
除上述因素外,ASA 分级、CSFL、局部应用万古霉素、糖尿病等与 SSI 的关系也被广泛争论。ASA分级被认为是患者术前健康状况的评估标准,最初用于麻醉风险评估,因其简单易操作,现也广泛用于评估外科手术风险、术后并发症发生率。Khan等[39]的研究也表明 ASA 分级可用于评估 SSI 风险。另外,ASA 分级与脊柱外科术后 SSI 发病率和病死率的相关性也得到了验证[40-41],因此,其对医生术前评估患者手术风险和术后并发症风险有极大帮助。ASA 分级越高的患者全身情况越差,术后并发症多、康复时间长,感染的机会也相应增加。
在脊柱手术中 CSFL 是一种相对常见的并发症,其发生率高达 17%[42-43]。CSFL 是否为 SSI 的危险因素仍存在争议。Puvanesarajah 等[42]报道称,在一组接受腰椎间盘切除术的老年患者中,CSFL 组和非 CSFL 组 SSI 的发病率有显著差异。这可能是因为CSFL 延缓了手术切口的愈合,为致病菌提供了增殖生长的环境并增加了患者的卧床时间。然而,在Adogwa 等[43]的研究中,1741 例接受腰椎融合手术的患者中有 70 例 ( 4% ) 发生了 CSFL,得出结论,CSFL 组和非 CSFL 组 SSI 的发生率没有显著差异。本研究中,CSFL 未被认为是 SSI 的独立危险因素。
脊柱外科 SSI 中最常见的病原体为金黄色葡萄球菌,而随着抗生素的广泛应用,耐甲氧西林金黄色葡萄球菌导致的感染逐渐增多[44]。万古霉素主要用于革兰阳性球菌感染,尤其是耐甲氧西林金黄色葡萄球菌感染。近年来,局部使用万古霉素预防 SSI得到了广泛的研究。Shan 等[45]进行了一项 Meta 分析,纳入 31 项研究共计 17 708 例,结果显示在脊柱外科手术中局部应用万古霉素可以显著降低 SSI发生率。相反,Martin 等[46]的一项回顾性研究发现,同对照组相比较,局部应用万古霉素组患者的SSI 感染率无明显变化。Tubaki 等[47]认为万古霉素在手术切口中的局部应用并不能显著降低 SSI 的感染率。笔者的研究发现局部应用万古霉素并没有显著降低 SSI 的发病率,这可能是因为我科感染患者致病菌的差异所致。
在一些研究中,糖尿病普遍被认为是 SSI 的重要危险因素,高血糖水平会降低患者免疫功能,影响白细胞吞噬能力和切口愈合速度,从而增加感染机会[2,6-7,9-13,17,20,22,26,48]。然而,笔者的研究发现糖尿病与 SSI 没有显著的相关性,这可能是由于笔者在围术期对糖尿病患者进行了严格的血糖监测与控制管理。同样,性别、吸烟、饮酒、激素使用史、输血、术中失血量、同种异体骨的使用等因素在本研究中没有被确定为独立危险因素,这可能是本研究的样本量较少所导致。同样,样本量较少,SSI 组与非 SSI 组的统计误差可能会导致不一致的研究结果,因此,这需要进一步的多中心、大样本研究来明确这些因素对 SSI 的具体影响。此外,本研究中SSI 多为浅表感染,这可能需要进一步的研究来分析手术部位浅表感染和深部感染的具体因素。
综上所述,腰椎融合术后 SSI 的危险因素有很多,笔者分析发现,患者术区皮下脂肪厚度较厚、术前血清白蛋白水平较低、术后引流时间较长与 SSI发生有关。了解这些危险因素有助于患者术前评估和术后康复,围术期加强患者体重管理、血糖控制、营养状态改善及术后引流时间控制将有助于降低患者的 SSI 发病率、病死率和住院时间,减轻患者及社会的医疗负担。

