改良腺嘌呤饮食诱导慢性肾脏病大鼠血管钙化
邓 岱 韩 雪 刘文虎
血管钙化(vascular calcification, VC)是慢性肾脏病(chronic kidney disease, CKD)患者常见的并发症之一,尤其是终末期肾脏病患者死亡的重要危险因素[1, 2]。研究发现,CKD患者VC的主要病理改变是血管中膜钙化,发病机制涉及钙磷代谢异常、血管平滑肌细胞(vascular smooth muscle cells,VSMCs)成骨转分化转换、钙化抑制物缺乏等多方面因素[3]。然而目前关于CKD血管钙化发生的确切机制尚未完全明确,因此建立一种准确、简便、稳定性好的CKD血管钙化动物模型对于进一步研究意义重大。在诸多研究CKD血管钙化的动物模型中,应用腺嘌呤能够诱导出与临床高度类似的慢性肾衰竭动物模型,可出现包括动脉中层钙化等相关并发症,但常规应用0.75%腺嘌呤仍存在许多缺点,VC发生率及钙化程度相对较低、严重和短期即出现的营养不良、干预4~6周时的高死亡率[4, 5]。因此,需要建立一种能够提高生存率的同时增加动脉中层钙化程度的改良腺嘌呤诱导CKD血管钙化动物模型。本研究建立了改良腺嘌呤(0.3%)饮食喂养的新型慢性肾脏病大鼠模型,探索比常规腺嘌呤(0.75%)喂养动物模型更广泛和稳定的动脉中层钙化。
材料与方法
1.材料:(1)实验动物: SPF级雄性SD大鼠38只,8周龄,体质量300±20g(北京华阜康生物科技股份有限公司),饲养于首都医科大学附属北京友谊医院实验动物中心。实验取得首都医科大学附属北京友谊医院实验动物管理委员会的许可。(2)试剂: 对照组:普通饲料饮食,含1.0%钙、1.2%磷、20%谷物基础蛋白。模型组:常规高腺嘌呤饮食,含0.75%腺嘌呤、1.0%钙、1.8%磷、20%谷物基础蛋白。改良组:改良低腺嘌呤饮食,0.3%腺嘌呤、1.0%钙、1.8%磷、20%乳糖、20%酪蛋白基础蛋白(定制自北京科澳协力饲料有限公司)。其他试剂:钙离子检测试剂盒(美国Bioassay公司),Von Kossa染色试剂盒(上海杰美医药科技有限公司)。
2.动物分组及处理:将大鼠随机分为对照组 (给予正常饮食)8只、模型组(常规高腺嘌呤饮食)15只、改良组(改良低腺嘌呤饮食)15只,共8周。
3.标本采集及生存分析:第2、4、6、8周采用断尾取血法,每只大鼠采血量为2ml,血液置于室温下自然凝固10~20min,3000r/min离心10min,收集上清液待测。8周时,对各组间进行生存分析比较。对前8周自然死亡和8周时麻醉后处死的大鼠,取出主动脉,分成两部分,分别用于形态学、钙离子测定。
4.生化检测:使用全自动生化仪(Hitachi 7170)检测大鼠血清中白蛋白、尿素氮、肌酐、钙、磷,测定尿蛋白、尿磷、尿钙。
5.大鼠主动脉钙含量测定: 取大鼠胸主动脉段,用吸水纸吸干水分至重量不再改变后称重,置于1mmol/L的盐酸中37℃消化24h,吸取上清脱钙液,10000r/min离心10min后收集上清,参照钙含量测定试剂盒说明书检测血管组织钙离子浓度,计算钙离子含量/血管组织重量。
6.大鼠主动脉Von Kossa染色:以常规组织取材、包埋、切片方法制备大鼠腹主动脉石蜡切片,按照Von Kossa染色试剂盒说明书操作步骤进行染色。
结 果
1.大鼠生存情况:8周时,对照组大鼠未出现死亡;模型组大鼠死亡12只,死亡率80.0%;改良组死亡4只,死亡率26.7%,与模型组比较差异有统计学意义(P<0.01)。生存分析(Kaplan-Meier方法)结果显示改良组大鼠存活率明显高于模型组,生存时间更长,差异有统计学意义(Log-Rank检验,P<0.05,图1)。
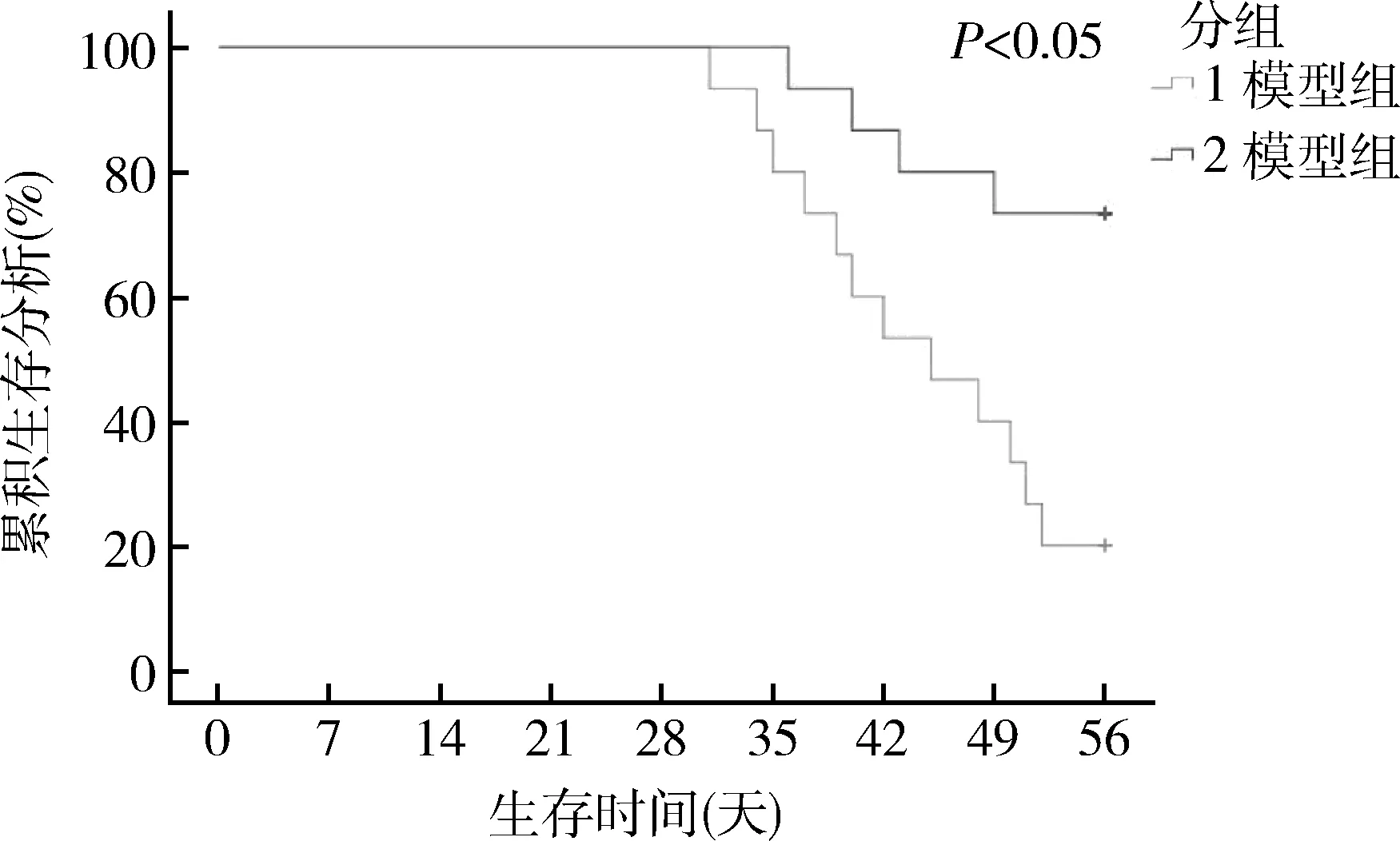
图1 大鼠生存时间分析
2.大鼠生理和生化指标情况:通过对模型组大鼠前6周及改良组前8周每2周记录体质量、进食量及血清尿素氮(BUN)、肌酐(SCr)、白蛋白(ALB)、矫正钙(Ca)、血磷(P)、尿磷指标分析发现,两组大鼠与对照组比较均出现BUN、SCr升高;体质量、进食量和ALB水平下降;继而出现高磷血症和高磷酸盐尿(表1)。然而这些指标在改良组的变化更缓慢,6周时改良组大鼠BUN水平低于模型组(P<0.05)、SCr与模型组相近(P>0.05),改良组的血磷水平和尿磷排泄值更高(P<0.05)、ALB水平和体质量更高(P<0.05)。8周时改良组大鼠BUN、SCr水平与模型组大鼠6周时对应指标近似相同,差异无统计学意义(P>0.05),同时改良组血磷水平、尿磷排泄值、ALB水平和体质量也更高(P<0.05)。
3.大鼠血管钙化情况:3组间主动脉钙含量的情况:改良组大鼠8周时和模型组大鼠6周时的主动脉钙含量(主动脉湿重每克所含钙毫克值)显著高于对照组(P<0.05);改良组与模型组再次比较时,前组钙含量仍高于后组,差异有统计学意义(P<0.05,图2)。对Von Kossa染色的大鼠主动脉进行钙化程度的半定量分析:病理图片(图3)中血管钙化显示为染色呈现黑色结节,根据钙化面积占血管环面积的百分比S进行钙化积分(表2),结果显示对照组8周时未检测到血管钙化灶,改良组8周时钙化积分高于模型组6周时的钙化积分,差异有统计学意义(P<0.05,图4)。

表1 模型组及改良组大鼠生理及生化指标变化情况

图2 大鼠主动脉钙含量与对照组比较,*P<0.05;与模型组比较,#P<0.05

图3 大鼠主动脉不同程度的钙化病理(Von Kossa染色,×40)
讨 论
CKD患者VC并发症发生率高达30%~80%,是此类患者心血管死亡和全因病死率的重要危险因素[6]。笔者团队一直致力于探究CKD血管钙化的发病机制及防治方法,其中用于研究的CKD血管钙化动物模型是此类研究的重要基础。然而既往CKD大

表2 主动脉钙化定量积分
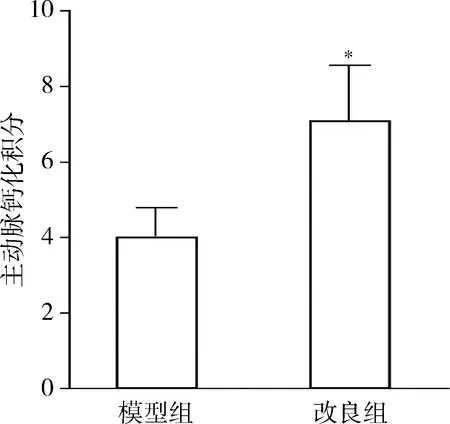
图4 大鼠主动脉钙化程度的半定量分析与模型组比较,*P<0.05
鼠模型出现VC的时间慢,延长了实验周期,而且随着肾衰竭进展,容易出现严重营养不良及高死亡率影响研究结果。因此,本研究建立了一种高效且稳定的CKD大鼠血管钙化模型。
CKD3期后并发的矿物质、骨代谢异常启动了VC的进程[7,8]。关于CKD诱导VC模型的研究,最早是以腺嘌呤饮食诱导出VC和继发性甲状旁腺功能亢进,这也是目前国内外应用较多的基础模型[9,10]。腺嘌呤进入机体后可通过代谢产物堵塞肾小管、氧化应激等途径诱导肾损伤的发生。单纯腺嘌呤饮食诱导CKD模型所需时间长约8~12周,且VC发生率仅15%左右。为了缩短造模时间,提高VC发生率,后续研究考虑到高磷血症在CKD血管钙化的发生、发展中起着重要的作用,通过促进VSMCs成骨样分化、诱导VSMCs凋亡、促进基质小泡释放等途径导致VC[11]。于是诸多研究对腺嘌呤饮食干预的CKD诱导VC模型进行优化,多在腺嘌呤饮食或混悬液灌胃的基础上联合高磷饮食制作CKD血管钙化动物模型,进而缩短了造模时间,提高钙化的发生率[12,13]。然而多项研究发现,标准腺嘌呤饮食(0.75%)联合高磷饮食(1.8%)制作的CKD大鼠VC模型约4~5周时开始出现死亡,6周时死亡率明显增高,且存在严重营养不良,少数大鼠死亡时也未出现VC[14]。因此,本研究探索了一种新型的改良腺嘌呤联合高磷饮食诱导CKD大鼠VC的模型,它与传统腺嘌呤联合高磷饮食比较,能够延缓肾衰竭的进程,出现更广泛、严重的动脉中层钙化,同时改善CKD大鼠后期营养状况,延长生存时间,明显降低死亡率。
在不利用基因操作的条件下,建立慢性肾功能不全大鼠广泛而显著的动脉中层钙化模型具有一定的挑战性。本研究为了克服传统腺嘌呤高磷饮食喂养大鼠模型的缺点,制作了一种新的合成饮食,在以下3个方面进行改良与创新:(1)既往研究发现以0.75%腺嘌呤为基础的饮食会导致大鼠模型严重的肾衰竭和营养不良,进而导致4~6周时的高死亡率。本研究使用仅含0.3%腺嘌呤的饮食减缓了CKD进程,血肌酐、尿素氮水平升高更缓慢,同时动物体质量及血白蛋白下降减慢,避免了迅速的营养不良以及后续的高死亡率。(2)本研究选择含酪蛋白饮食作为蛋白质来源,由此促进胃肠道对磷的吸收,通过增加高磷饮食的吸收进一步提升血磷水平,以促进VC的发生。(3)本研究在饮食中添加了20%的乳糖以进一步增加胃肠道对钙和磷的吸收。
本研究结果显示,改良组大鼠的血肌酐、尿素氮水平与模型组相近,但改良组大鼠肾衰竭的进展相对较慢,并且其相同周数时血磷水平高于模型组。模型组大鼠4周后开始出现死亡,且死亡率逐渐上升,6~8周期间改良组生存率明显高于模型组。VC形态学、定量分析显示,改良组大鼠VC的程度比改良组更重,呈现广泛而明显的动脉中层钙化,而对照组大鼠并未出现VC,说明与周龄增加无相关。本研究发现该动物模型存在8周时钙化进一步发展的可能性。基于本模型的以上特点,并符合实验动物的“3R”原则(减少、细化和替换),改良腺嘌呤饮食喂养大鼠模型具有更长生存期和稳定VC发生,可以减少用于VC研究的动物数量,该模型值得进一步推广应用。

