CYP450 酶内源性生物标志物的研究进展*
莫锦灵,应玉雯,沈 叶,王敦建,孙鲁宁**,王永庆**
1 南京医科大学第一附属医院 临床药理研究室,南京 210029;2 南京医科大学 药学院,南京 210029
药物的有效性和安全性与其在体内的吸收、分布、代谢和排泄有关,而细胞色素P450(Cytochrome P450,CYP450)酶参与80%~90%药物的Ⅰ相代谢[1]。因此,希望通过检测CYP450 酶活性,了解药物的体内代谢过程,预测药物疗效和不良反应。CYP450 酶的活性受到多种因素的影响[2],包括基因、性别、年龄、疾病等,不同个体间代谢酶的活性可能有较大差异,如CYP2C19 不同突变体会造成个体间的药物代谢差异[3],因此需要密切关注代谢酶的活性。外源性探针广泛用于临床试验中CYP450 酶活性的测定[2],这种方法需要受试者服用探针药物(如检测CYP3A 活性需口服咪达唑仑[4]),同时采集受试者血样以测定血药浓度。但以非治疗为目的且需要频繁地采血,在特殊人群(如小儿、孕妇、老人等)中应用存在着困难[5]。CYP450 酶参与机体内源性化合物的代谢,如胆固醇、脂肪酸等,部分内源性物质可作为测定CYP450 酶活性的生物标志物[2]。内源性内源性生物标志物用于评价CYP450酶活性不借助外源性探针药物,利用某些内源性物质及其代谢物的水平变化来反映酶的变化,具有更好的依从性[4]。本文汇总了CYP1A2、CYP2A6、CYP2C19、CYP2D6、CYP2E1 和CYP3A 6 种重要CYP450 酶亚型内源性生物标志物的研究进展。
1 对主要CYP450 酶内源性生物标志物的分析
2.1 人体内的CYP450
药物代谢发生在肝脏、小肠、肾等组织中,肝脏是代谢的主要器官,其微粒体酶活性最强。其中最重要的氧化酶因其在还原状态下可与CO 结合,在波长450 nm 处有一最大吸收峰,故认为是细胞色素P450 酶[6]。位于肝脏内质网和线粒体内膜上的CYP450 是参与药物Ⅰ相代谢的关键酶,经酶催化的氧化反应是药物体内代谢的主要途径。CYP450 参与了许多内源性物质如脂肪酸、花生四烯酸的代谢过程和外源性化合物如药物、环境中污染物的处置过程[7]。
CYP450 酶是一个参与编码500 多种酶蛋白的超家族[8]。其可按氨基酸的序列分类,同一家族的氨基酸序列有40%相似性,同一亚家族相似性超过55%[7]。在人肝微粒体中参与药物代谢的CYP450 酶主要有CYP1A、CYP2C、CYP2D、CYP2E、CYP3A 五大类,它们占肝脏中CYP450 酶总含量>75%。
1.2 CYP1A2 的内源性生物标志物
CYP1A2 约占CYP450 酶总量的13%,仅次于CYP3A 和CYP2C[9]。CYP1A2 参与咖啡因、硝苯地平、华法林、普萘洛尔等多种外源性药物的代谢,也负责部分内源性激素的羟化反应,除此之外,CYP1A2 也参与一些前致癌物(黄曲霉毒素、亚硝胺等)在体内的活化过程[9]。测定CYP1A2 活性的外源性探针药物主要是咖啡因[10],内源性生物标志物主要有褪黑素(melatonin)及其6-羟基化代谢物(6-hydroxymelatonin)[4]。在体外肝微粒体模型研究中发现,褪黑素通过CYP1A1、CYP1A2 及CYP1B1 代谢生成6-羟基褪黑激素,其中CYP1A2 为肝内主要代谢酶[4]。Wang 和Hiemke 通过高效液相色谱结合电化学检测法,发现褪黑素主要代谢为6-羟基化代谢物和N-乙酰羟色胺(N-acetylserotonin,NAS),添加CYP1A2的特异性抑制剂呋拉茶碱后,仅检测到少量NAS,推测6-羟基代谢物是经CYP1A2 代谢[11],理论上褪黑素及其6-羟基化代谢物可作为检测CYP1A2 活性的内源性生物标志物。
目前检测人体中褪黑素的方法有高效液相色谱法(HPLC)、高效液相色谱-质谱法(HPLC-MS/MS)[12]和酶免疫检测法(ELISA)[2]。有研究利用生物免疫法测定血清褪黑素的药时曲线下面积(AUC)[4],分别测定受试者吸烟(增加CYP1A2的活性)前后外源性和内源性血浆褪黑素水平变化,结果外源性血浆褪黑素水平在吸烟后显著降低,而内源性血浆褪黑素水平未受到显著影响。现有研究将外源性褪黑素作为CYP1A2 探针,但因其缺乏相关理论,还存在争议。研究[4]表明,咖啡因的清除率与内源性血清褪黑素AUC 值不存在显著的相关性,而在人体内咖啡因清除率的90%以上由CYP1A2 介导[13],产生这些结果的原因可能是内源性褪黑素的含量不仅与CYP1A2 代谢有关,还与褪黑素的重新分泌有关,褪黑素的分泌作用掩盖了它的含量变化。因此,使用内源性褪黑素作为CYP1A2 的探针,应选择合适的指标,如排除褪黑素分泌昼夜节律的影响[2]。
1.3 CYP2A6 酶的内源性生物标志物
CYP2A6 广泛参与药物的代谢,如依非韦伦、来曲唑等,同时也能将许多致癌前体化合物代谢为强致癌物,如将烟草中大量的亚硝胺致癌前体化合物代谢为亚硝基亚甲胺[14]。CYP2A6 的外源性探针主要是香豆素[15]。吸烟者体内含有尼古丁,尼古丁经CYP2A6 的代谢产物可替宁(cotinine,COT)和反式-3'-羟基可替宁(trans-3'-hydroxycotinine,3HC)可作为表征CYP2A6 酶活性的内源性标志物。
以内源性生物标志物评价酶活性的方法有COT/尼古丁和3HC/COT 的比值(C3HC/CCOT)。由于尼古丁的半衰期(2 h)比COT 的半衰期(16 h)低得多[16],若考虑使用COT/尼古丁的比值评价CYP2A6 的活性,CYP2A6 活性结果取决于最后一次接触尼古丁的时间,需要提前较长时间禁止受试者接触尼古丁,使体内COT 被完全代谢;若使用C3HC/CCOT评价CYP2A6的活性,3HC 由COT 产生,半衰期较短(6 h),C3HC/CCOT与COT的半衰期相关,与COT/尼古丁的比值相比,以C3HC/CCOT作为内源性生物标志物评价更加稳定。Dempsey D 等[17]研究表明,唾液和血浆中C3HC/CCOT与尼古丁口服清除率有显著的相关性,而尼古丁代谢的主要指标是尼古丁的口服清除率,表明C3HC/CCOT与尼古丁的代谢有高度相关性,进而证实C3HC/CCOT是表征吸烟者CYP2A6 活性的可靠内源性生物标志物。测定3HC 和COT 浓度的主要方法为GC-MS 和HPLC-MS/MS[17]。
以C3HC/CCOT评价CYP2A6 活性的方法在临床上已有了应用,如Lerman C 等[18]通过测定C3HC/CCOT预测了尼古丁经皮治疗戒烟的有效性,在C3HC/CCOT低的患者中有46%的人戒烟成功,而在比值高的患者中仅有28%的人戒烟成功,C3HC/CCOT与戒烟效果有显著的相关性,CYP2A6 快代谢患者比慢代谢患者的戒烟效果较差,表明C3HC/CCOT对预测尼古丁经皮治疗的戒烟成功率有着重要临床意义。
1.4 CYP2C19 酶的内源性生物标志物
经CYP2C19 代谢的药物占CYP450 酶代谢的2%,临床上参与代谢有许多重要药物,如奥美拉唑、氯匹格雷等[4]。CYP2C19 的外源性探针主要有奥美拉唑、美芬妥英[10],内源性生物标志物还在研究中,研究方向主要是花生四烯酸(AA)。
花生四烯酸可被所有CYP450 酶代谢,但经CYP2C19代谢的代谢率最高,生成4 种环氧三烯酸(epoxyeicosatrienoic acids,EETs)和11 种羟基花生四烯酸(hydroxyeicosatetraenoic acids,HETEs)[19]。研究认为,EETs 可代谢生成碳三烯酸(dihydroxyeicosatrienoic acids,DHETs),其 中11,12-DHET 和14,15-DHET 是EET 占比最大的代谢产物。为证明CYP2C19 活性与EET 水平呈正相关[20],Akasaka T 等[21]测定了不同CYP2C19 活性的血清样本中11,12-和14,15-DHETs 的浓度,用来替代EET 水平,发现CYP2C19慢代谢受试者的血清11,12-和14,15-DHETs 水平显著低于快代谢受试者,检测DHET 的方法主要有酶联免疫法[21]。
但DHET 并非EETs 经CYP2C19 代谢的直接产物,是EET经可溶性环氧化物水解酶生成的代谢产物[20],其浓度受到该水解酶影响,故无法利用血清11,12-和14,15-DHETs 水平代替EET 水平评价CYP2C19 的活性。未来需要直接研究AA 的代谢产物EETs、HETE 的水平与CYP2C19 活性的关系,以验证AA 是评价CYP2C19 活性的内源性生物标志物。
1.5 CYP2D6 酶的内源性生物标志物
CYP2D6 存在于肝脏、心脏和脑组织中,参与约25%药物的代谢,如阿片类药、抗精神病药、抗抑郁药等[22]。CYP2D6 的外源性探针有右美沙芬[22],内源性生物标志物有5-甲氧基色胺(5-methoxytryptamine,5-MT)/5-羟色胺(serotonin,5-HT)和松香烃(pinoline,PIN)/6-羟基-1,2,3,4-四氢化-β-咔啉(6-hydroxy-1,2,3,4-tetrahydro-beta-carboline,6-OHTHBC)。
5-MT 是一种微量的内源性吲哚胺类,Yu AM 等[23]发现5-HT 是唯一经CYP2D6 介导的5-MT 的代谢物。之后Kirchheiner J 等[24]测定了经不同活性CYP2D6 代谢后血小板中5-HT 的浓度,结果显示,CYP2D6 活性高的受试者体内5-HT 的含量显著高于CYP2D6 活性低的受试者,提示5-MT/5-HT 可能是测定CYP2D6 活性的内源性生物标志物。但5-HT 的半衰期较长(大于3 天)[4],可能会因代谢不及时而不能准确反映CYP2D6 的活性,研究发现,受试者服用CYP2D6 抑制剂24 h 后体内5-HT 含量无明显变化[24]。因此,需要进一步的临床研究来验证5-MT/5-HT 能否作为内源性生物标志物、以反映CYP2D6 的活性[4]。
PIN 是一种存在于哺乳动物大脑和组织中的内源性化合物[24],经CYP2D6 特异性地发生O-去甲基化代谢为6-OH-THBC。Jiang XL 等[25]发现,在人肝微粒体 中,加入8 种代谢酶抑制剂后,只有奎尼丁(CYP2D6 抑制剂)对PIN 的O-去甲基化反应有明显的抑制作用,并在注射PIN 后,野生型小鼠体内的PIN/6-OH-THBC 值(0.29±0.19,n=4)显著高于CYP2D6 转基因小鼠(0.0070±0.0048,n=4)。基于此研究,PIN/6-OH-THBC 被认为可能是反映CYP2D6 活性的内源性生物标志物[4]。
目前,通过测定尿液中的C6-OH-THBC/CPIN比值评价人体内CYP2D6 的活性[26,27]。如米氮平为经CYP2D6 代谢的抗抑郁药物,高达40%的患者存在耐药现象,Sychev DA 等[26]利用口服米氮平患者尿液中C6-OH-THBC/CPIN比值反映CYP2D6 活性,CYP2D6 活性高的患者米氮平代谢加快,药效降低,提示可以根据C6-OH-THBC/CPIN比值来指导临床用药,减小耐药性的发生。但以上研究未将C6-OH-THBC/CPIN比值与特异性探针药物的代谢结果进行比较[4],因此以C6-OH-THBC/CPIN比值作为内源性指标还需要进一步研究确认。
1.6 CYP2E1 酶的内源性生物标志物
CYP2E1 参与约90 种外源性药物以及各种内源性脂肪酸的代谢,包括月桂酸、硬脂酸、花生四烯酸等,也能代谢体内多种有毒底物,如乙醇、四氯化碳等[28]。测定CYP2E1 活性的典型外源性探针药物为氯唑沙宗[28]、月桂酸(lauric acid,LA)及其(ω-1)-羟基化产物11-羟基月桂酸(11-hydroxylauric acid,11-OH-LA),均是测定CYP2E1 活性的内源性生物标志物。
Amet Y 等[29]发现,经CYP2E1 诱导剂(吡啶、丙酮、异烟肼等)处理的鼠肝微粒体产生更多的11-OH-LA。Choi YJ 等[30]考察了人肝微粒体中14 种CYP 重组酶对LA 代谢反应的影响,发现经CYP2E1 代谢的11-OH-LA 生成率最高。同时,氯唑沙宗发生6-羟基化反应生成6-羟基化氯唑沙宗,而LA的(ω-1)-羟基化反应和氯唑沙宗的6-羟基化反应具有显著的相关性[30]。综上,LA/11-OH-LA 可能是测定人或鼠肝微粒体中CYP2E1 活性的内源性生物标志物。目前研究建立HPLC法和HPLC-MS/MS 法[30]测定了人肝微粒体中LA 和11-OHLA 浓度,并研究了LA/11-OH-LA 与CYP2E1 活性的关系。然而,仅在人肝微粒体进行了部分研究,仍需进一步的临床研究验证LA/11-OH-LA 能否用于测定人体CYP2E1 的活性。
1.7 CYP3A 酶的内源性生物标志物
CYP3A 是肝脏中最重要的代谢酶之一,在肝脏和小肠中表达最为丰富,约占肝脏总CYP 含量的30%,参与约50%上市药物的代谢[31]。CYP3A 常用的外源性探针药物主要是咪达唑仑[10],且对测定CYP3A 活性的内源性生物标志物也研究众多,其中常用的两种内源性标志物有:氢化可的松(cortisol)及其代谢物6β-氢化可的松(6β-hydroxycortisol,6β-OHF)和胆固醇(cholesterol)及其代谢物4β-羟基胆固醇(4βhydroxycholesterol,4β-OHC)[4]。
Shibasaki H 等[32]发现,患者服用利福平(CYP3A 诱导剂)后,人肝微粒体中氢化可的松发生6-羟基化的活性更高。而用酮康唑(CYP3A 抑制剂)处理人肝微粒体后,氢化可的松浓度显著升高[33]。Furuta T 等[34]比较了CYP3A、CYP2B6 和CYP2C9 几种CYP450 亚型对氢化可的松反应的影响,结果证实,氢化可的松主要经CYP3A 发生6β-羟基化反应。基于以上研究,认为6β-羟基皮质醇是测定CYP3A 活性的内源性生物标志物[4]。6β-羟基皮质醇/皮质醇比值与皮质醇清除率可用于评价CYP3A 的活性[4,35,36]。目前,CYP3A 活性评价的标准是咪达唑仑的清除率,研究表明[35],皮质醇清除率与咪达唑仑肾清除率有显著的相关性,但有文献发现[36],尿液6β-羟基皮质醇/皮质醇比值与咪达唑仑清除率无显著相关性。因此,认为皮质醇清除率比6β-羟基皮质醇/皮质醇比值评价CYP3A 的活性更加准确。测定血浆和尿液中6β-羟基皮质醇和皮质醇浓度的分析方法包括ELISA、HPLC 法[34]和HPLCMS/MS 法[37]。
4β-羟基胆固醇是胆固醇经CYP3A 代谢的内源性化合物,不受肾排泄功能和体内胆固醇水平的影响[36]。血浆4β-羟基胆固醇浓度以及4β-羟基胆固醇/胆固醇与咪达唑仑血浆清除率有一定的相关性[36]。然而,4β-羟基胆固醇的半衰期约为17 天,要准确地检测4β-羟基胆固醇的浓度,至少需要等到2 周以后,使浓度达稳态[38]。测定血浆中4β-羟基胆固醇和胆固醇浓度的分析方法有GC-MS/MS 法和HPLC-MS/MS 法[39,40]。
2 讨论
2.1 内源性生物标志物研究进展
CYP450 各亚型内源性生物标志物见表1。综上所述,CYP1A2、CYP2A6、CYP2C19、CYP2D6、CYP2E1 和CYP3A 主要的内源性标志物分别为褪黑素/6-羟基褪黑素、3HC/COT、AA/EET 和AA/19-HETE、5-MT/5-HT 和PIN/6-HO-THBC、LA/11-OH-LA、6β-羟基皮质醇/皮质醇和4β-羟基胆固醇/胆固醇。检测方法汇总见表2。
内源性生物标志物的相关进展主要体现在以下几个方面:(1)在某些研究选取的评价代谢酶活性的方法中,待评价的代谢酶不是该评价指标的主要影响因素,无法有效地评价酶活性,如CYP2C19 酶活性的评价指标11,12-和14,15-DHETs 水平不仅与CYP2C19 酶活性有关,同时与环氧化物水解酶有关[23],未来需要选取更合适的评价方法进行研究,证明内源性生物标志物的可靠性。(2)有些代谢酶的内源性生物标志物经过一定的临床研究后存在一些问题,如某些代谢产物(如5-HT 和4β-羟基胆固醇)半衰期过长,难以评价酶的快速变化,某些评价酶活性的方法与外源性探针代谢结果无显著相关性(如R6β-羟基皮质醇/皮质醇),提示需选择更可靠的内源性生物标志物或评价方法。(3)某些内源性生物标志物已通过临床研究证明其评价代谢酶活性的可行性(如3HC/COT 和皮质醇清除率),但这些内源性生物标志物如何更好地用于临床评价还需要深入研究。
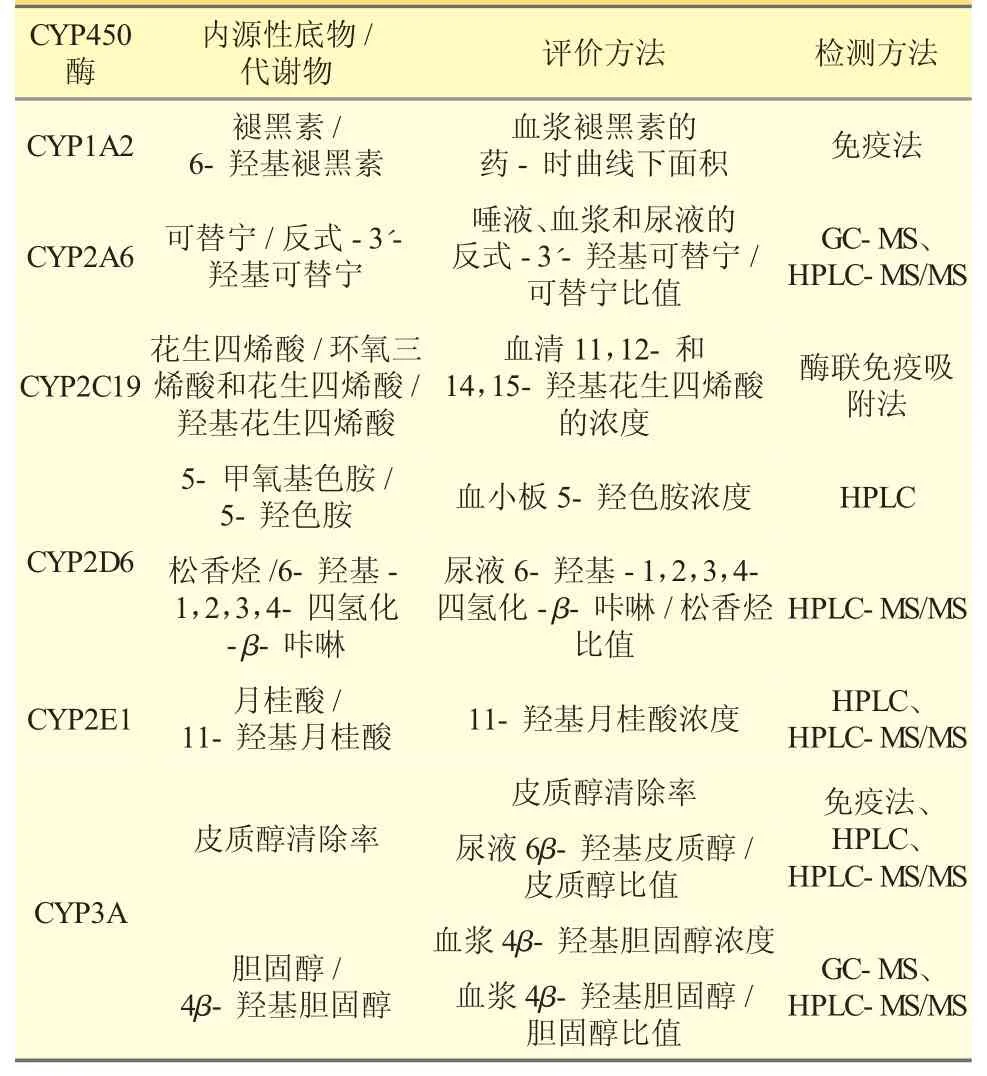
表1 CYP450 酶各亚型内源性生物标志物的评价方法汇总
2.2 酶活性评价及临床应用
评价酶活性的方法主要有内源性代谢底物浓度、内源性代谢产物浓度,以及内源性代谢产物/代谢底物的比值。应用较为广泛的是内源性代谢产物的浓度和内源性代谢产物/代谢底物的比值,而内源性代谢底物的浓度较少用于酶活性的评价,可能是由于内源性底物的浓度受到多种因素的影响,包括代谢酶代谢和底物的重新分泌等,导致结果不可靠。
在临床研究中需要注意:(1)应选择半衰期合适的内源性生物标志物浓度。若半衰期过长,需要待体内底物代谢完全后再采集生物样本,对受试者要求较高,若半衰期过短,代谢产物可能在采集之前已被代谢,需要严格控制采样时间。(2)应选择合适的生物样本。目前用于临床研究的有唾液、血浆和尿液,各个样本有其各自优缺点。体内大多数物质经尿液排泄,浓度较高,容易采集,但可能存在代谢途径差异、个体间的肾脏清除率差异等问题,使结果不准确[41]。血浆中内源性生物标志物的浓度更为稳定,但某些物质可能由于代谢较快而浓度过低,对检测要求更高,且采集过程需要抽血,受试者依从性较差。因此,可根据试验目的,选择快速、简便、准确的方法,测定各CYP450 酶活性的生物样本。(3)内源性探针的浓度存在个体间差异,建议临床研究时采集并测定基线值,以消除个体差异对CYP450 酶活性评价的影响。
3 小 结
内源性探针用于评价CYP450 酶活性不借助外源性探针药物,利用某些内源性物质及其代谢物的水平变化来反映酶的变化,具有更好的依从性[4]。本文汇总了这6 种重要CYP450 酶亚型内源性生物标志物的研究进展。目前,能用于准确评价CYP450 酶活性的标志物还不多,个体差异、半衰期等问题还需要进一步的探讨。期待今后会有更多的临床研究,发现更为合适的内源性探针和评价方法。
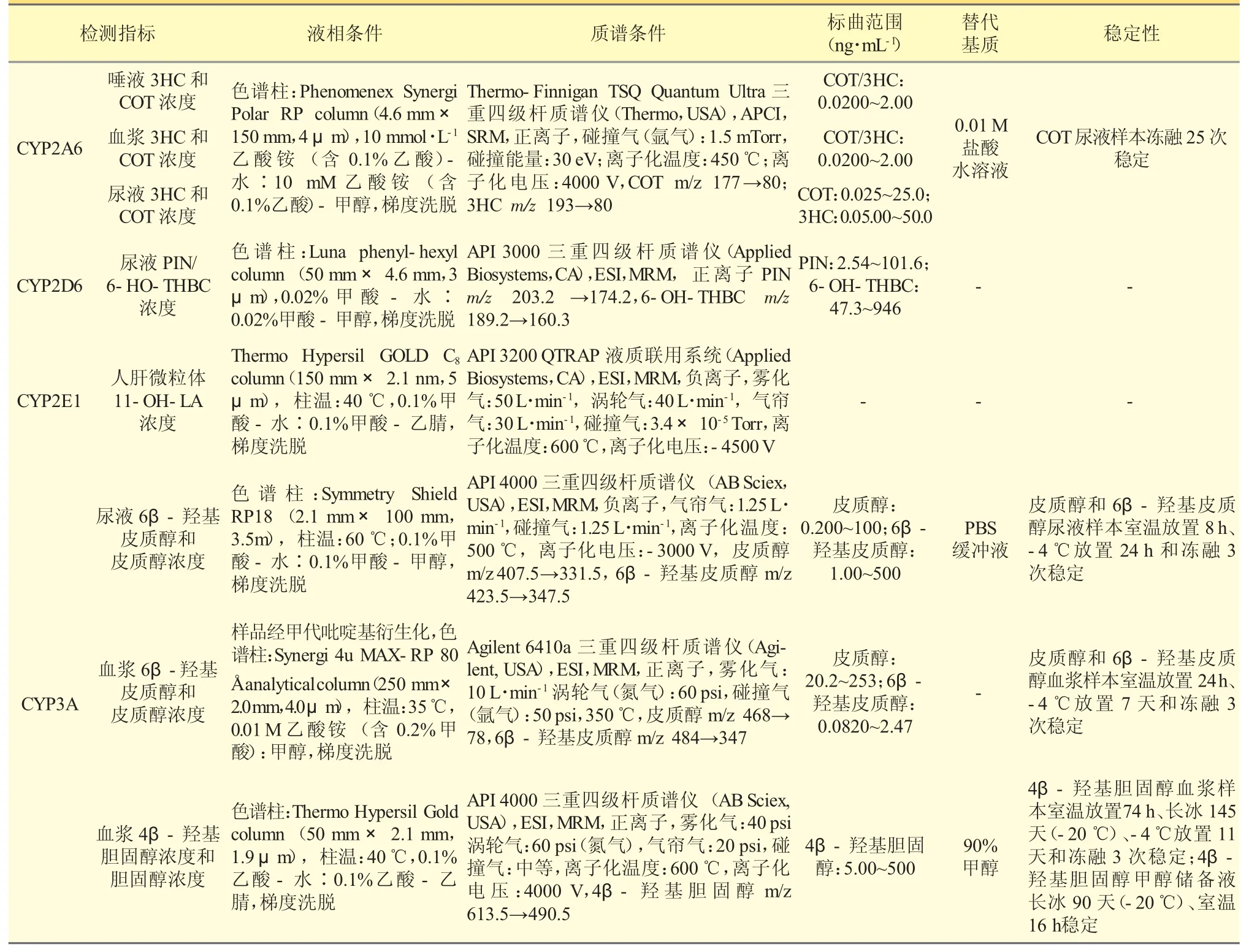
表2 CYP450 酶各亚型内源性生物标志物检测的HPLC-MS/MS 法汇总

