钙蛋白酶激活可促进大鼠透析相关性腹膜纤维化
李 芳,洪 雪,蒋建平
南方医科大学南方医院肾内科,广东 广州510515
慢性肾脏病已成为全球公共健康问题,据报道,美国、日本、中国等国家是终末期肾病的高发区[1]。腹膜透析(PD)是公认的肾脏替代治疗方案之一,全世界约8.5%的终末期肾病患者接受透析治疗,并在持续增长。然而,在接受持续不卧床腹膜透析治疗6年以上的患者中,约50%的患者存在容量负荷过重和超滤失效。随着时间的推移,PD患者残余肾功能的减退、腹膜纤维化的发生,最终导致腹透治疗失败[2]。如何减轻腹膜纤维化、保护腹膜功能,提高腹膜治疗效果,延长腹透治疗时间,提高透析质量是目前肾脏病界的重要问题。在PD治疗期间,透析液的生物不相容性(高浓度葡萄糖、低pH、高渗、葡萄糖降解产物和晚期糖基化终产物)、腹膜炎和尿毒症等因素,启动了腹膜固有细胞的活化,分泌多种细胞因子,促进纤维化的发展[3]。因而预防PD 患者腹膜纤维化是PD治疗和研究的重点之一[2,4]。
腹膜透析相关性腹膜纤维化发生其中最关键的是TGF-β1 因子的激活,但具体的分子机制尚未明确。随着对PF 发病机制的探索的进一步深入,防治的手段愈来愈多,如使用生物相容性腹膜透析液、抑制TGF-β1作用、保护间皮细胞、使用基因治疗、调节免疫功能、移植干细胞等。然而,需要注意的是,临床上仍未有治疗PF 的有效药物[5]。
钙蛋白酶(CAPN)是一种分布在胞质的钙依赖的半胱氨酸蛋白酶,参与许多种涉及钙的细胞功能,并有多种蛋白底物[6]。随着一些缺乏水解区域的CAPN家族新成员的发现及进一步认识,提示CAPN有可能参与某些与蛋白水解以外的功能。近年发现。CAPN的活化,可诱导胸膜间皮细胞COL I合成及细胞增殖增加,提示CAPN 在间皮细胞纤维化中发挥重要作用[7-8]。最近,CAPN家族的胃肠型CAPN9被报导是缓解转化生长因子β(TGF-β)β诱导小鼠乳腺癌细胞、人肺成纤维细胞、犬肾细胞以及人血管内皮细胞纤维化的治疗靶点[9]。然而,尽管近有报道显示CAPN于多种体内体外纤维化模型具有促进作用,但对于长期PD诱导的正常和受损腹膜中CAPN的表达模式和功能作用仍然知之甚少。因此本实验旨在通过探究CAPN的表达和活性变化是否参与腹透相关性腹膜纤维化的过程,为腹膜纤维化的治疗提供新的方向。
1 材料和方法
1.1 动物实验
选择8周、体质量为15~180 g的雄性SD大鼠,实验动物购自南方医科大学SPF动物实验中心。24只雄性SD大鼠被随机分为4组,6只/组。a组为不作任何处理的对照组;b组为生理盐水MDL28170(CAPN抑制剂)组,每日腹腔注射100 mL/kg的生理盐水+隔日腹腔内注射4 mg/kg MDL28170(Enzo life);c 组为腹膜透析组,每日腹腔注射100 mL/kg的4.25%葡萄糖腹膜透析液(Baxter);d组为腹膜透析+MDL28170组,MDL28170每日腹腔注射100 mL/kg 的4.25%葡萄糖腹膜透析液+隔日腹腔内注射4 mg/kg MDL28170。所有大鼠在首次腹腔内灌液后第8周处死。分别留取脏层和壁层腹膜备用。所有动物实验均经南方医科大学动物实验委员会批准,并符合该大学《实验动物的护理和使用指南》。
1.2 大鼠腹膜的组织病理学
腹膜组织用4%多聚甲醛(北京雷根)固定并包埋在石蜡中,切成4 μm石蜡切片,用苏木精和HE和天狼星红(Siris Red,北京雷根)对壁层腹膜组织进行染色,光学显微镜(×200)下观察,使用倒置显微镜自带的标尺功能,标化每张图片的比例尺,然后导入到image J测量测量腹膜组织厚度。每个切片中随机选择3个视野,取其平均值作为各部分的厚度。
1.3 大鼠腹膜间皮细胞的分离和培养
取200~250 g的雄性SD大鼠的大网膜组织用PBS充分洗涤以去除污染的红细胞,与预热的0.25%胰蛋白酶(Amresco)以及0.02%EDTA在37 ℃间断摇晃消化15 min。消化后,去除组织块,将细胞悬液悬液在4 ℃下以80×g离心10 min,然后在补充有10%胎牛血清(FBS,Gibco),青霉素(100 U/mL,Gibco)和链霉素(100 mg/mL,Gibco)的DMEM/F12培养基中在37 ℃,5%CO2条件下培养。每2 d进行换液。所有实验均使用第1和第3代之间的细胞进行。
将腹膜间皮细胞(RPMC)按照1×105接种于六孔板中,当RPMC生长汇合至70%,将培养基更换成含1%FBS的DMEM/F12培养基同步化24 h,分为4组。对照组:1%血清培养基培养;单纯MDL28170组:在用1%FBS的DMEM/F12培养的RPMC中,加入30 μmol/L的MDL28170;TGF-β诱导组:在用1%FBS 的DMEM/F12 培养的RPMC 中,加入10 ng/mL 的TGF-β(美国B&D);MDL28170联合TGF-β干预组:分3个亚组,分别使用10、20、30 μmol/L的MDL28170与10 ng/mL的TGF-β共孵育。孵育48 h后观察细胞的形态,采集各组细胞光镜下形态,收集细胞用于后续检测及实验。
1.4 钙蛋白酶活性的测定
使用荧光钙蛋白酶活性测定试剂盒(Abcam)定量钙蛋白酶活性。将上述体外培养的腹膜间皮细胞或留取的腹膜组织分别使用提取裂解液充分裂解后高速离心,分离上清,使用Bradford蛋白定量法检测蛋白浓度,然后通过荧光底物Ac-LLY-AFC检测钙蛋白酶活性。所有样品均使用多功能酶标仪(激发波长360 nm;发射波长460 nm,BMG CLARIOstar)进行3次重复分析,并表示为相对荧光单位(RFU)。
1.5 Western blot
采用Western blot和免疫荧光检测CAPN活化状态、FN 和Col-1在腹膜组织和RPMC细胞中的表达。为了测量在腹膜和腹膜间皮细胞中CAPN是否激活,使用特异性识别SBDP的抗体(MERCK Millipore),测定αII血影蛋白降解产物。αII血影蛋白含有特定的钙蛋白酶切割位点,CAPN1和CAPN2可以将250 000 的SBDP全长分解为150 000和12 000的产物。该方法已被广泛用于检测钙蛋白酶激活[10-12]。
分别将腹壁组织和RPMC在RIPA和蛋白酶抑制剂中裂解。使用BCA蛋白定量试剂盒进行蛋白定量。使用等量的总蛋白(20 μg)通过SDS/PAGE电泳分离,5%脱脂奶粉封闭1 h后转移到硝酸纤维素膜上,加入抗大鼠β-actin(Proteintech)、FN(Proteintech)、COL-I(武汉博士德)、SBDP(Millipore)、CAPN1(SIGMA)以及CAS1(Abcam)抗体,4 ℃过夜,次日TBST 洗膜后与相应的荧光二抗(LICOR)室温孵育1 h。在凝胶成像和化学发光图像分析系统(Odyssey)中采集图像。用Image J 软件进行蛋白条带定量分析。
1.6 免疫荧光
将不同分组的细胞悬液均匀铺在六孔板中的盖玻片上培养,细胞密度达到80%左右进行免疫荧光染色。用PBST洗涤3次,使用甲醇在-20 ℃固定20 min,PBST洗涤3次后使用5%BSA封闭2 h,将与在PBST中稀释的α-sma、角蛋白18(Proteintech)、波形蛋白(Vimentin,Proteintech)一抗在4 ℃孵育过夜,PBST浸洗3次然后与荧光二抗在室温下孵育1 h。细胞核用二脒基苯基吲哚(DAPI)(北京中杉金桥)复染,荧光倒置显微镜(OLYMPUS)观察并采集图像。
1.7 统计学分析
使用SPSS18.0软件进行统计分析,数据采用均数±标准差表示,采用单因素方差分析,组间比较使用t检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 大鼠腹膜组织的形态变化,CAPN抑制缓解了腹膜纤维化的进展
Sirius red染色显示,对照组大鼠腹膜间皮下区正常,组织结构正常;与对照相比,单独使用生理盐水和MDL28170组大鼠腹膜无明显增厚;PD组腹膜组织明显增厚,大量胶原沉积以及血管增生;MDL28170给药组的间皮下区纤维增生以及厚度明显小于PD 组的(图1)。而HE染色下,对照组以及单纯盐水给药组腹膜组织形态正常;腹膜透析组可见腹膜组织内大量炎性细胞浸润及新生血管增多;与腹膜透析组相比,腹膜组织的病理改变在CAPN抑制剂MDL28170治疗的大鼠中明显减弱,腹膜厚度变薄(图1A、B,P<0.01)
2.2 MDL28170 抑制钙蛋白酶活性后大鼠腹膜中CAPN的活性与表达变化
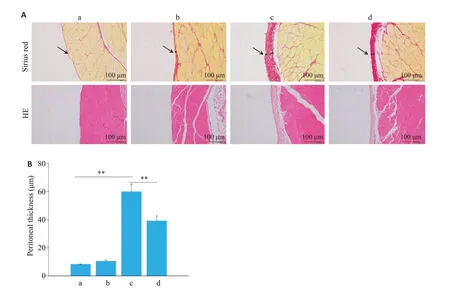
图1 对CAPN进行阻滞缓解了腹透液导致的腹膜增厚Fig.1 Blocking calpain reduces peritoneal thickening induced by peritoneal dialysis fluid(PDF).A:Sirius red and HE staining of peritoneal tissues of rats following peritoneal dialysis fluid challenges(week 8,original magnification:×200).B:Peritoneal thickness in the rats following the treatment(week 8,n=6).**P<0.01.
与正常对照组比较,腹膜透析组的COL I和FN 蛋白表达水平显著上调(图2A、B,P<0.01);腹膜透析+MDL28170组的COL I和FN蛋白表达水平较PD组下调(图2A、B,P<0.01)。同时,对比各组之间CAPN的表达和活性,腹膜透析组CAPN表达和活性显著高于其他各组(图2C、D,P<0.01)。生理盐水MDL28170组与正常对照组比较蛋白表达未有明显变化(图2,P>0.05)。
2.3 RPMC的培养及鉴定
原代大鼠腹膜间皮细胞贴壁后在光镜下观察呈铺路石状,细胞间连接紧密(图3A)。免疫荧光检测双标记腹膜间皮细胞波形蛋白和角蛋白18的表达,可见细胞胞质分别呈现代表波形蛋白的红色荧光、代表角蛋白18的绿色荧光以及重叠部分的叠加荧光(图3B)。
2.4 阻断钙蛋白酶活性后Western blot 检测RPMC 中CAPN的活性、FN和COL I的蛋白表达
检测各组细胞CAPN1、CAS1、SBDP切割带、FN和COL I的表达水平。结果显示在TGF-β组明显高于对照组、单纯MDL28170组和MDL28170联合TGF-β干预组(图4,P<0.01)。
2.5 体外抑制钙蛋白酶活性后腹膜间皮细胞α-sma的表达变化
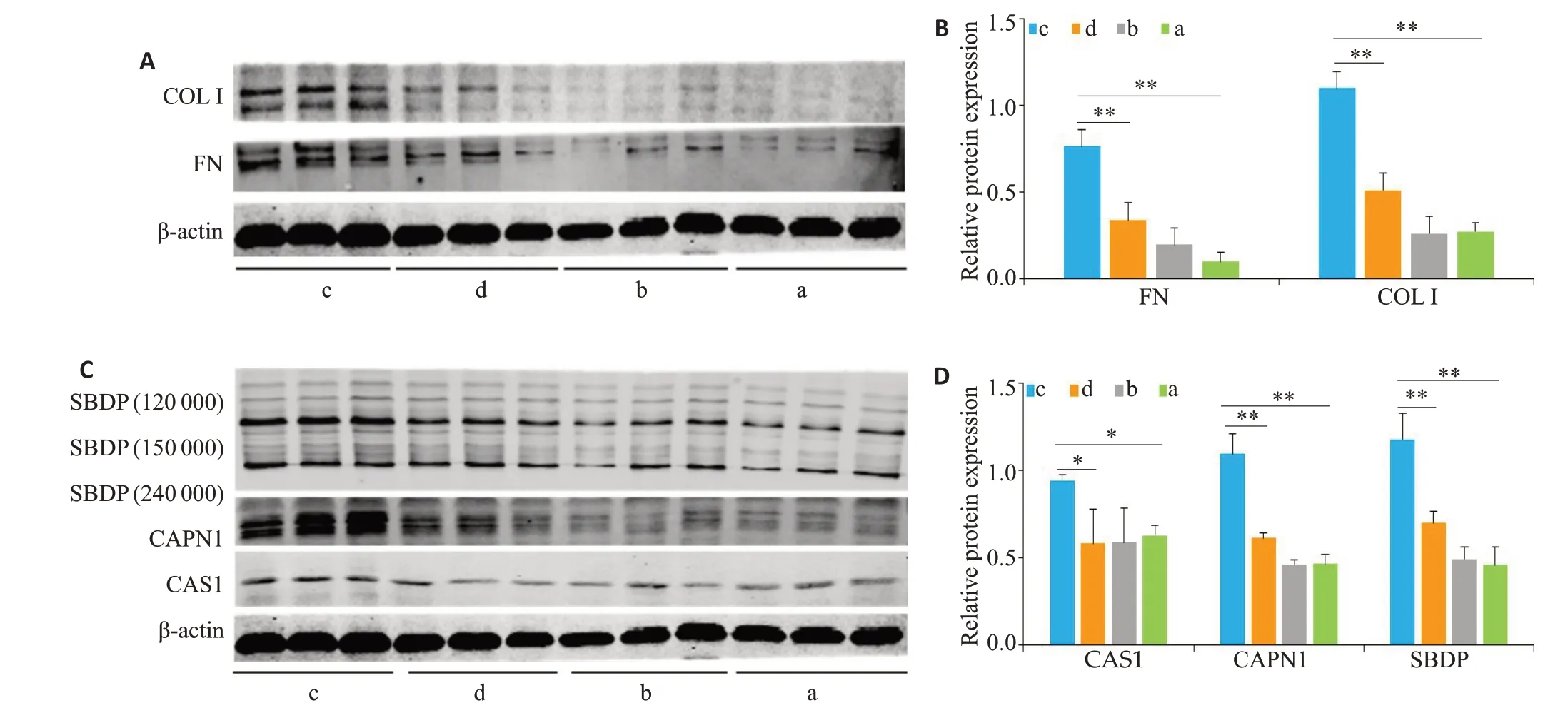
图2 阻滞CAPN对大鼠腹膜组织钙蛋白酶活性和表达、纤维化相关因子的表达的影响Fig.2 Efect of blocking calpain on the activity and expression of calpain and expressions of fibrosis-related factors in rat peritoneal tissues. A:Western blotting for detecting FN and COL-I expressions in the peritoneal tissue lysates. B:Quantitative analysis of FN and COL I expressions.C:Western blotting for detecting 150 000 cleavage fragment of SBDP,calpain1 and CAS1 expressions.D:Quantitative analysis of the levels of 150 000 cleavage fragment of SBDP,calpain1 and CAS1.**P<0.01;*P<0.05.
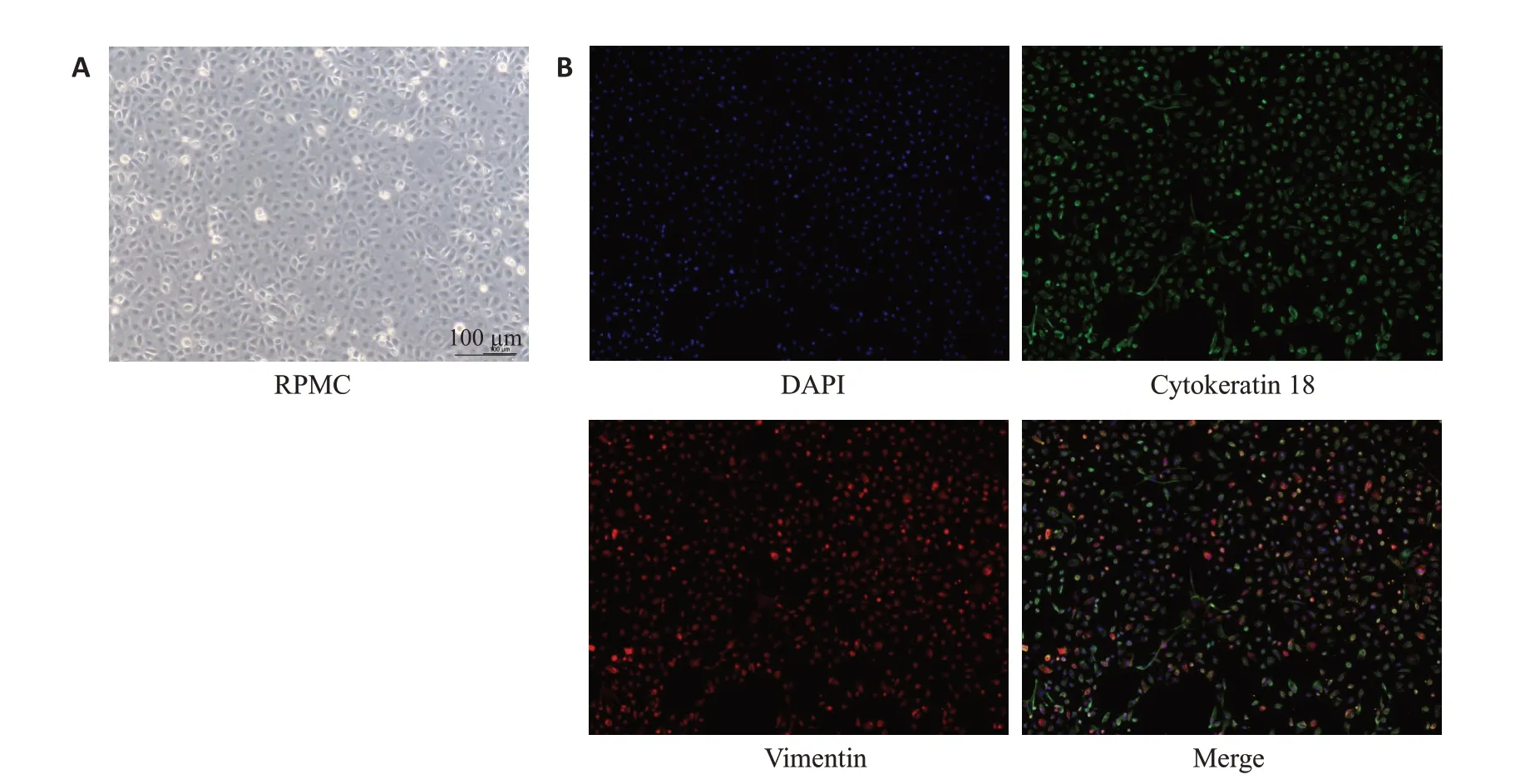
图3 大鼠腹膜间皮细胞观察和鉴定Fig.3 Microscopic observation and identification of primary rat peritoneal mesothelial cells (×100). A:Cobblestone-like appearance of normal mesothelial cells.B:Expressions of vimentin and cytokeratin 18.
通过免疫荧光标记反映腹膜间皮细胞表达促纤维化因子α-sma表达变化,结果显示,TGF-β组表达增加,与TGF-β组比较,加入MDL28170共孵育组α-sma表达减少(图5,P<0.01)。
2.6 TGF-β以及钙蛋白酶抑制影响RPMC形态
在倒置显微镜下观察,与对照组比较,TGF-β组细胞中拉长的星型或长梭形形态细胞增加。在进行了CAPN 抑制剂MDL28170 的共孵育后细胞形态相对TGF-β组有明显变化,更趋向于上皮样细胞的多边形形态(图6,P<0.01)。
3 讨论
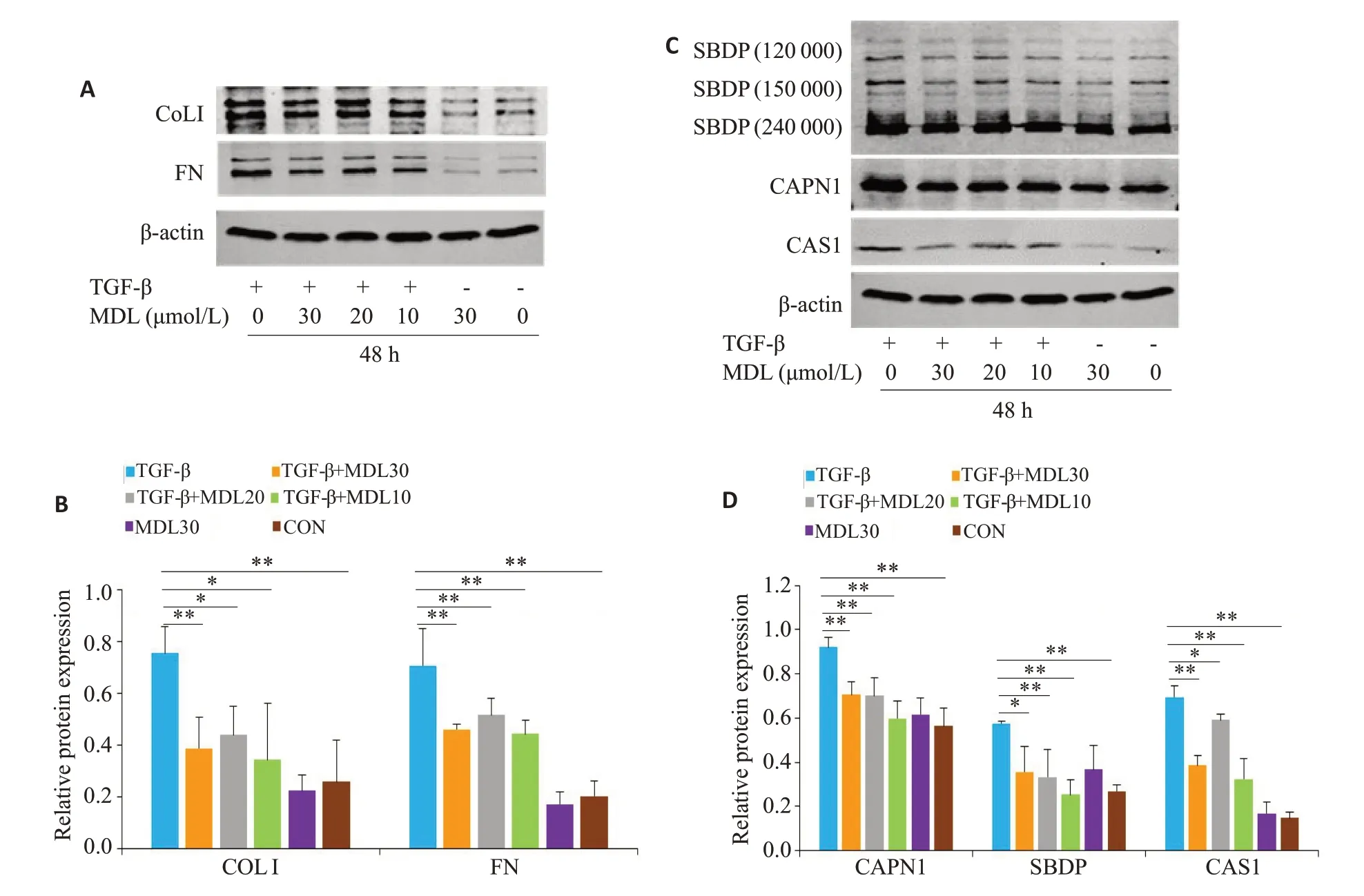
图4 钙蛋白酶阻断对TGF-β处理间皮细胞CAPN活化的影响以及纤维化相关因子的表达Fig.4 Effect of calpain blocking on fibrosis-related factors and calpain activation in rat mesothelial cells treated with TGF-β.A,B:Western blotting for detecting the expressions of FN and COL-I and results of quantitative analysis.B:Quantitative analysis of FN and COL I expressions.C,D:Western blotting for detecting 150 000 acleavage fragment of SBDP,calpain1 and CAS1 expressions and results of quantitative analysis.**P<0.01;*P<0.05.
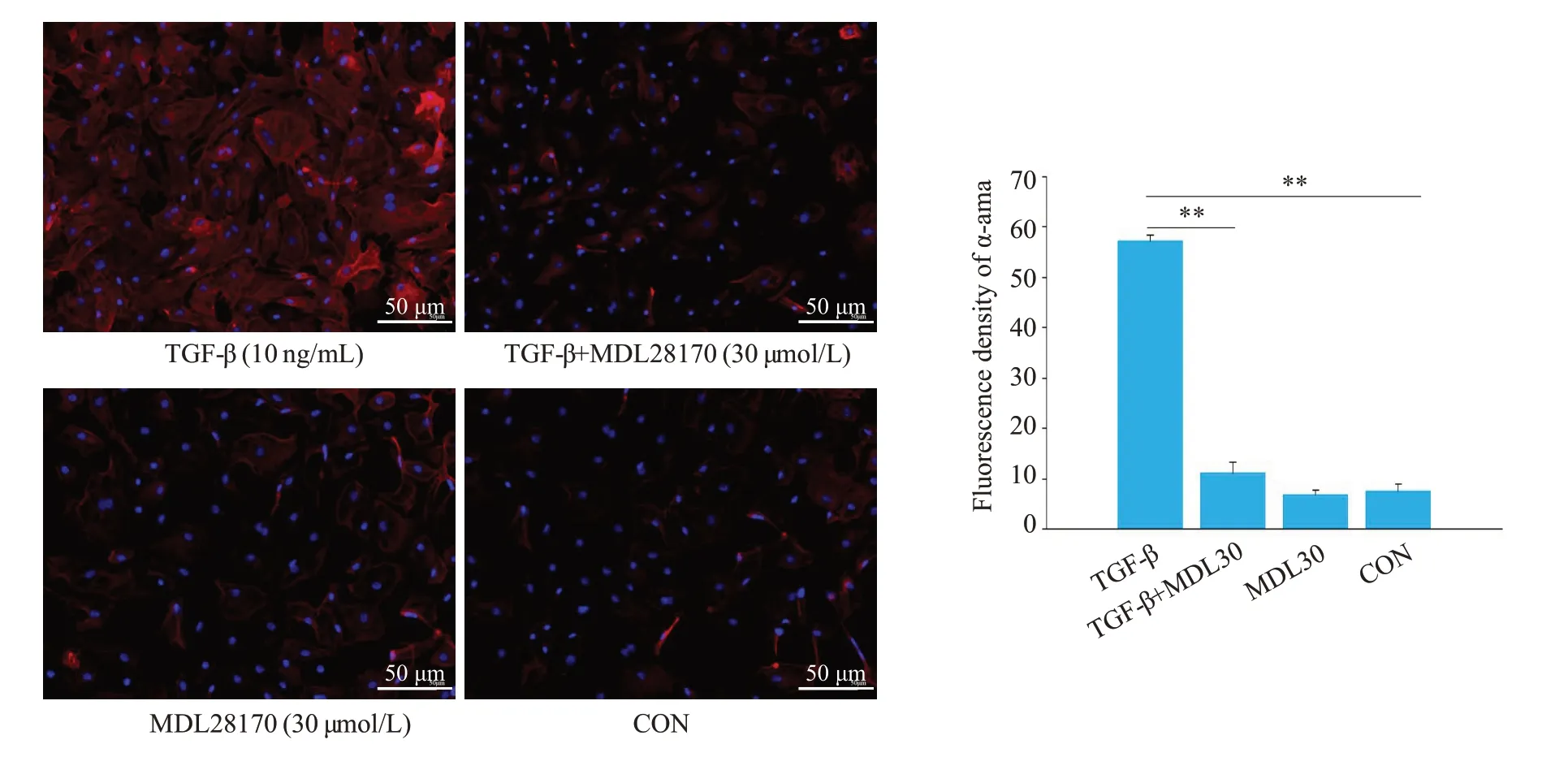
图5 大鼠腹膜间皮细胞免疫荧光观察纤维标志因子α-sma表达的变化Fig.5 Changes of α-SMAexpression in rat mesothelial cells treated with TGF-β,MDL28170,or both.**P<0.01.
本研究结果显示,CAPN参与了腹透相关性腹膜纤维化的进程,并起促进作用;抑制CAPN的活性,可以缓解腹膜纤维化的程度。CAPN是一组保守的钙敏感性半胱氨酸蛋白酶,在生物体内广泛表达,CAPN1 和CAPN2是其两种主要的典型代表,分别由一个不同的较大的约80 000催化亚基(CAPN1与CAPN2)和一个共同的约30 000小亚基(CAS1)协助维持钙蛋白酶活性,被认为与细胞融合和运动期间的细胞骨架重塑、信号转导途径中的分子水解修饰、调控细胞周期的酶降解、基因表达调控、某些凋亡途径的底物降解以及长程增强效应等有关[13]。研究发现,在CAS1敲除的小鼠肺纤维化模型中,肺动脉高压引起的血管重构被显著改善[14]。CAPN的抑制可以改善由血管紧张素II诱导的肺纤维化和胸膜间皮细胞的胶原蛋白过度增殖和纤维化[15]。
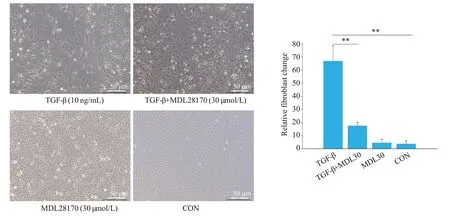
图6 大鼠腹膜间皮细胞TGF-β孵育以及钙蛋白酶抑制后形态变化Fig.6 Morphological changes of rat mesothelial cells treated with TGF-β,MDL28170,or both(×100).**P<0.01.
本研究以非肾衰腹膜透析模型大鼠为研究对象,通过每日腹腔注射腹膜透析液,8周后,腹膜组织增厚,并呈现纤维化的病理学改变;组织中CAPN的活性升高,CAPN1大亚基和小亚基表达上调。各组大鼠的病理改变显示,腹膜透析组大鼠腹膜显著增厚以及胶原纤维增生明显。CAPN的胞膜通透性抑制剂MDL28170可以显著抑制腹膜组织以上的一系列变化,这表明CAPN的活化在体内可以加重腹膜纤维化。
腹膜透析相关的腹膜纤维化所涉及的关键纤维化因子是TGF-β。TGF-β的激活是腹膜纤维化的一个重要的早期事件,在生物不相容性腹膜透析液广泛应用的背景下,高浓度的葡萄糖,葡萄糖降解产物和晚期糖基化终产物均可以诱导TGF-β的产生,促进腹膜纤维化的发生、发展[16]。高浓度的葡萄糖增加间皮细胞的I型和II型TGF-β受体(TGFR1,TGFR2)的表达[17]。随着治疗持续时间的延长,腹膜透析患者腹透引流液中的TGF-β水平明显升高[18-19],并与腹膜溶质转运特性相关[20]。本研究通过对RPMC的观察,同样发现TGF-β诱导间皮细胞的形态从规则的铺路石样转变为扩张伸长的长梭状的成纤维细胞。通过分子生物学的检测手段,发现TGF-β诱导了腹膜间皮细胞中CAPN的活性和CAPN1表达水平的升高;用CAPN 抑制剂MDL28170 对RPMC进行预处理后,TGF-β诱导的RPMC形态和纤维化标志物的这种变化得到抑制。
在肺纤维化中,COL I的上调与CAPN的活性增加是同步的,同时也显示TGF-β的活化形式与CAPN1共定位,药理性抑制和相关的基因敲除也说明CAPN在器官纤维化疾病中的重要作用,证明CAPN与器官纤维化相互联系[11,14,21]。本研究实验结果显示,与既往肺纤维化的钙蛋白酶相关文献结果趋势相符,但是并没有对CAPN 的底物SBDP 做形态学检验,因使用的抗体SBDP(美国Millipore,MAB1622),检测此分子最常用的抗体[10,12],无法单独识别SBDP全长或切割带,为求严谨只使用了Western blot在蛋白水平进行检测和定量。相对于目前的腹膜透析相关性腹膜纤维化的研究,与TGF-β相关的研究比较深入[22],但是钙离子相关的研究仍然较少,而腹膜透析患者往往存在钙磷代谢失调[23],目前尚未有钙蛋白酶与腹膜透析相关性腹膜纤维化的研究。
既往的钙蛋白酶相关研究表明,TGF-β的活化并上调下游相关基因转录过程中,CAPN起到了进一步激活的作用[24]。在细胞中,TGF-β1引起细胞内Ca2+浓度的快速,短暂和显著性上升[25-26]。在胞内钙离子浓度上升后,激活的CAPN可以使TGF-β从休眠复合物中释放出来,TGF-β通过Smad 2/3/CTGF通路对下游的相关纤维化分子进行转录调节[27-28]。而诱导Smad2/3磷酸化高度依赖钙,并受钙激活剂和螯合剂调控[29],提示钙蛋白酶在TGF-β诱导纤维化中起到重要介导作用。已有报道,CAPN1/CAPN2参与肺纤维化。本文尚未对钙蛋白酶参与调控TGF-β诱导的腹膜纤维化的具体信号传导进行深入研究,后续的研究将就TGF-β与钙蛋白酶之间相互作用的研究进行探讨,以希阐明其潜在机制。
综上所述,本研究发现CAPN参与了腹膜透析相关性腹膜纤维化的进程。下一步将对CAPN和TGF-β之间相互作用以及相应的可能的信号传导进行探讨,并阐明其机制,为寻找治疗腹膜透析相关性腹膜纤维化的手段提供线索。