晚期胃癌生存预后因素及列线图预测模型的建立与验证
张力苹,刘喜娟,林 卉,王嘉丽,张启周
广东省中西医结合医院肿瘤科,广东 佛山528200
2018年全球新发胃癌病例103万,其中超过78.3万人死亡,为世界上第五大最常见的癌症和第三大癌症相关死亡原因[1]。我国为胃癌高发地区,据2019年我国国家癌症中心统计数据,中国2015年胃癌发病率29.31/10万,死亡率为21.16/10万,其发病率及死亡率均居第3位,严重威胁着国人健康。我国目前胃癌早期筛查方面远不及日本,因早期胃癌症状不典型,当出现临床症状时,往往病变已进展到晚期;80%~90%的胃癌患者初诊时已是进展期、丧失根治性手术机会,且术后5年内复发多见[2]。近年来随着针对AGC患者的化疗药物、新型靶向药物及免疫治疗药物的不断研发,虽总体疗效及生存期有了一定提高,但患者总生存仍不乐观。
因目前AGC总体生存不理想,国内外学者一直在探索AGC生存的预后因素以更好指导临床实践。因不同地域、不同时间和不同治疗方案,有关胃癌生存预后因素的研究得出的结论也有所不同,目前认为与AGC患者总生存相关的危险因素包括如下[3-8]:体能状态(PS)评分、组织学类型、血清白蛋白水平、胆红素水平、乳酸脱氢酶水平、转移部位的数量、骨转移、腹膜转移、单核细胞/淋巴细胞比值、一线治疗PFS时间、一线化疗方案、一线化疗周期数等。列线图是建立基于风险的预测模型的一种可靠方法,在癌症相关研究中得到了广泛的应用。目前国外有关于胃癌根治术后复发、胃印戒细胞癌、胃鳞状细胞癌、以及曲妥珠单抗时代一线含铂方案化疗后胃癌患者生存的列线图预测模型的建立[4,9-11],认为可以较好帮助临床医生进行临床决策。但基于多线治疗,以及目前化疗药物及新型靶向、免疫药物治疗后AGC患者OS的列线图预测模型国内外暂未见报道。
为深入了解我院肿瘤科AGC患者的临床特征、治疗及生存情况,探索生存相关危险因素、建立可靠的AGC患者预后模型,为临床医生对AGC患者进行治疗决策提供临床依据,开展了此项研究。本研究于2019年10月10日通过广东省中西医结合医院伦理委员会审查。
1 资料和方法
1.1 纳入及排除标准
纳入标准:(1)2015年1月~2019年12月在我院肿瘤科诊治、临床确诊为AGC患者(病理学/细胞学及影像学诊断),AJCC 7th分期为Ⅳ期;(2)病历资料完整者。排除标准:(1)合并第二肿瘤者;(2)合并有重要脏器功能不全者(如合并心衰、呼吸衰竭、肝功能衰竭及肾功能衰竭者);(3)妊娠期妇女。
1.2 疗效评价标准
疗效评价按实体肿瘤的疗效RECIST 1.1版分为完全缓解(CR)、部分缓解(PR),病情稳定(SD)和疾病进展(PD)。客观缓解率(ORR)为CR和PR的总和,DCR为CR、PR和SD的总和。PFS时间指从化疗开始到疾病进展的时间、或者任何原因导致的死亡时间,以先发生者为准。OS时间指从化疗开始至死亡或末次随访的时间。本研究于2019年11月1日开始进行患者生存随访,随访日期截止至2020月8月31日,失访患者占3.3%(4/122),存活患者占23.2%(26/112)。
1.3 研究方法
采用回顾性调查分析方法,通过查询病历及电话随访记录所有纳入病例的临床资料及生存情况,并统计病人死亡情况,分析临床因素与病人死亡之间的关系,以及各因素对死亡的影响。
1.4 数据管理
采用Microsoft Excel数据库管理软件建立数据库,并对有关信息编码赋值。
1.5 统计处理
采用SPSS 26.0统计软件对数据统计分析,计数资料用百分比(%)表示,组间比较采用χ2检验;单因素分析和生存率计算采用Kaplan-Meier 法,组间比较采用Log-rank检验,多因素分析采用Cox比例风险模型。所有统计分析的检验水准均为α=0.05。列线图及校准曲线是用R软件绘制。基于多变量分析的结果,建立了1年及2年生存时间的预测模型。为了验证该模型的性能,计算了模型的C-index和校正曲线,以及随时间变化的ROC、AUC和DCA,以评价模型的判别能力。
2 结果
2.1 患者临床资料
共112例AGC患者纳入本研究(包括19例胃癌根治术后复发患者),其中男性60例,女性52例;年龄25~80岁,年龄51.07±1.27岁,中位年龄52岁,年龄≤65岁占80.4%(90/112)。本研究中病理类型为印戒细胞癌占20.5%(23/112),低分化腺癌占63.4%(71/112),Lauren分型为弥漫型患者占33.9%(38/112),HER2阳性患者占比21.4%(24/112)。2015~2017年期间我院胃癌患者未常规进行微卫星不稳定(MSI)相关检测,本研究中仅22 例患者有进行MSI 检测,其中错配修复基因缺陷(dMMR)患者4例,错配修复基因正常(pMMR)患者18例,dMMR 患者比例占18.2%(4/22)。初诊有21.4%(18/112)患者合并肝转移,38.4%(43/112)患者合并腹膜转移,12.5%(14/112)患者合并腹膜后淋巴结转移,22.3%(25/112)患者合并>2个部位转移(表1)。
2.2 单因素分析
对可能影响AGC患者生存期的16个预后变量进行单因素Kaplan-Meier法分析及Log-rank检验,经统计显示:胃癌转移部位数目、一线治疗疗效达到DCR、接受治疗线数、一线治疗PFS时间(≤7vs>7月),以及一线是否接受手术治疗共5个因素影响胃癌生存期,与AGC患者的预后密切相关(P<0.05)。而性别、年龄、病理类型、肿瘤分化程度、Lauren分型、MSI状态、HER2状态、肝转移、腹膜转移、腹膜后淋巴结转移及一线治疗疗效达到ORR共11个因素与AGC患者生存期无关(表2)。
2.3 多因素Cox回归分析
将Log-rank检验中P<0.2的6个因素分别进行比例风险(PH)假定,并纳入本次Cox多因素回归模型分析,以进一步探讨影响AGC患者预后的相关因素。结果显示,一线是否接受手术治疗、治疗线数、一线治疗PFS时间、腹膜转移共4个因素与AGC患者生存期显著相关,是影响AGC患者生存的独立预后因素(P<0.05,表3)。
2.4 列线图模型建立及验证
基于多因素分析的结果,综合了4个可预测的指标,我们构建了一个列线图,作为预测AGC患者1年和2年生存的模型(图1)。列线图显示一线治疗PFS时间(≤7月vs>7月)对预后影响最大,而合并腹膜转移对总生存的影响最小。每一水平的变量代表不同的分数,根据列线图得到总分。为了验证该模型的性能,我们计算了模型的C-index和校准曲线,证实了模型的一致性。C-index为0.785(95%CI,0.744~0.826),校准曲线表明我们的模型与实际观测结果有很好的一致性,X轴代表列线图预测的生存率,Y轴代表实际的生存率(图2、3)。
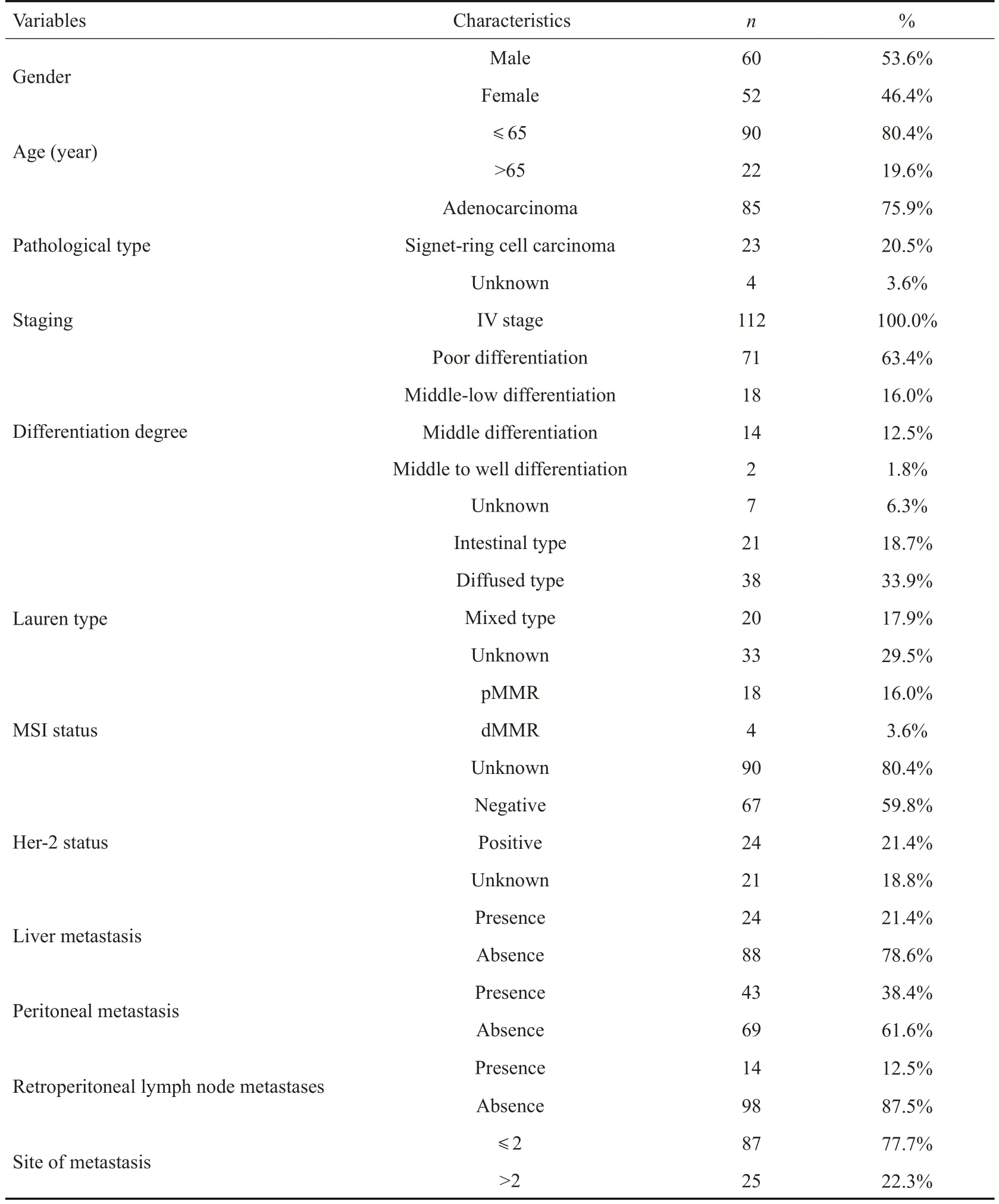
表1 患者临床资料Tab.1 Clinical characteristics of the patients
此外,我们发现随时间变化的ROC的曲线下面积(AUC)较大,列线图预测模型1年及2年OS的概率,AUC 值分别为0.911(95%CI,0.883~0.940)和0.913(95%CI,0.881~0.940),(图4、5)。进一步绘制列线图模型的1年及2年生存DCA,X轴表示阈值概率,Y轴表示净收益,黑色实线表示使用列线图预测模型的净收益,也证实了列线图预测模型的有效性(图6、7)。
3 讨论
胃癌目前仍是我国最常见的消化道恶性肿瘤,因其早诊率低、且趋年轻化,总体治疗效果欠佳,高度未满足患者的生存需求。因AGC患者总体生存情况不乐观,因此一直有学者在探索AGC生存及预后相关危险因素,以更好指导临床治疗决策。Kim等[8]研究发现,不良的PS状况评分、总胆红素升高、腹膜转移、骨转移以及超过1个转移部位,这5项是一线接受顺铂方案化疗的AGC患者生存不良预后因素。Lu等[12]学者的一项回顾性研究发现KPS评分、体质量指数和病理高分化是老年AGC患者生存期延长的有利因素,而血清乳酸脱氢酶水平升高及多发转移病灶与预后不良相关。Qiu等[13]学者认为T分期(P<0.001)、N期(P<0.001)、肿瘤大小(P<0.001)和Lauren分型(P=0.003)是胃癌患者的独立预后因素。一项接受多线治疗的AGC患者真实世界的回顾性分析[14],显示AGC 一线mPFS≥6.9 月、二线mPFS≥3.5月的患者预后较好。目前外科手术在AGC中的应用价值仍存在争议。Sato等[15]学者对AGC患者进行了一项回顾性研究,显示:与非手术组相比,手术组的中位生存时间明显更长(53月vs11月,P<0.0001)。R0 手术是OS 良好的独立预后因素(风险比(RR)=0.188,P=0.022)),对于提高术后长期生存至关重要。初始非根治性胃切除术可以减少严重的肿瘤相关并发症的发生,并可以延长部分亚组患者的总生存期,对于小于3个转移灶的年轻患者应考虑进行胃癌手术[16]。姑息性胃空肠吻合术可解决不可切除的晚期胃癌相关的胃出口梗阻,可改善患者进食,但是对PS状态差、C反应蛋白水平高和有化疗史的患者的获益尚不清楚[17]。
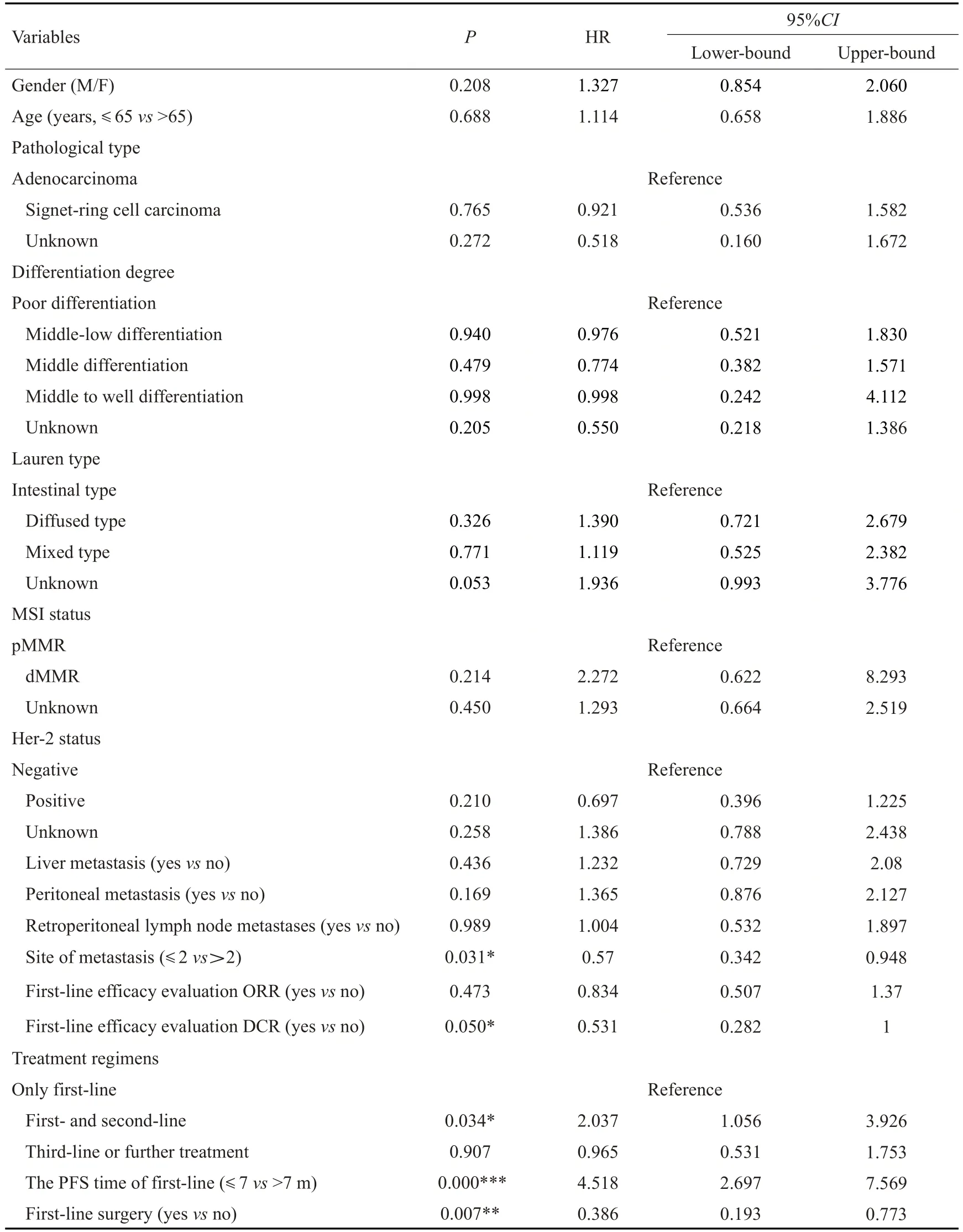
表2 晚期胃癌患者生存的单因素分析Tab.2 Univariate analysis of survival of patients with advanced gastric cancer
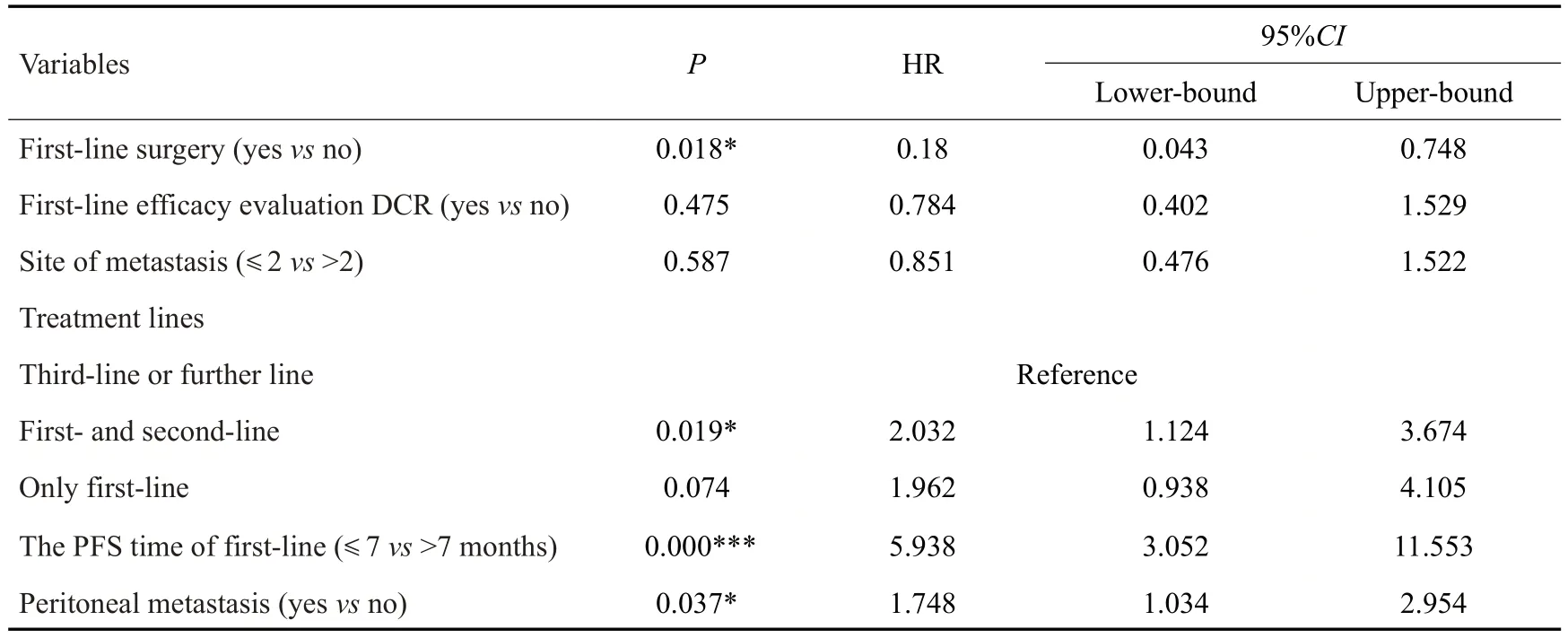
表3 晚期胃癌患者生存多因素分析Tab.3 Cox regression analysis of survival of patients with advanced gastric
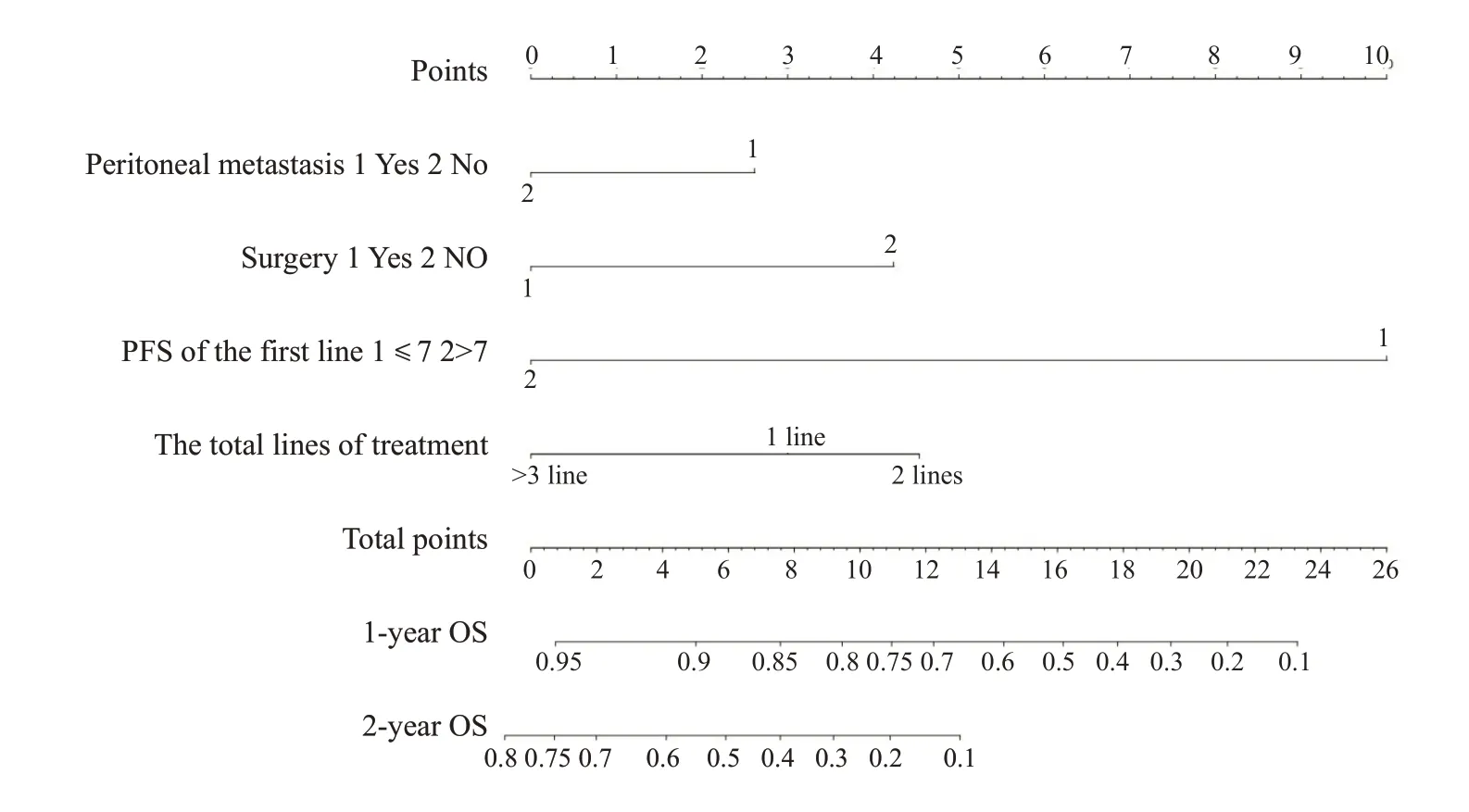
图1 AGC患者1年及2年OS的列线图预测模型Fig.1 Anomogram predicting the 1-and 2-year OS of AGC patients.
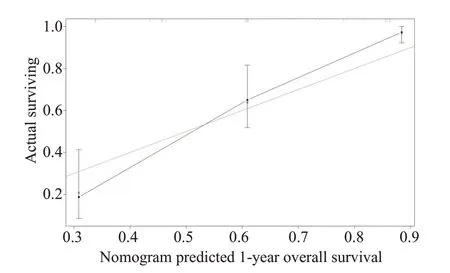
图2 1年OS列线图模型校准曲线Fig.2 Nomogram model calibration curves of 1-year overall survival.
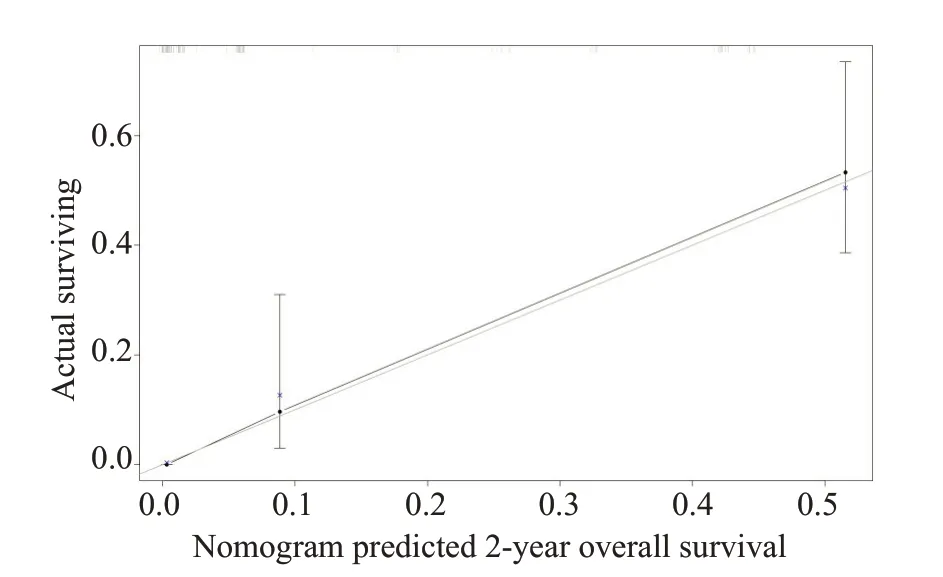
图3 2年OS列线图模型校准曲线Fig.3 Nomogram model calibration curves of 2-year overall survival.
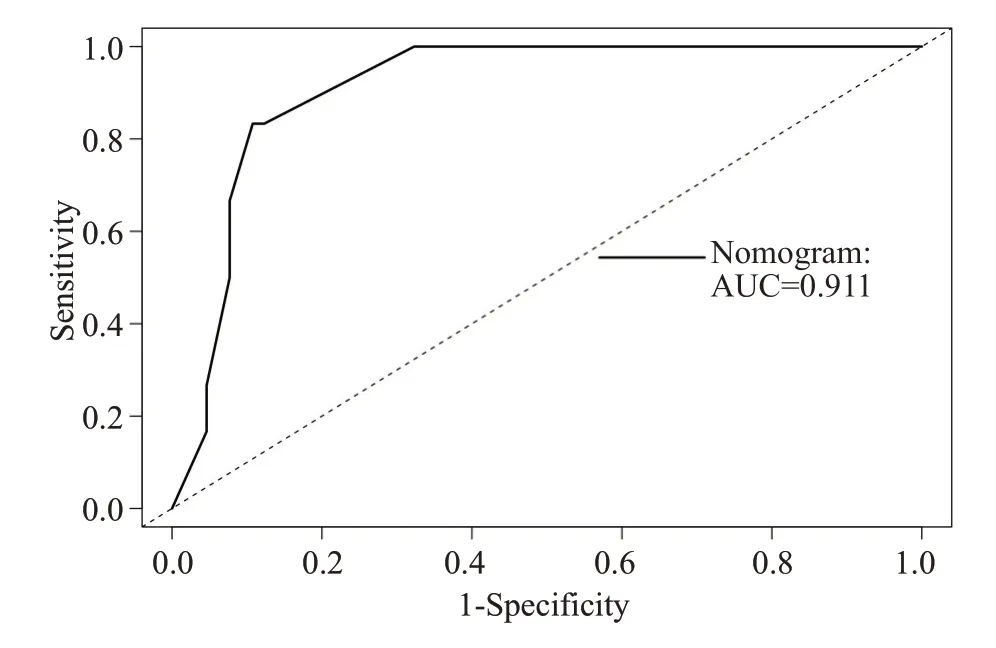
图4 列线图模型1年OS的ROCFig.4 ROC of 1-Year Overall Survival.
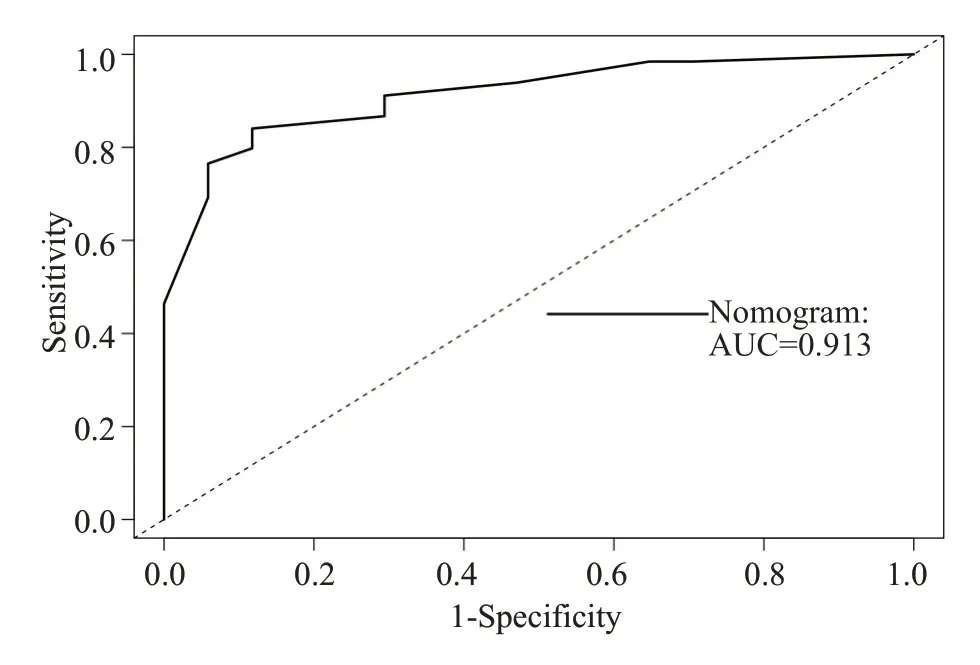
图5 列线图模型2年OS的ROCFig.5 ROC of 2-Year Overall Survival.
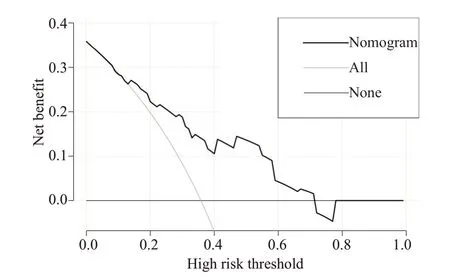
图6 列线图模型1年OS的DCAFig.6 DCAof 1-year overall survival.
本研究对当前化疗及新型靶向及免疫药物治疗下可能影响AGC患者生存的预后因素进行分析,多因素Cox回归分析显示,一线接受手术治疗、接受治疗线数、一线治疗PFS时间、腹膜转移共4个因素与AGC患者OS显著相关,是影响AGC患者生存的独立预后因素(P<0.05),这些在既往已发表的文献中尚有不同结论。AGC伴腹膜转移患者多合并肠梗阻、恶性腹水,合并营养风险的患者相对较多,治疗耐受性差,预后不佳,本研究中也是显示AGC伴腹膜转移患者生存期短。本研究对一线治疗包含手术治疗的20例AGC患者进行分析,手术包括胃癌姑息切除术/腹腔镜探查术/腹腔淋巴结清扫术/食管空肠吻合术/腹膜结节活检术/卵巢转移瘤切除术等,显示一线治疗包括手术的AGC患者生存获益,考虑这些选择手术的患者大多是转移灶比较局限,且姑息胃癌手术降低肿瘤负荷、减轻患者消化道出血及梗阻症状,并为接受后续系统抗肿瘤治疗提供条件,从而达到延长生存期,因此,对寡转移的胃癌患者考虑进行含手术联合化疗的系统治疗方案或许是一种更佳的选择,有望改善AGC患者生存期。一线mPFS时间较长(>7月)的AGC患者肿瘤相对惰性、且对治疗敏感,必然也是生存期占优势的人群,而能够接受三线及后线治疗的患者因总治疗强度增加、多线多种药物治疗机会导致患者总生存期延长。
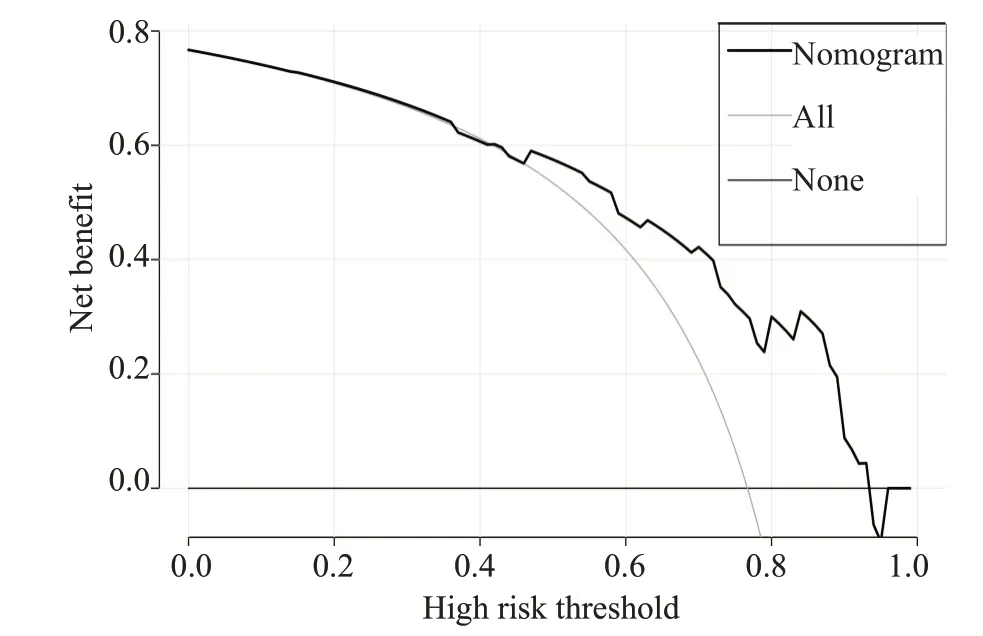
图7 列线图模型2年OS的DCAFig.7 DCAof 2-year overall survival.
列线图建立在多因素回归分析的基础上,可预测一定的临床结局或者某类事件发生的概率,其分析结果图形化、可视化,可帮助临床医生根据模型预测的预后制定临床决策。目前大多是关于放射技术结合临床特征诊断腹膜转移、淋巴结转移,恶性肿瘤术后复发风险,以及肿瘤患者特异性生存的列线图模型的研究进行报导[18-22]而AGC患者生存列线图模型较少报导。在当前化疗联合新型靶向及免疫药物、多线治疗条件下,AGC患者OS的列线图预测模型暂未见报道。在本研究中,我们根据多因素分析的结果获得了一些选定的指标,用来构建列线图,以及用来预测AGC患者1年和2年OS发生率。列线图显示一线治疗PFS时间(≤7vs>7月)对预后影响最大,而合并腹膜转移对总体生存的影响最小。C-index用于确认模型的预测准确性。越接近1,就越表明该模型具有完善的预测能力[23]。为了验证可预测的模型,我们计算了C-index和校准曲线。在校准曲线中,X轴代表预测的OS,Y轴代表实际的OS。本研究中列线图模型的C-index 为0.785(95%CI,0.744~0.826),校准曲线表明我们的模型与实际观测结果有很好的一致性,证明了我们模型的准确性和有效性。ROC和DCA是常用的预测模型,都可以用来评价不同模型的优劣,ROC 结合了所有灵敏度与特异度通过比较AUC决定预测模型的准确性,而DCA是用来预测临床结局变量的模型,后者是根据不同影响因素构建的模型来预测临床结局。在这项研究中,我们将影响生存的这些指标都进行了分析(图4~7),我们证明了列线图预测生存的有效性和实用性。我们发现列线图预测模型对应的ROC 的1 年、2 年生存的AUC 值分别为0.911 和0.913,DCA也证实了列线图预测模型的有效性。因我们纳入均为M1的AGC患者,没有完整TNM分期信息、未能在ROC及DCA中与TNM分期进行生存对比。
因此,本研究为AGC患者构建了可靠的预后风险评估模型,AGC患者都可以根据列线图找到一个总分,然后对未来的生存进行评估,具有较强的临床指导作用。对于得分高的AGC患者,临床医生可以更及时地做出治疗干预及治疗方案调整,以改善预后。我们通过多种验证确定了本模型的可靠性和准确性,而且证明了列线图对于AGC患者具有更好的预测,它可以为临床工作提供更多的信息。
虽然我们取得了有意义的结果,但也存在一些局限性。首先,可能存在选择偏差,因为所有纳入这项研究的患者都有竞争风险,部分细节不完整的患者被排除在外,其次,没有对我们的模型进行外部验证,而这些被认为是最可靠的验证。