阿霉素-甘草酸分子复合物的制备及体外抗肿瘤活性
吕雪丽,刘 媛,祝瑶露,3,赵博欣,3,魏 理,李国锋~4
1广州医科大学附属第一医院药学部,广东 广州 510120;南方医科大学2南方医院药学部,3南方医院合理用药评价与药物递送发展实验室,4药学院广东省新药筛选重点实验室,广东 广州510515
阿霉素是临床上常见的抗肿瘤药物之一,在体内有广泛的非选择性分布特点。因此,化疗不良反应明显,毒性较大[1-3]。甘草在中药方剂中使用相当普遍,通常作为佐药和使药,起着调和诸药的作用,也常与有毒中药配伍使用,减轻有毒中药的器官损伤、改善毒性损伤指标以及减少毒性药物不良反应等[4-7]。其中,甘草酸是中药甘草的主要活性成分之一,其结构特征上有活性-COOH基团,可能在中药煎煮过程中与其他药物发生反应或者生成新的化合物,由此猜想其是否容易与带NH4+的阿霉素之间通过非共价键结合形成分子复合物?
另一方面,甘草酸自身又是一种表面活性剂,能够提高药物的溶解度[8-11],基于甘草酸的结构和功能特性,我们构建了ADR-GL分子复合物,并对之进行初步表征和抗肿瘤效果评价。
1 材料和方法
1.1 仪器与试药
岛津高效液相色谱仪(岛津LC-20A 系列,日本岛津);离心机(Eppendorf);红外光谱仪(FT-IR)(Vertex 70,Bruker);差示量热扫描仪(DSC214 polyma,NETZSCH);EYELA 直立型N-1100 V型旋转蒸发仪(上海亚荣生化仪器厂);SHZ-D循环水式真空泵(郑州华特仪器设备有限公司);5804R Eppendorf冷冻离心机(Eppendorf);流式细胞仪(BD)。
甘草酸(纯度>98%,北京百灵威科技有限公司);盐酸阿霉素(纯度>98%,大连美仑生物技术有限公司);盐酸阿霉素标准品(Adriamycin hydrochloride,国家药品标准物质,中国食品药品检定研究院);甘草酸标准品(Glycyrrhizic Acid,北京百灵威科技有限公司);甲醇、乙腈(色谱级,Merck);水为超纯水;氢氧化钠、三乙胺、磷酸等均为国产分析纯。
1.2 实验细胞株
HepG2细胞(目录号SCSP-510)购自中科院上海细胞库;MDA-MB-231乳腺癌细胞于广东省中医院大学城院区王胜奇研究员处获得。
1.3 ADR-GL分子复合物的制备
固定阿霉素物质的量为0.2 moL,按照阿霉素与甘草酸的摩尔比(ADR:GL=2∶1,1∶1,1∶2时,其对应GL的量分别为0.1 moL,0.2 moL,0.4 moL)分别称取阿霉素与甘草酸于相应的锥形瓶中。阿霉素中加入6 mL 66.7%乙醇充分溶解,再滴入适量0.1 mol/L NaOH(1.7~1.8 mL,万不可过量)脱盐,乙醇终浓度约为50%;甘草酸中则加入50%乙醇,搅拌使之充分溶解;将脱盐后的阿霉素在高速搅拌下逐滴缓慢滴加到甘草酸50%乙醇水溶液中,滴加结束后继续搅拌1~2 h;转移溶液至旋蒸瓶中,用旋蒸蒸发仪蒸干溶剂,得干燥ADR-GL固体复合物,刮下,加入5 mL pH=7.4的磷酸盐缓冲液于超声下尽量使之溶解,最后于3000 r/min离心5 min,取上清即得ADR-GL分子复合物溶液。
1.4 pH 7.4磷酸盐缓冲液的制备
采用磷酸氢二钠(Na2HPO4)和柠檬酸(C6H8O7)配制磷酸盐缓冲液,加入的具体用量参考表1。
1.5 ADR-GL分子复合物的表征
1.5.1 红外光谱法 将阿霉素、甘草酸、ADR+GL物理混合物、及ADR:GL=2∶1,1∶1,1∶2分子复合物干燥样品在FT-IR中压片,在4000~500 cm-1波数范围扫描测定红外光谱[12],并对不同样品的红外光谱图进行分析比较。
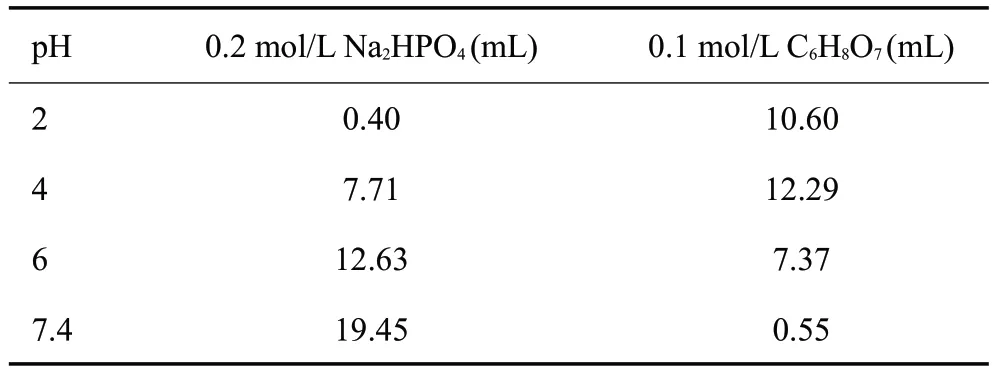
表1 不同pH磷酸盐缓冲液的配制Tab.1 Preparation of different pH phosphate buffers
1.5.2 差示扫描量热法 将阿霉素、甘草酸、ADR+GL物理混合物、及ADR:GL=2∶1分子复合物干燥样品密封并放置于铝盘中,填充氮气,形成真空条件。利用差示扫描量热仪进行示差扫描量热记录,设定以10 ℃/min的速度将温度从20 ℃上升到300 ℃。
1.6 阿霉素的溶解度测定
1.6.1 色谱条件 色谱柱:反相Ecosil C18柱(5 μm,4.6 mm×150 mm);流动相:乙腈-磷酸三乙胺缓冲液(25∶75,v/v),(pH 2.5);检测波长:254 nm;柱温:40 ℃;流速:1.0 mL·min-1;进样量:20 μL;检测器:紫外检测器(SPD-20A);分析时间:12 min。
1.6.2 标准曲线 精密称量阿霉素标准品5 mg用甲醇溶解并定容至10 mL,得到500 μg/mL的阿霉素标准溶液母液,置4 ℃冰箱避光储存备用。
精密吸取一定量的阿霉素标准品母液,分别用甲醇稀释至浓度为2.5、10、40、160、200、320 μg/mL。经离心机14 000 r/min 离心15 min 后取上清,进样量20 μL,按“1.6.1”色谱条件测定。以药物浓度(μg/mL)x为横坐标,峰面积y为纵坐标回归分析,得到的方程为y=60 994x-22 995;R²=1。表明阿霉素在2.5 μg/mL~320 μg/mL浓度范围内,线性良好(图1)。
1.6.3 精密度测定 精密吸取阿霉素标准品母液,分别用甲醇稀释,配制浓度为10、40、160 μg/mL的3个浓度水平的标准品溶液,于1 d内每个浓度分别测定3次,计算日内精密度;同法分别测定3 d,计算日间精密度[13](表2)。
1.6.4 专属性考察 精密吸取一定量的阿霉素标准品,在“1.6.1”色谱条件下测定得到色谱图2,如图所示阿霉素的保留时间为8.4 min。精密吸取一定量的空白溶液甲醇,在同样测定条件下,甲醇作为溶剂,只出现了溶剂峰,且与样品峰完全分离(图3),证明甲醇在样品出峰处不会造成干扰。精密吸取一定量的甘草酸溶液,在同样条件下进样分析,甘草酸溶液在样品出峰处不会造成干扰(图4)。精密吸取一定量的阿霉素标准品,加入适量的甘草酸溶液(阴性对照),HPLC测定含甘草酸的阿霉素溶液(图5),甘草酸的加入并不影响阿霉素峰,分离度高。
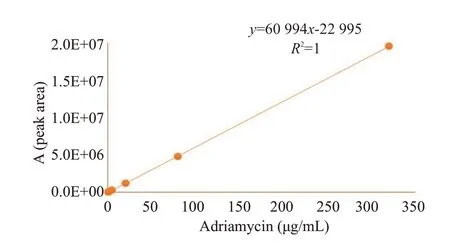
图1 阿霉素的标准曲线Fig.1 Standard curve of Adriamycin.
1.6.5 加样回收率试验 精密称量适量制备的阿霉素样品,用甲醇溶解并稀释成一定浓度的阿霉素样品溶液,进样20 μL测定其浓度,再分别定量加入不同浓度的阿霉素标准品溶液(分别由阿霉素标准品母液用甲醇稀释成浓度为10,40,160 μg/mL),每个浓度分别测定3次,计算回收率。回收率计算公式为:回收率=测得量/(样品中药物的量+加入量)×100%(表3),所测得回收率在93%~104%之间,RSD均小于2%,证明该方法用于测定阿霉素的含量,回收率较高。
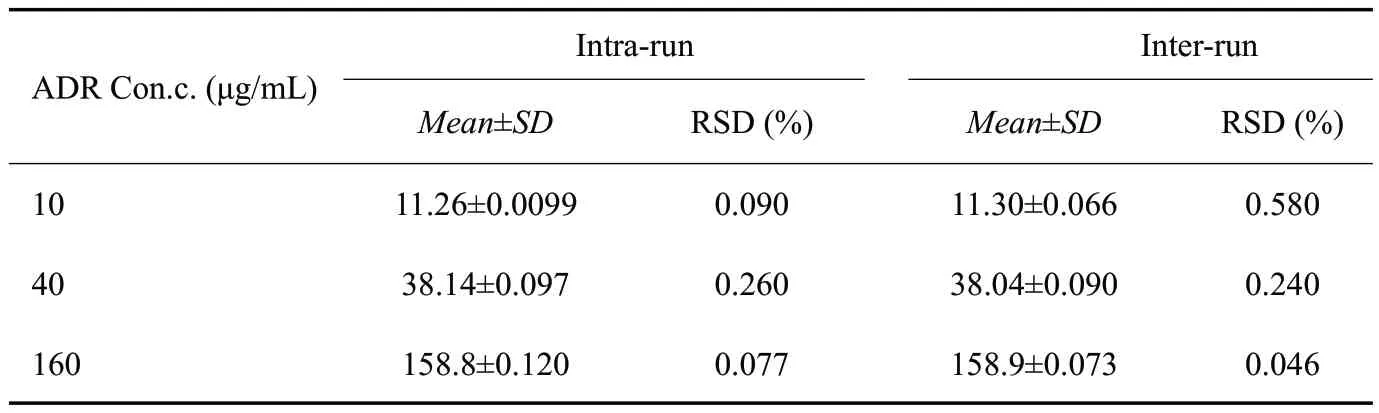
表2 阿霉素的日内、日间精密度Tab.2 Intra-day and intra-day precision of adriamycin(n=3)
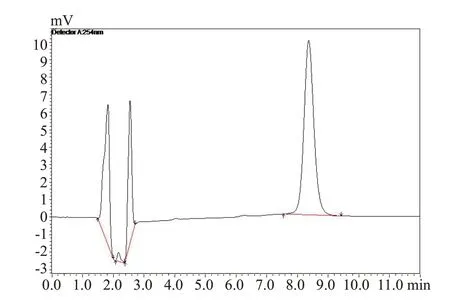
图2 ADR标准品的HPLC色谱图Fig.2 HPLC chromatogram of ADR.
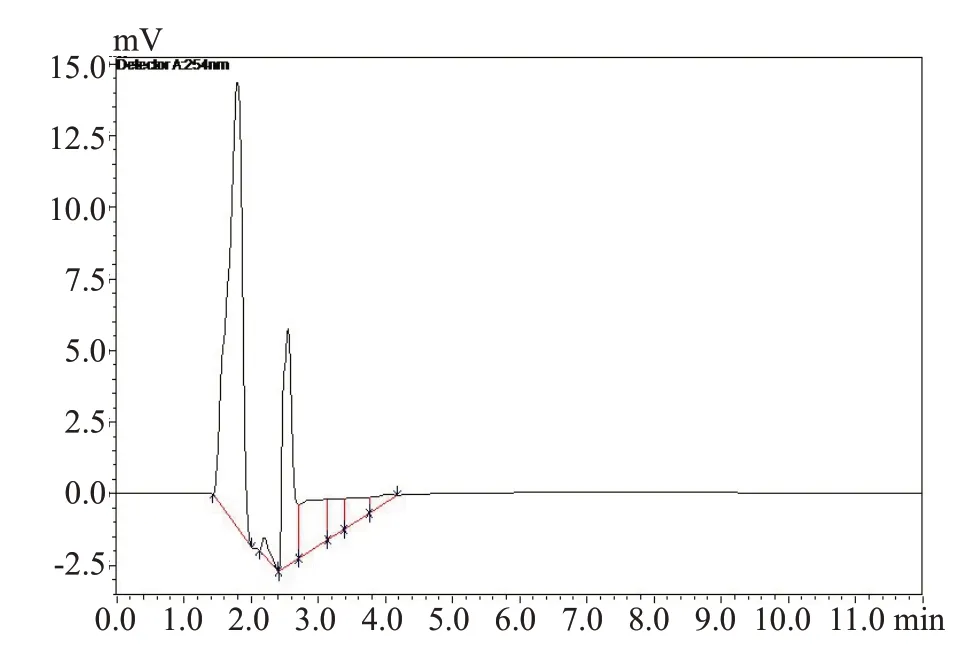
图3 空白溶剂-甲醇的HPLC色谱图Fig.3 HPLC chromatogram of methanol.
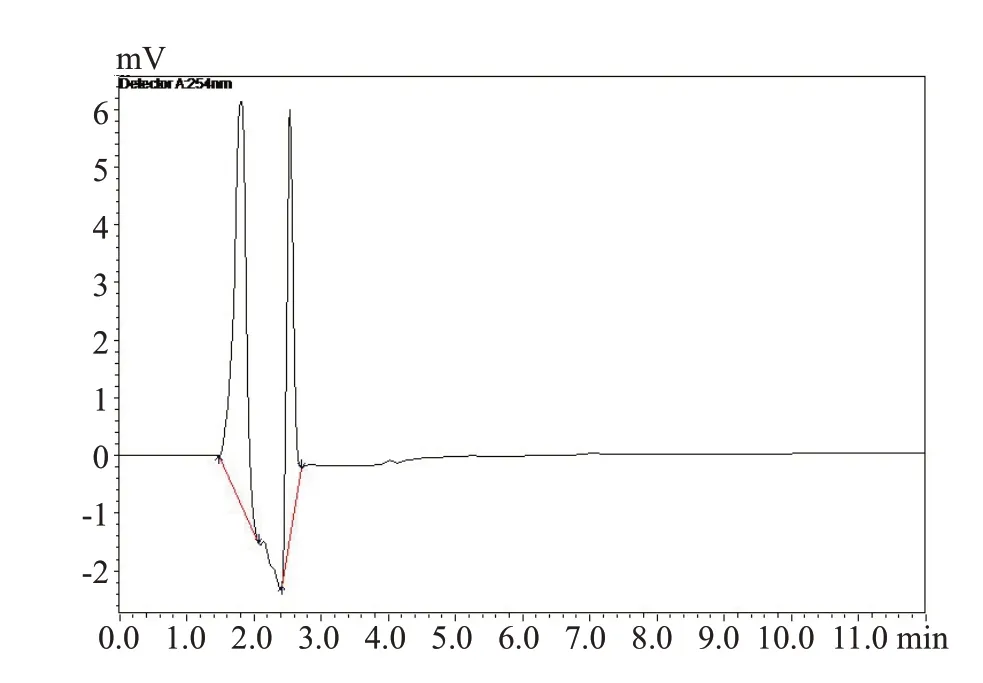
图4 甘草酸HPLC色谱图Fig.4 HPLC chromatogram of glycyrrhizin.
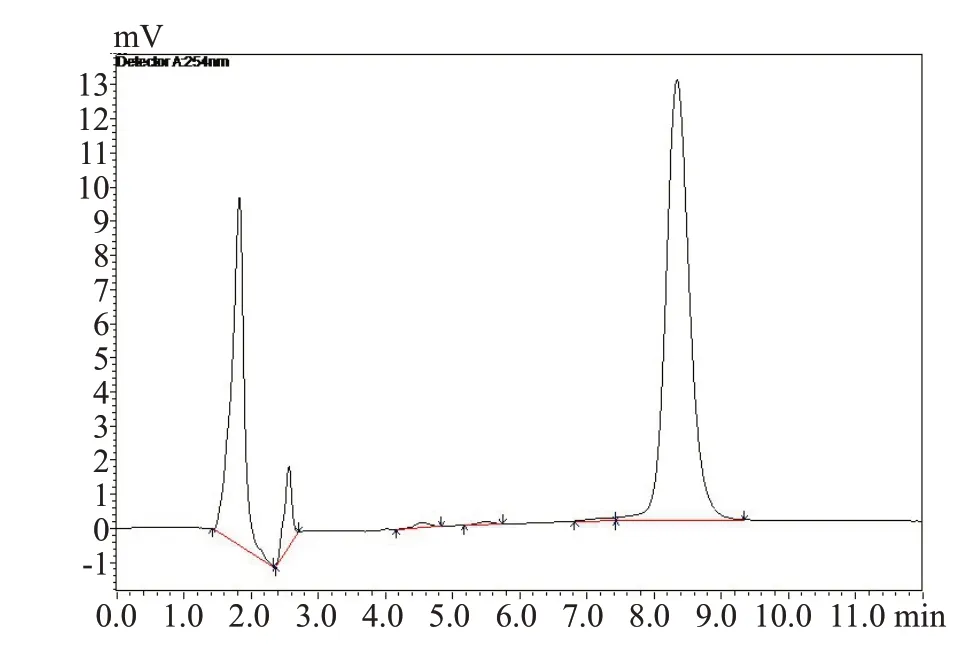
图5 ADR+GL 物理混合物HPLC色谱图Fig.5 HPLC chromatogram of ADR+GLmixture.
1.6.6 浓度测定 取20 μL阿霉素饱和溶液,用甲醇稀释10倍,12 000 r/min离心15 min,取上清进HPLC分析。
1.7 ADR-GL复合物抗肿瘤活性测定
1.7.1 MTT 法测定阿霉素及ADR-GL 对肝肿瘤细胞HepG2体外增殖的影响 HepG2细胞消化后收集于无菌10 mL EP管中,用Countstar细胞计数板计数,稀释细胞浓度为8×104/mL,每孔100 μL接种于96孔板,即终浓度为8000/孔,边缘孔不加细胞,用无菌PBS缓冲液填充后放入细胞培养箱中继续培养24 h。分为空白对照组、阴性对照组(不含药物的DMEM培养基培养)、阿霉素对照组(ADR浓度依次为0、0.5、1、4、8、16、32 μmol/L)和ADR-GL(2∶1)分子复合物组(其中ADR浓度依次为0、0.5、1、4、8、16、32 μmol/L)。药物作用24 h后每孔加入20 μL 5 mg/mL的MTT溶液,混匀,放入细胞培养箱中等待4 h,用1 mL注射器沿边缘小心吸去孔内培养液,弃去,然后每孔加150 μL普通DMSO(可以观察到部分组别细胞颜色出现紫色),将96孔板置于微孔板振荡器上低速振荡5~10 min使紫色结晶物充分溶解,最后在酶标检测仪570 nm处测定各孔的吸光度(A570nm)。按下式计算各组药物对细胞的活力影响:
细胞活力(%)=1-(1-A570nm实验组/A570nm对照组)×100%
1.7.2 流式细胞仪测定阿霉素及ADR-GL对MDA-MD-231肿瘤干细胞群比的影响 将MDA-MD-231细胞按1×106/孔接种在六孔板上,分为空白对照组、阿霉素对照组和ADR-GL(2∶1)分子复合物组。对照组为MDAMD-231 细胞不加药物培养24 h,阿霉素对照组在MDA-MD-231细胞中加入0.25,0.5,1 μmol/L阿霉素培养24 h,ADR-GL(2∶1)复合物组在MDA-MD-231细胞中加入ADR浓度为0.25,0.5,1 μmol/L的ADR-GL复合物培养24 h。药物处理完毕后将细胞用PBS洗涤两次,加入CD44抗体在暗处孵育20 min后用流式细胞仪进行分析,计算CD44阳性(CD44+)的MDA-MB-231细胞所占总的MDA-MB-231细胞的比例。
1.8 数据处理
统计学分析采用GraphpadPrism 5.0软件,结果以均数±标准差表示,通过one-way ANOVA with Tukey posthoc test对多组进行分析。P<0.05被认为差异具有统计学意义。
2 结果
2.1 ADR-GL复合物的制备与表征
旋蒸后的ADR-GL复合物呈亮红色、透明晶体状(图6)。红外光谱分析(图7)结果显示,与阿霉素对照组相比,ADR-GL复合物1525 cm-1碳碳双键吸收峰消失;DSC图示(图8)阿霉素在239 ℃处存在熔融峰,但此峰在ADR+GL Physical mixture(物理混合物)和ADRGL Complex(ADR-GL分子复合物)中均消失,且ADRGL分子复合物在86 ℃出现一个明显的新吸收峰,表明阿霉素可能被甘草酸所包裹而以ADR-GL分子复合物的新形式存在。
2.2 不同比例的ADR-GL复合物在pH=7.4的磷酸盐缓冲液中阿霉素溶解度
研究发现,随GL用量增加,阿霉素的溶解度逐渐升高(图9),与阿霉素对照组相比,ADR-GL分子复合物组阿霉素溶解度均具显著性差异(P<0.05),ADR∶GL=2∶1、1∶1、1∶2 的ADR-GL 复合物在pH=7.4 磷酸盐缓冲液中阿霉素的溶解度分别为2.109,3.630,5.562 mmol/L,其中ADR∶GL 2∶1的分子复合物阿霉素溶解度最高,是阿霉素对照组的6.3倍。将应用于下一步抗肿瘤活性研究中。
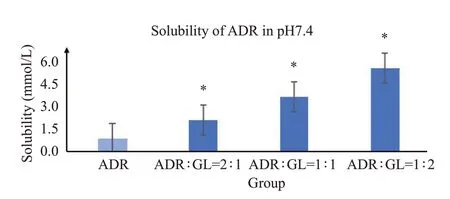
图9 不同比例的ADR-GL复合物在pH=7.4磷酸盐缓冲液中的溶解度Fig.9 Solubility of ADR in pH7.4 phosphate buffer in different ratios of ADR-GLcomplex.*P<0.05 vsADR Group.
2.3 抗肿瘤活性
MTT结果显示(图10),随着阿霉素和ADR-GL分子复合物中ADR浓度的升高,HepG2细胞活力逐渐下降,两组对HepG2的细胞活力影响在1 μmol/L处有明显差异(P<0.05),而其他浓度下均无显著性差异(P>0.05),其IC50值分别为5.940 μmol/L和6.385 μmol/L。
采用流式细胞仪检测ADR-GL分子复合物的肿瘤抑制作用。与阿霉素对照组相比,ADR-GL复合物能否改善MDA-MB-231乳腺癌干细胞群比的负作用(图11),MDA-MB-231乳腺癌干细胞群比在阿霉素对照组0.25,0.5,1 μmol/L占比分别为1.51%,2.56%,4.56%;在ADRGL复合物组(ADR∶GL=1∶2)0.25,0.5,1 μmol/L占比分别为1.41%,2.45%,4.31%,二者相比无明显差异。
3 讨论
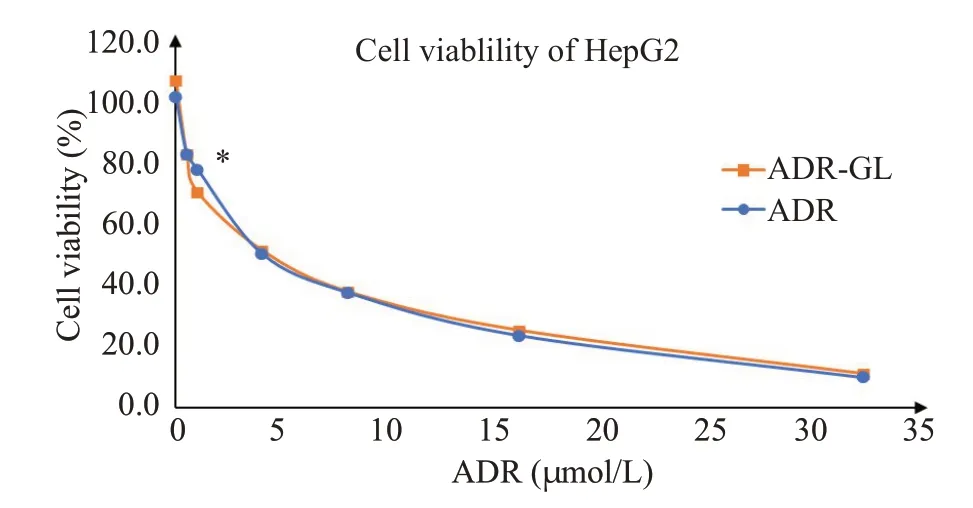
图10 ADR及ADR-GL分子复合物对HepG2体外增殖的影响Fig.10 Viability of HepG2 cells with ADR or ADR-GL treatment(concentration of ADR=0,0.5,1,4,8,16,and 32 μmol/L)for 24 h.
在中医基础理论中,甘草是调和诸药之王[14],而甘草酸则是来源于中药甘草的三萜类化合物,具保肝作用[15-17];阿霉素是一种蒽环类广谱抗肿瘤药物,其药代动力学结果[18-19]显示,它在体内的循环半衰期非常短,并且具有广泛的非选择性组织分布[20]。我们采用旋蒸法制备了ADR-GL分子复合物并对其进行了初步表征,初步证明阿霉素可能被甘草酸所包裹而以一种新的分子复合物的形式存在,且其中阿霉素的溶解度显著提高。
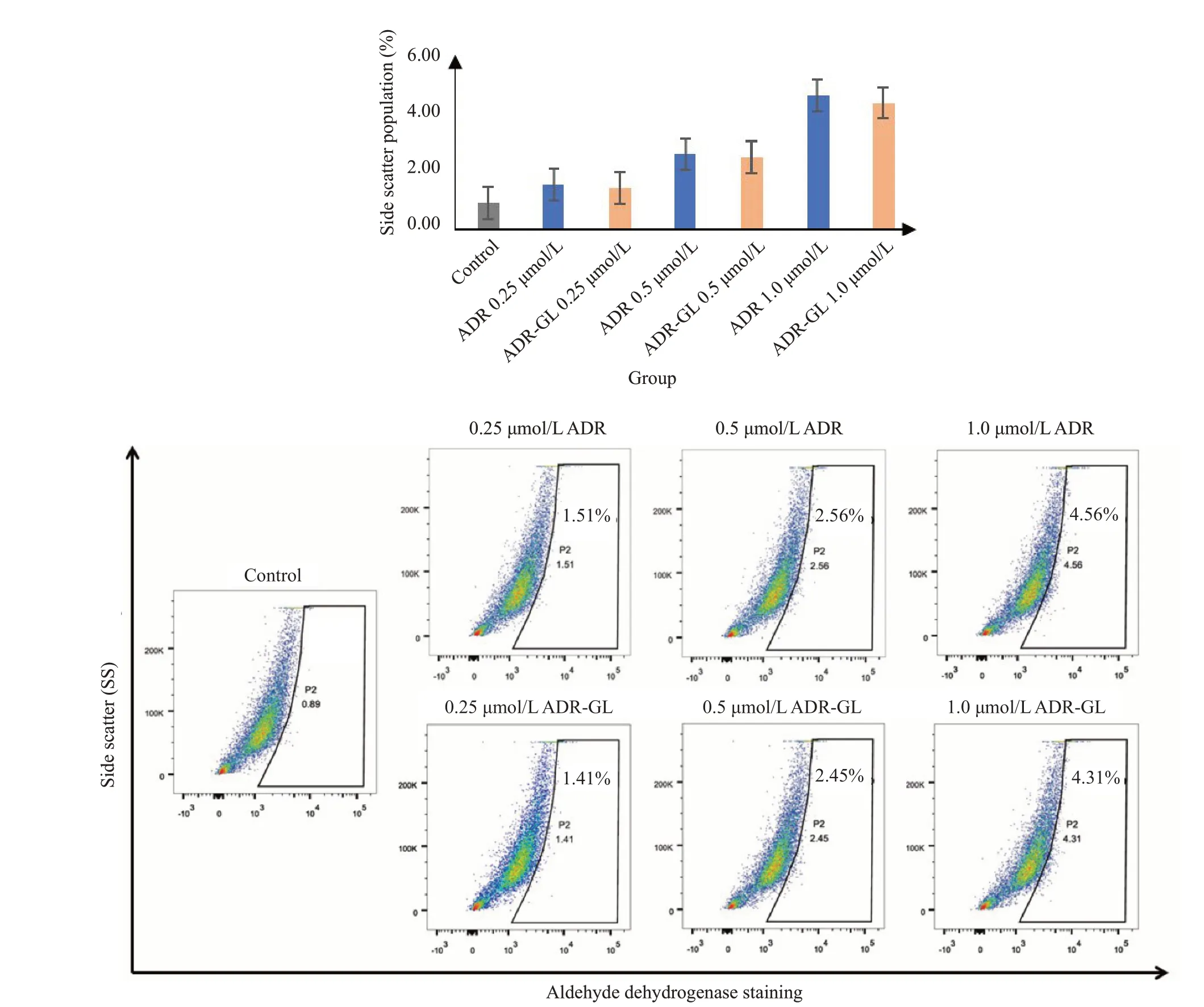
图11 ADR-GL复合物对MDA-MB-231乳腺癌干细胞群比的影响测定Fig.11 Determination of ADR-GLcomplex on MDA-MB-231 stem cell population ratio.
阿霉素又称多柔比星,临床上注射用盐酸多柔比星(辉瑞)适应症为急性白血病、淋巴瘤、软组织和骨肉瘤、儿童恶性肿瘤及成人实体瘤的治疗,尤其用于乳腺癌和肺癌。我们采用MTT法首先考察对比ADR和ADRGL分子复合物对肝癌细胞HepG2细胞增殖的直接作用,结果显示,ADR和ADR-GL分子复合物对HepG2的细胞活力影响在1 μmol/L处有明显差异(P<0.05),而其他浓度下均无显著性差异(P>0.05)。另一方面,肿瘤干细胞是肿瘤研究领域相对较新的概念,是指具有干细胞样的特征,能快速自我更新,逃避化疗、放疗抗肿瘤效果导致肿瘤的术后复发,在肿瘤细胞中占很小比例的细胞亚群[21-23]。乳腺癌的多种治疗方案如手术治疗、放射治疗、化学治疗等只能消灭肿瘤细胞,但肿瘤干细胞恶性程度高,能继续分化肿瘤细胞,是导致肿瘤预后差、肿瘤复发和转移的重要介质。因此,意图治愈肿瘤,清除处于非增殖期的肿瘤干细胞就成为恶性肿瘤治疗的首要[24]。MDA-MB-231细胞系是经典的乳腺癌细胞系[25-26],其分化差、恶性程度高、易复发转移且预后差,而研究表明这可能归因于MDA-MB-231细胞中干细胞比例较高[27]。因此,我们同时选择了MDA-MB-231干细胞作为研究对象比直接作用于肿瘤细胞更加具有实际意义。实验结果表明,ADR和ADR-GL分子复合物均增加MDA-MB-231 细胞的肿瘤干细胞负作用占比,与Control组无明显差异,我们笔者前期也已证实,甘草酸能够通过调节自噬流而降低阿霉素的心肌毒性[28],由此证明,甘草酸可以在一定程度上降低阿霉素的毒副作用而不影响其抗肿瘤能力。
本团队曾先后以甘草酸为载体构建了紫杉醇-甘草酸胶束[29]、鬼臼毒素-甘草酸胶束[30]和羟喜树碱-甘草酸胶束[5]等,其中甘草酸因其具有“两亲性结构”(疏水的甘草次酸+亲水性的葡萄糖醛酸),因此可作为一种“功能性载体”,既是药物载体[31-32],显著提高药物溶解度的同时,又提高了紫杉醇的口服生物利用度、鬼臼毒素的皮肤抗炎作用以及羟喜树碱的抗肿瘤活性等。本文则再次以甘草酸为载体,构建ADR-GL分子复合物,由于pH 7.4更符合健康人体血液pH值,过酸或者过碱都有可能干扰血管内膜的正常代谢和机能,因此为其作为一种静脉注射制剂提供参考[33]。甘草酸价格低廉,来源丰富易得,有望开发为一种新的“功能性载体”材料,在装载药物的同时发挥增效减毒[34-35]作用。我们的研究发现,ADR-GL分子复合物与阿霉素对照组的抗肿瘤活性无明显差异。由于我们前期研究发现,甘草酸能够通过调控HMGB1介导的自噬而减轻阿霉素心脏毒性[28],因此,本研究将为后续探究甘草酸增效减毒的机制提供一定的实验基础和科学依据。